牦牛尿嘌呤衍生物排出量对皱胃注射酵母RNA水平的响应
王虎成,叶得河,周建伟,龙瑞军*
(1.草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州730020;2.甘肃农业大学动物医学院,甘肃 兰州730070)
牦牛是分布在青藏高原及周边地区特有的家畜遗传资源。中国现有牦牛1 400多万头,约占世界牦牛总数的92%[1]。牦牛同当地藏族及其他少数民族的生产、生活、文化、宗教等有着密切的关系,发展牦牛业对提高藏族及其他少数民族的生活水平有着十分重要的意义。由于其独特的生物学特性,决定了牦牛是唯一能充分利用青藏高原天然草地资源进行动物性生产的牛种,因此在其分布地区具有不可替代的生态和经济学地位。特别是在地球生态环境日益恶劣、稀有物种不断消失的今天,以牦牛、藏羊为主体的高寒生态生产体系所具有的潜力及面临的危机,已引起了世人广泛的重视[2-5]。多年来,广大科研工作者在牦牛营养学方面进行了能量代谢[6-9]、瘤胃消化生理[10-12]、氮代谢及补氮技术的研究[8,13],填补了该畜种营养领域的空白。最近研究亦揭示了牦牛在牧食行为[14]、代谢物肾脏调控[15]和采食器官形态结构[16]诸方面有别于黄牛的高原适应机制,但受高原气候及牦牛生活习性的影响,传统营养学方法的应用正面临着挑战。Topps和Elliot[17]研究发现尿嘌呤衍生物排出量与小肠吸收微生物蛋白数量存在相关性,Verbic等[18]通过给阉牛皱胃连续灌注微生物核酸,发现有77%核酸以尿囊素和尿酸的形式被排出,通过皱胃注射嘌呤碱基,许多试验室已测定了注射嘌呤在尿中回收率,并进一步建立相关模型,基于此类模型,利用尿嘌呤衍生物估测瘤胃微生物产量模型亦被建立[19-24]。但模型的相关参数因动物种属及生境而存在差异[25-29]。基于牦牛所处生活环境的独特性,以及利用尿嘌呤衍生物估测瘤胃微生物产量模型的特异性,本研究旨在借助皱胃瘘管注射技术,以酵母RNA为嘌呤碱基供体,测定牦牛吸收嘌呤回收率,为建立快速、高效监测牦牛瘤胃微生物蛋白产量方法(purine derivative,PD法)奠定量化基础,以期改善放牧牦牛管理系统,使青藏高原草地生态系统服务功能[30]得以有效体现。
1 材料与方法
1.1 试验动物及皱胃手术
1.1.1 动物 2010年4月于天祝藏族自治县白牦牛产区选取体况相近的3头成年阉牦牛,在乌鞘岭试验站舍饲1周后进行皱胃瘘管手术,经30d康复后进行皱胃注射试验,试验期室内平均温度5℃,相对湿度为60%。
1.1.2 牦牛皱胃瘘管手术 皱胃瘘管:选择中国农业大学肉牛研究中心研制的中号T-型瘘管(内径1.7cm,高9.8cm,长9.7cm),对基部做适当修整,以利于更紧地贴于胃内壁。
术前准备:术前禁食24h,禁水12h。腹肋骨下缘皱胃区常规剪毛,术野面积为20cm×25cm,刮净毛茬。手术器械、纱布和创巾等均高压灭菌消毒,瘘管用温水配制的0.1%新洁尔灭溶液浸泡消毒。
麻醉与保定:首先拴系固定试牛头部,注射硫酸阿托品溶液2~5mL,15min后注射2% 静松灵5~10mL进行全身麻醉,使牛左侧卧倒下,将牛于蹄部分前后绑定,头部专人压定。手术人员常规消毒,术部先用5%的碘酊消毒,再用75%的酒精脱碘。然后于牛左、右侧均施行腰旁神经传导麻醉结合术部浸润麻醉。腰旁神经传导麻醉包括麻醉最后肋间神经、髂下腹神经和髂腹股沟神经。刺入点分别为第一腰椎横突游离端前缘、第二腰椎横突游离端后缘和第四腰椎横突游离端后缘,垂直皮肤进针,每点深达骨面后沿骨缘下行1.0cm后注入2%的普鲁卡因溶液10mL。在左侧预行切口线部位分两点注射0.5%的普鲁卡因20mL浸润麻醉。
瘘管安装:术野部做一与最后肋骨平行的10cm切口,用手术刀柄按肌纤维走向钝性剥离腹外斜肌、腹内斜肌和腹直肌,切开腹膜,打开腹腔,将手伸入腹腔找到皱胃,将其顺势小心拉出,用肠钳夹住皱胃,并用生理盐水浸泡的灭菌纱布绕其下部塞住切口。在皱胃腹侧部血管稀疏处做荷包缝合,于缝合圈内做一约4cm切口,置入瘘管底座,拧紧瘘管冒,双层荷包缝合,将肠道切口浆膜内翻,套上圆形夹片,以无菌生理盐水(每500mL生理盐水内加160IU青霉素和80IU链霉素)冲洗手术创口后还纳胃部于腹腔,逐层缝合肌肉大切口,在原切口皮肤层后方作一略小于直管外径(1.5cm)的小切口,用组织钳拉出瘘管,缝合皮肤大切口,随后用外夹片固定瘘管,创口外用碘酊进行常规消毒。
术后护理:肌注320万IU青霉素和100万IU链霉素,连续注射7d,每天2次。动物立即饮用温水,并在术后第1周喂以少量易消化的日粮,随后饲喂试验饲粮20d。术后当日开始每天于创口周围用酒精或碘酊棉球擦洗2遍。直到伤口愈合并拆线。
1.2 试验日粮及调制
试验期基础日粮由豌豆秸秆草粉、豌豆和青稞面构成,每头牛每天饲喂2.4kg全价饲粮,分别于8:00和17:00分2次饲喂。每次饲喂前按60%草粉+15%豌豆+34%青稞面+1%的复合添加剂(微量元素Co、Cu、I、Fe、Mn、Se、Zn含量依次为0.03,2.75,0.15,3.08,3.50,3.08,10.75mg/kg;维生素 A、D、E含量依次为921.0,251.0,6.4IU/kg)配比,加少量水拌匀后饲喂给试畜,试验期动物自由饮水。
1.3 嘌呤碱基
1.3.1 试剂 酵母 RNA (ribonucliec acid from torula yeast,Sigma R6625,CAS 63231-63-0)为嘌呤碱基(purine base,PB)供体,含量为1.4mmol PB/g RNA。
1.3.2 溶液配制及注射 于注射前1d配制注射液。称取一定量酵母RNA于400mL 0.1mol/L氢氧化钠溶液,40℃搅拌溶解,用蒸馏水定容至1 000mL,浓盐酸调节pH值为5~6,4℃储存至次日注射。用蠕动泵(BT00-100M)将PB溶液以0.7mL/min流速经皱胃瘘管注入动物体内。
1.4 试验设计
本试验参照Guerouali等[31]方案执行,分15d基础日粮适应期和20d注射期。其中注射期为4个处理(PB日均注射量分别为0,14,30,52mmol/d),2个重复,每个处理适应2d、采样3d,共4期合计20d。
1.5 样品采集及分析
依国际原子能机构(International Atomic Energy Agency,IAEA)试验程序全收集尿样[32];尿肌酐、尿嘌呤衍生物(尿囊素和尿酸)测定参照李晓鹏等[33]的方法;尿氮测定参照杨胜[34]的方法。
1.6 回收率计算
回收率 (%)=100×(PDi-PD0)/(PBi-PB0),式中,PDi为第i期尿嘌呤衍生物排出量;PD0为第1期尿嘌呤衍生物排出量;PBi为第i期嘌呤碱基注射量;PB0为第1期嘌呤碱基注射量;i=2,3,4。
1.7 数据分析
利用SPSS 13.0线性回归方法建立嘌呤衍生物排出量与注射嘌呤之间的等式。处理效应按程序GLM(general linear models)由多项式比较(polynomial contrasts)实现,显著水平为P<0.05。
2 结果与分析
2.1 试验动物体况
3头动物于第一期同时参加试验,2d预注射发现,其中1头动物应激性较强,故退出试验。另外2头动物整个注射期一切正常,且试验前后体重无明显变化。
2.2 牦牛皱胃嘌呤注射量与尿嘌呤衍生物排出量关系
在连续注射嘌呤碱基条件下,牦牛尿嘌呤衍生物由尿囊素和尿酸组成,且各试验期动物尿样未检出黄嘌呤和次黄嘌呤(表1)。回归分析发现,牦牛皱胃嘌呤注射量(X,mmol/d)与尿嘌呤衍生物排出量(Y,mmol/d)间存在如下关系:Y=0.85X+33.02(R2=0.96,n=8,P<0.001)。
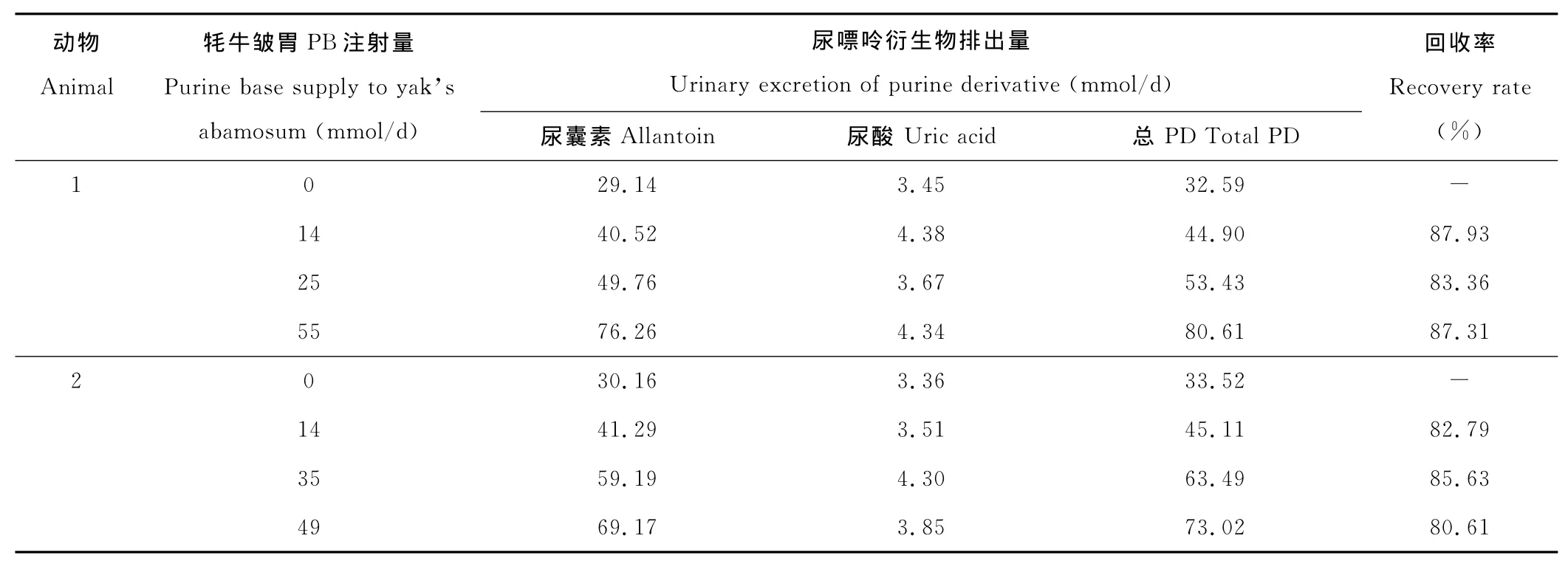
表1 牦牛皱胃嘌呤注射量与尿嘌呤衍生物排出量间关系Table 1 Urinary excretion of PD in relation to purine supply to abamosum in yak
2.3 牦牛皱胃嘌呤注射量对尿嘌呤衍生物、肌酐及尿氮排出量的影响
牦牛皱胃连续注射酵母RNA可导致尿中尿囊素(564~1 426μmol/kg BW0.75)(表2)、总嘌呤衍生物排出量(629~1 507μmol/kg BW0.75)及尿囊素占总PD比例(0.90~0.95)线性提高(P<0.01);尿酸所占比例(0.10~0.05)则线性降低(P<0.001);PB注射水平对尿酸、肌酐及尿氮排出量影响不显著(P>0.05)。

表2 牦牛皱胃嘌呤注射量对尿嘌呤衍生物,肌酐及尿氮日排出量的影响Table 2 Effect of abamosum purine infusion level on daily urinary excretion of purine derivatives,creatinine and nitrogen of yak
3 讨论
3.1 牦牛外源性嘌呤供给量对尿嘌呤衍生物组成的影响
本研究结果表明,牦牛连续注射嘌呤碱基并不影响尿嘌呤衍生物的组分(尿囊素和尿酸),且尿囊素为主要的构成部分(≥0.90),但其构成比例则会受到显著影响。总体趋势为随嘌呤碱基注射量的增加,尿囊素比例显著升高(P=0.002),而尿酸所占比例变化趋势与之相反(P<0.001)。下列研究也有类似的发现:Pimpa等[29]给黄牛(Bosindicus)十二指肠连续注射腺苷和鸟苷发现,随着PB注射量的增加(0~45mmol/d),尿囊素占总PD比例线性增加(0.75~0.90),尿酸所占比例线性降低(0.22~0.09);Chen等[19]给绵羊皱胃注射PB(0~45mmol/d),尿囊素占总PD比例线性增加(0.56~0.81),尿酸所占比例线性降低(0.27~0.10)。上述趋势基于嘌呤碱基在体内的代谢规律,亦即,进入血液的一部分外源性嘌呤通过补救合成途径合成核酸补充组织损失,而另一部分则被降解为嘌呤衍生物随尿排出体外,由于动物体绝大部分黄嘌呤氧化酶存在于肝脏和肠粘膜,当嘌呤碱基经过肠粘膜时被脱氨基氧化生成尿酸,因而动物通过补救合成组织核酸的几率很小,需经过直接合成途径以补偿组织的核酸损失,但是当动物被动的给予递增的外源补给量时,则利用外源性嘌呤合成体核酸以补偿代谢损失。因此利用PD估测反刍动物微生物蛋白产量时应以其总量为参数,而非单一尿囊素数值,尤其在饲养水平较低时更应如此。
3.2 牦牛外源性嘌呤供给量与尿嘌呤衍生物排出量关系
反刍动物血浆中嘌呤衍生物来源于体组织核酸的周转及从肠道吸收而未用于合成体组织的外源性嘌呤。尽管血浆中嘌呤衍生物可通过肾脏排出体外,也可通过非肾脏途径如唾液、奶和肠分泌物等分泌。大量研究结果表明,随外源性嘌呤供给量的增加,反刍动物尿嘌呤衍生物排出量亦线性提高。Belenguer等[35]给山羊注射0~17 mmol/d外源性嘌呤,则总尿嘌呤衍生物排出量从11.42增至26.07mmol/d;Chen等[19]给绵羊皱胃注射0~45 mmol/d PB,则PD排出量从2.06增至19.02mmol/d。更多的研究也表明尿中嘌呤衍生物的排出量与十二指肠核酸量或注入皱胃的核酸量相关,已建立的模型能很好地量化注入绵羊、山羊、牛皱胃或十二指肠中核酸量与嘌呤衍生物排出量间的关系[19-21,35]。与此同时,Chen等[19]和 Balcells等[20]相继发现,绵羊和山羊因体组织酶活差异性,用曲线模型更能确切地描述二者的关系,并指出吸收嘌呤在尿中的回收率为0.84,由吸收的外源嘌呤补救方式合成代替直接合成的速率常数为-0.25,当吸收的外源嘌呤量为0时,尿中排出内源嘌呤衍生物量为0.15 mmol/kg BW0.75。然而,由于牛血液及组织中黄嘌呤氧化酶的活性较高,尿中排出嘌呤衍生物的数量与吸收嘌呤的数量关系与羊不同。本研究嘌呤回收率(0.85)与早期他人研究结果:0.85[18,26],0.86[36],0.84[37]一致。Wang等[15]绝食代谢研究结果表明,牦牛内源性尿嘌呤衍生物日排出量为134μmol/kg BW0.75,基于本研究回收率参数,则牦牛吸收嘌呤(X,mmol/d)与尿嘌呤衍生物排出量(Y,mmol/d)的数学模型为:Y=0.85X+0.134kg BW0.75。
3.3 牦牛瘤胃微生物氮产量估测模型
Topps和Elliot[17]首次发现瘤胃内容物中核酸浓度与尿中尿囊素排出量呈正相关关系。进一步研究表明,由于日粮中核酸在瘤胃中快速降解,故进入十二指肠的核酸主要来自微生物,而微生物氮75%~85%以蛋白质、肽或游离氨基酸形式存在,15%~25%存在于核酸中[38,39]。Chen等[19]指出,应该使用总嘌呤衍生物(尿囊素、尿酸、黄嘌呤和次黄嘌呤,即PD在尿中的排泄量)作为估测参数,而非单一尿囊素,尤其当动物的采食量较低时更应如此。本研究结果发现牦牛尿囊素所占比例随嘌呤吸收量的增加而变化,进而表明利用总PD估测瘤胃微生物氮产量的合理性。Chen和Gomes[40]提出利用以下等式计算进入小肠的微生物氮(MN,g/d)流量:MN=(X×70)/(0.83×0.116×1000)=0.727X,式中,X为小肠所吸收的外源嘌呤数量;70指每毫摩尔嘌呤含70mg氮;0.83指微生物核酸的消化率;0.116指混合微生物中嘌呤氮占总氮的11.6%。Ellis和Pfander[41]指出,瘤胃细菌嘌呤氮与细菌总氮比值十分恒定,变化范围为10%~15%,Leng和Nolan[42]研究结果为8%~15%。韩兴泰等[10]指出在能蛋比例固定条件下,日粮精粗比和日粮氮源不会明显影响牦牛瘤胃细菌嘌呤氮与微生物总氮的比值,然而日粮粗蛋白质水平却显著影响该比值,当日粮粗蛋白质水平为12%时,瘤胃细菌粗蛋白质含量为37%,嘌呤氮占微生物总氮的比值为0.15,而当日粮粗蛋白水平降至8%时,瘤胃细菌粗蛋白质含量为29%,嘌呤氮占微生物总氮的比值为0.33。
本研究建立了牦牛吸收嘌呤与尿嘌呤衍生物排出量的数学模型,解决了利用尿嘌呤衍生物估测瘤胃微生物蛋白产量瓶颈问题,但受牦牛产区牧草产量及质量随季节而剧烈变化,牦牛瘤胃细菌嘌呤氮与细菌总氮比值参数亦不尽一致,已有模型并不完全适应于牦牛生产实际,相关研究有待进一步深入和完善。
[1]常祺,刘满香.青藏高原牦牛竞争力研究报告[J].青海畜牧兽医杂志,2002,32(6):22-25.
[2]柴永清,曹致中.草地农业生态系统4个生产层理论对肃北县畜牧业可持续发展的指导[J].草业科学,2010,27(4):160-164.
[3]周刊社,杜军,袁雷,等.西藏怒江流域高寒草甸气候生产潜力对气候变化的响应[J].草业学报,2010,19(5):17-24.
[4]李东,黄耀,吴琴,等.青藏高原高寒草甸生态系统土壤有机碳动态模拟研究[J].草业学报,2010,19(2):160-168.
[5]淡瑞芳,张海涛,龙瑞军,等.藏系绵羊瘤胃细菌数量及其放牧地牧草养分随季节变化的研究[J].草业学报,2009,18(1):100-104.
[6]韩兴泰,胡令浩.生长牦牛能量代谢的研究[J].青海畜牧业,1993,(1):13-16.
[7]胡令浩,谢敖云.不同海拔高度下生长牦牛绝食代谢的研究[J].青海畜牧兽医杂志,1992,22(2):1-5.
[8]董世魁,龙瑞军.不同采食水平下舍饲干奶牦牛能量转化,氮、钙和磷代谢的研究[J].草业学报,2000,9(2):32-37.
[9]韩兴泰,胡令浩.粗饲条件下生长牦牛能量代谢的估测[J].青海畜牧兽医杂志,1992,22(2):21-22.
[10]韩兴泰,胡令浩,谢敖云,等.牦牛瘤胃细菌中核糖核酸含量及其与细菌总氮比值的研究[J].动物营养学报,1998,10(2):35-39.
[11]李林,薛白.控释尿素对牦牛瘤胃氨氮和微生物蛋白质的影响[J].中国草食动物,2007,27(3):10-11.
[12]胡令浩,谢敖云.生长期牦牛瘤胃消化代谢的研究:II.饲喂氨化麦秸对牦牛瘤胃代谢的影响[J].青海畜牧兽医杂志,1989,(3):11-13.
[13]薛白,柴沙驼.生长期牦牛蛋白质需要量的研究[J].青海畜牧兽医杂志,1994,24(4):1-4.
[14]Ding L M,Long R J,Shang Z H,etal.Feeding behaviour of yaks on spring,transitional,summer and winter pasture in the alpine regionof the Qinghai-Tibetan plateau[J].Applied Animal Behaviour Science,2008,111:373-390.
[15]Wang H C,Long R J,Zhou W,etal.A comparative study on urinary purine derivative excretion for yak(Bosgrunniens),cattle(Bostaurus)and crossbred (Bosgrunniens×Bostaurus)in Qinghai-Tibetan plateau[J].Journal of Animal Science,2009,87:2355-2362.
[16]Shao B P,Long R J,Ding Y P,etal.Morphological adaptations of yak(Bosgrunniens)tongue to the foraging environment of the Qinghai-Tibetan Plateau[J].Journal of Animal Science,2010,88:2594-2603.
[17]Topps J H,Elliot R C.Relationship between concentrations of ruminal nucleic acids and excretion of purine derivatives by sheep[J].Nature(London),1965,2005:498-499.
[18]Verbic J,Chen X B,MacLeod N A,etal.Effect of microbial nucleic acid infusion on purine derivative excretion by steers[J].Journal of Agricultural Science,1990,114(3):243-248.
[19]Chen X B,Hovell F D,rskov E R,etal.Excretion of purine derivatives by ruminants:effect of exogenous nucleic acid supply on purine derivative excretion by sheep[J].British Journal of Nutrition,1990,63(1):131-142.
[20]Balcells J,Guada J A,Castrillo C,etal.Urinary excretion of allantoin and allantoin precursors by sheep after different rates of purine infusion into the duodenum[J].Journal of Agriculture Science,1991,116(2):309-317.
[21]Fujihara T,rskov E R,Reeds P J,etal.The effect of protein infusion on urinary excretion of purine derivatives in ruminants nourished by intragastric nutrition[J].Journal of Agricultural Science,1987,109(1):7-12.
[22]Antoniewicz A M,Pisulewski P M.Measurements of endogenous allantoin excretion in sheep urine[J].Journal of Agricultural Science,1982,98:221-223.
[23]Perez J F,Rodriguez C A,Gonzalez J,etal.Contribution of dietary purine bases to duodenal digesta in sheep[J].Animal Feed Science Technology,1996,62(4):251-262.
[24]Belenguer A,Yanez D,Balcells J,etal.Urinary excretion of purine derivatives and prediction of rumen microbial outflow in goats[J].Livestock Production Science,2002,77(2):127-135.
[25]Liang J B,Matsumoto M,Young B A.Purine derivative excretion and ruminal microbial yield in Malaysian cattle and swamp buffalo[J].Animal Feed Science and Technology,1994,47(4):189-199.
[26]Pimpa O,Liang J B,Jelan Z A,etal.Urinary excretion of duodenal purine derivatives in Kedah-Kelantan cattle[J].Animal Feed Science and Technology,2001,92(3):203-214.
[27]Vercoe J E.Urinary allantoin excretion and digestible dry-matter intake in cattle and buffalo[J].Journal of Agricultural Science,1976,86(3):613-615.
[28]Liang J B,Young B A.Comparative energetic efficiencies of male Malaysian cattle and buffalo[J].Livestock Production Science,1995,41(1):19-27.
[29]Pimpa O,Liang J B,Balcells J Q.Absorption of nucleic acid from the small intestines of swamp buffaloes and zebu cattle[J].Silpakorn Uuniversity Science and Technology Journal,2007,1(1):26-35.
[30]龙瑞军.青藏高原草地生态系统之服务功能[J].科技导报,2007,25(9):26-28.
[31]Guerouali A,Gass Y E,Balcells J,etal.Urinary excretion of purine derivatives as an index of microbial protein synthesis in the camel(Camelusdromedarius)[J].British Journal of Nutrition,2004,92(2):225-232.
[32]IAEA.Estimation of Basal Purine Excretion,in Estimation of Rumen Microbial Protein Production from Purine Derivatives in Urine[M].Vienna:International Atomic Energy Agency,1997:21-24.
[33]李晓鹏,周围,王虎成,等.高效液相色谱法对牦牛血浆与尿中嘌呤衍生物及肌酐含量的测定[J].分析测试学报,2009,28(7):867-861.
[34]杨胜.饲料分析及饲料质量检测技术[M].北京:农业大学出版社,1993.
[35]Belenguer A,Yanez D,Balcells J,etal.Urinary excretion of purine derivatives and prediction of rumen microbial outflow in goats[J].Livestock Production Science,2002,77(3):127-135.
[36]Vagnoni D B,Broderick G A,Clayton M K,etal.Excretion of purine derivatives by Holstein cows abomasally infused with incremental amounts of purines[J].Journal of Dairy Science,1997,80(8):1695-1702.
[37]Orellana B P,Balcells J,Martn-Orúe S M,etal.Excretion of purine derivatives in cows:Endogenous contribution and recovery of exogenous purine bases[J].Livestock Production Science,2001,68(3):243-250.
[38]Smith R H,McAllan A B.Nucleic acid metabolism in the ruminant:Amounts of nucleic acids and total and ammonia nitrogen in digesta from the rumen,duodenum and ileum of calves[J].British Journal of Nutrition,1971,25(1):181-190.
[39]McAllan A B.The fate of nucleic acids in ruminants[J].Proceedings of the Nutrition Society,1982,41(3):309-316.
[40]Chen X B,Gomes M J.Estimation of Microbial Protein Supply to Sheep and Cattle Based on Urinary Excretion of Purine Derivatives-an Overview of the Technical Details[M].Bucksburn Aberdeen:International Feed Resources Unit,1992.
[41]Ellis W C,Pfander W H.Rumen microbial polynucleotide synthesis and its possible role in ruminant nitrogen utilization[J].Nature,1965,205(4975):974-975.
[42]Leng R A,Nolan J V.Nitrogen metabolism in the rumen[J].Journal of Dairy Science,1984,67(5):1072.

