不同热应激条件下添加二氢吡啶对奶牛瘤胃发酵功能的影响
赵新茂,隋 晨,王肆玖,金尔光,才 航,易建明*
(1.华中农业大学动物科技学院,湖北 武汉 430070;2.武汉市畜牧兽医科学研究所,湖北 武汉 430065)
二氢吡啶(Dihydropyridine)的化学名称为2,6-二甲基-3,5-二乙酯基-l,4-二氢吡啶,其主要结构是l,4-二氢吡啶环和NH基。二氢吡啶是农业部首次批准在我国使用的兽药类促生长添加剂,现已列入农业部《兽药质量标准》2003年版中。大量研究表明,二氢吡啶能够抗氧化、保护生物膜,提高血清甲状腺素水平,提高促卵泡激素(FSH)和促黄体激素(LH)的含量,降低血清中皮质醇的含量,提高机体免疫力,促进矿物质的消化吸收等[1-6]。因此,二氢吡啶作为一种非营养性添加剂受到广泛关注。目前,国内外关于二氢吡啶在奶牛上的研究主要有其对产奶量,乳中成分,产奶量及抗氧化的影响等,李成会等[7]在奶牛精料补充料中添加150mg/kg二氢吡啶,试验结果表明,产奶量提高6.19%。陈桂荣等[8]在奶牛精料补充料中添加100mg/kg二氢吡啶,结果试验组奶牛日平均产奶量提高了8.6%(P<0.01),平均乳脂率提高了21.9%(P <0.05),而且添加二氢吡啶后,奶牛健康状况有了很大的改善。朱莲英等[9]在奶牛日粮中添加150mg/kg二氢吡啶,产奶量也提高了5.65%,隐性乳房炎的发病率降低了71.4%。曹杰[10](2010)在商品浓缩料和自配精饲料中添加0.02%二氢吡啶,提高了血浆中SOD、GSH-Px、CAT酶活力,减少脂质过氧化产物MDA的产量。而二氢吡啶对热应激奶牛瘤胃发酵状态影响的研究报道极少。因此,本试验拟通过研究饲粮中添加二氢吡啶对热应激奶牛瘤胃发酵功能的影响,为二氢吡啶在对抗奶牛热应激领域的合理应用提供理论依据。
1 材料与方法
1.1 试验材料
二氢吡啶(DHP,纯度≥98%),购自武汉市合中生化制造有限公司。
1.2 试验动物及试验设计
试验动物根据胎次(3.0±0.05)、产奶量(20.52±0.33kg)、体重相近(504.0±6.0kg)的原则,选取6头泌乳中期(104.8±12.0d)健康的中国荷斯坦奶牛。试验采用随机区组实验设计。试验有两因素,因素一为氧化应激状态(Stress):春季无应激和夏季应激;因素二为二氢吡啶添加量(二氢吡啶添加剂量参照农业部《兽药质量标准》2003年版),分别为0.0g/(头·d)和3.0g/(头·d)。试验设计见表1。

表1 试验设计
1.3 试验饲粮及饲养管理
本试验在湖北省武汉市畜牧兽医科学研究所金口基地奶牛养殖场进行。奶牛饲养方式采用双列对头固定颈夹式饲养,舍内配备卧床,奶牛自由采食、自由运动。各处理组之间除有无添加二氢吡啶不同外,奶牛饲养管理一致。喂料方式为先粗后精,人工饲喂。每日饲喂3次,分别于07:00、13:00和19:00饲喂,每次喂料结束后散放到运动场自由运动,饮水槽保证足够清洁的饮水。每天挤奶2次,每次均记录产奶量,每月一次DHI测定。使用时将二氢吡啶先与少量精料混匀,再逐级扩大直至与所有饲料混匀,因二氢吡啶本身极易氧化,所以在试验过程中采取随制随喂的方法,以期获得最理想的效果。试验基础日粮组成及营养水平见表2。
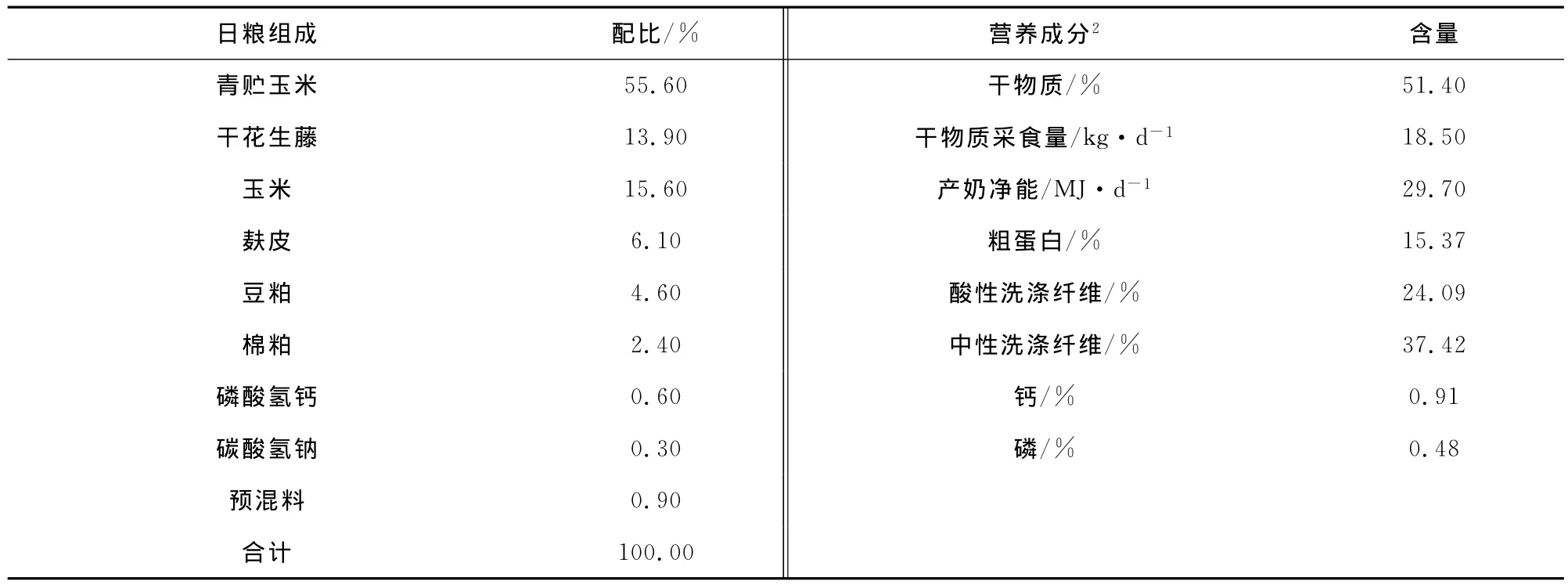
表2 试验基础日粮组成及营养成分表1
1.4 样品采集
试验分春季和夏季两个阶段,每个阶段两个时期,全部动物试验共计4个时期(NS-ND,无应激不添加二氢吡啶;NS-D,无应激添加二氢吡啶;S-ND,应激不添加二氢吡啶;S-D,应激添加二氢吡啶),每个时期15d。试验周期安排见图1。

图1 试验周期
每期饲养试验结束后,于第14d的13:00和第15d的7:00、10:00采集瘤胃液样品(瘤胃穿刺法)30mL左右,即饲喂后的6h和饲喂前0h、3h采集共3次,-20.0℃冰箱中保存备用。
1.5 测定指标及方法
pH采用Sartotius普及型pH计测定(PB-10);NH3-N浓度的测定参照冯宗慈等[11]比色法;VFA浓度的测定按照曹庆云等[12]气相色谱法。通过监测环境温湿度变化来评价奶牛的热应激状况。将干湿球温度表悬挂于奶牛走道和卧床上方,距地面2 m,室内和室外各3个,试验期间每天在8:00、14:00和20:00记录温湿度表读数,并换算为THI即温湿指数。THI计算公式为:THI=0.72(Td+Tw)+40.6,其中Td为干球温度,Tw为湿球温度。
1.6 数据处理与统计分析
试验数据采用Excel软件整理,SAS 8.1软件处理,用双因素方差分析中的GLM过程。
2 结果与分析
2.1 试验期间牛舍环境状况及THI的变化
试验期间牛舍温湿环境状况及THI变化结果见表3、图2a/b。
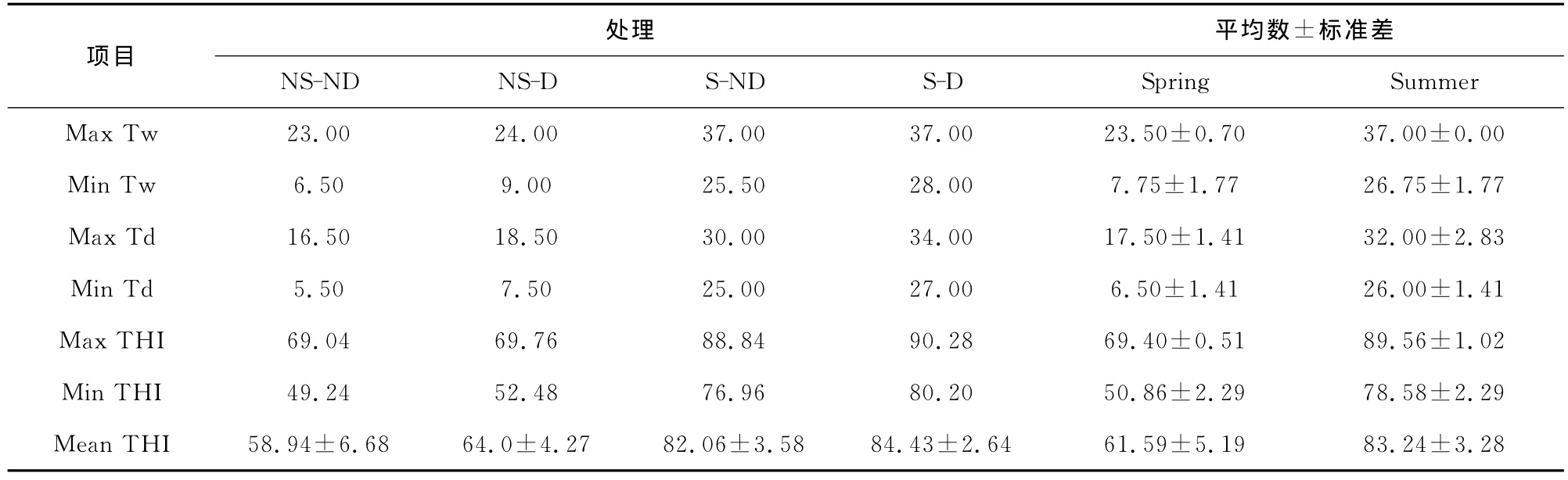
表3 试验期间牛舍温热环境状况
由表3可知,春季牛舍最高温度24.0℃,最低温度6.5℃;湿度范围5.5~18.5(即51%~95%的湿度);THI的范围为49.24~69.76。而夏季牛舍最高温度37.0℃,最低温度25.5℃;湿度范围为25.0~34.0(30%~95%的湿度);THI指数的范围为76.96~90.28。

图2a 春季室内THI指数变化
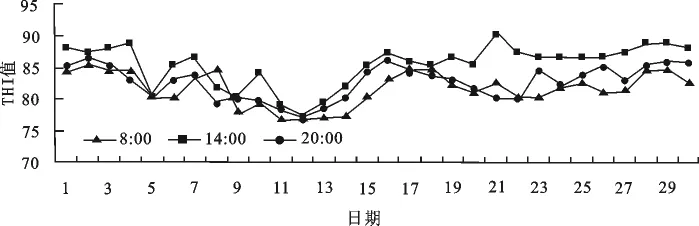
图2b 夏季室内THI指数变化图2a/b 试验期间牛舍温湿指数变化
由图2a/b可知,春季每天3个测定时间的THI都低于69.80,而夏季每天3个测定时间的THI值都高于76.96。另外,从图中可以看到,春季早中晚的温差较小,而夏季较大;并且在一天之中,THI的基本变化趋势为中午>晚上>早上。
2.2 不同应激水平下添加二氢吡啶对奶牛瘤胃液发酵参数的影响
瘤胃发酵参数可以反应瘤胃的发酵模式和饲料在瘤胃内的发酵程度。不同应激水平下添加二氢吡啶对奶牛瘤胃液发酵参数的影响见表4。
2.2.1 不同应激水平下添加二氢吡啶对奶牛瘤胃pH的影响 各时期试验奶牛的瘤胃液pH值均在6.00~7.20之间,均处于正常范围内,可以保证瘤胃微生物的正常代谢。S-ND时期与NS-ND时期相比,瘤胃液的pH值显著下降(P<0.01)。添加二氢吡啶,可降低瘤胃液的pH值,在夏季添加二氢吡啶未达到显著水平。热应激和二氢吡啶对pH值的影响不存在互作。
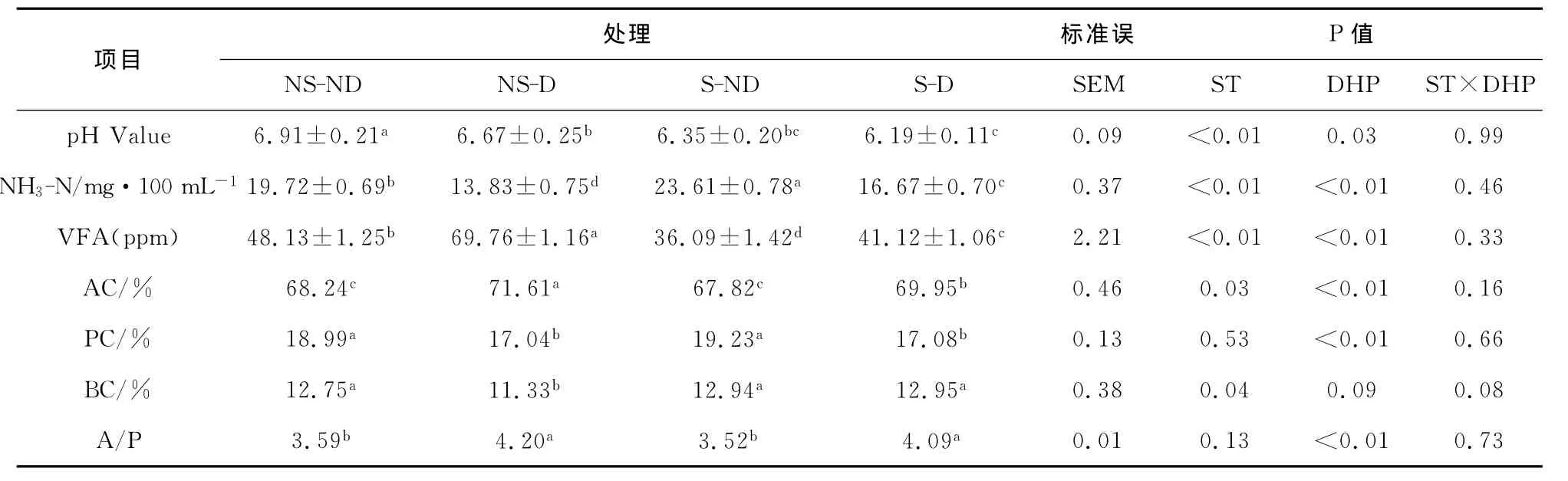
表4 不同应激水平下添加二氢吡啶对奶牛瘤胃液发酵参数1的影响
2.2.2 不同应激水平下添加二氢吡啶对奶牛瘤胃液NH3-N浓度的影响 从表4可知春季和夏季添加二氢吡啶后,NH3-N浓度均极显著降低(P<0.01),下降幅度分别为29.8%和29.4%。S-ND时期与NS-ND时期相比,瘤胃液中NH3-N浓度呈升高的趋势,且差异显著(P<0.01)。即应激提高了瘤胃液中NH3-N的浓度,而二氢吡啶降低了NH3-N 的浓度。
2.2.3 不同应激水平下添加二氢吡啶对奶牛瘤胃液VFA的影响 从表4可知,S-ND时期与NS-ND时期相比,瘤胃液VFA的浓度极显著下降(P<0.01),下降幅度为25.0%。添加二氢吡啶可以显著提高VFA的浓度,在春季和夏季均达到极显著水平(P <0.01),分别提高了31.0%和12.2%。随应激水平的升高,乙酸、丙酸和丁酸三者的百分含量呈现出不一致的变化趋势,其中乙酸的百分比含量下降,而丙酸和丁酸的百分比含量升高。添加二氢吡啶后,乙酸百分含量有所升高,春季和夏季均达到显著水平,升高幅度分别为3.37%和2.13%。丙酸和丁酸的百分含量则呈相反的变化趋势,丙酸的百分含量在春季和夏季添加二氢吡啶后,均下降且差异极显著(P<0.01),丁酸的百分含量在春季添加二氢吡啶后下降,夏季时有上升的趋势,但差异不显著。S-ND时期与NS-ND时期相比,乙丙比呈下降趋势,但差异不显著(P=0.13),在春季和夏季添加二氢吡啶后均极显著增高(P<0.01)。说明添加二氢吡啶可以改变瘤胃的发酵模式。热应激和二氢吡啶对瘤胃液发酵参数的影响不存在互作效应。
3 讨论
3.1 牛舍环境温湿度的变化
温热环境是指家畜周围空气中的温暖、炎热与寒冷,它由空气的温度、湿度、气流速度和太阳热辐射等温热因素综合而成。环境温湿度的变化常常导致奶牛处于应激状态,用来衡量奶牛是否处于热应激状态的常用且实际操作方便可行的办法就是测定环境指标。常用的环境指标主要有环境温度、温湿指数、体感温度等。温湿指数是结合了温度和湿度两个因素来综合评价环境状况的指标,是用于评定奶牛是否处于热应激的一个重要参数。
根据美国堪萨斯州立大学和美国新泽西州立大学的研究结果表明,当温湿指数THI≥72时,奶牛即处于热应激状态。当THI≥78时,奶牛处于严重热应激状态。目前该评价标准已得到各国研究人员的广泛认可(Michael B,2005)[13]。由上述结果和分析可知,本试验在春季(THI=49.24-69.76)奶牛无热应激,在夏季(THI=76.96-90.28)牛舍内温湿环境对试验奶牛构成热应激。即在整个试验期内外界温热环境对奶牛构成的应激状况完全符合试验的要求。
3.2 奶牛瘤胃液pH值和NH3-N的变化
瘤胃始终维持着相对稳定的厌氧环境,瘤胃内pH值的稳定是保证瘤胃正常发酵的基础。影响瘤胃内pH值的因素主要有反刍动物唾液中的缓冲盐含量、瘤胃内VFA的浓度、瘤胃对VFA的吸收速度等。过高和过低的瘤胃pH值不利于保证瘤胃内环境的稳定,对瘤胃微生物正常生长和繁殖也是不利的。随着应激水平的升高,奶牛的瘤胃液pH值呈 下 降 趋 势,这 与 Bhatta(2006)[14]、Kristensen(2004)[15]的报道一致。因为纤维在体内的消化和代谢会产生更多的热量,所以奶牛会本能的减少对粗料的采食,这会导致奶牛实际采食的日粮中精粗比例发生变化,精料比例相对升高,所以导致的结果就是乙酸产量下降,pH值降低。本试验中瘤胃液的pH值在6.00~7.20之间,均处于正常范围内,可以保证瘤胃微生物的正常生长代谢。瘤胃内微生物氮源的主要来源是NH3-N,瘤胃内NH3-N的浓度直接反映了微生物氮的供应情况。瘤胃中约三分之一的细菌在生长过程中必需NH3-N,约有一半以上的细菌以NH3-N为唯一氮源。若瘤胃内NH3-N浓度过低,则瘤胃微生物的生长受到抑制,瘤胃内微生物蛋白的合成也会受阻;若瘤胃内NH3-N浓度过高,则会降解为大量的氨,经瘤胃壁吸收最终进入肝脏代谢,造成氮源的浪费又使多余的NH3-N进入肝脏降解,加重了机体代谢氮的负担。本试验中各时期奶牛的NH3-N浓度均呈现一定的变化规律:在进食逐渐上升,然后下降至进食前的水平。各时期试验牛的瘤胃 NH3-N 在11.08~24.80mg/100mL之间,均在5.0~28.0mg/100mL的正常范围内,能够保证瘤胃微生物蛋白的正常合成。本试验中,添加二氢吡啶后,奶牛瘤胃内的NH3-N浓度呈下降趋势,但处于正常的浓度范围内,推测二氢吡啶可促进瘤胃微生物蛋白质的合成,且能够改善较高浓度的NH3-N对奶牛机体的不利影响,提高饲料的利用率。
3.3 奶牛瘤胃液VFA的变化
在反刍动物体内最为重要的VFA是乙酸、丙酸和丁酸,正常情况下瘤胃内产生的这三种酸占到95%以上,而这些VFA又以乙酸为主,占VFA的70%左右,这三种酸都是反刍动物重要的能量来源。粗纤维发酵降解最终生成乙酸,乙酸和丁酸主要用于合成脂肪,丙酸则主要由精饲料发酵降解生成,主要用于合成葡萄糖。本试验中热应激显著降低了瘤胃液中 VFA的浓度,这与Bandaranayaka(1976)[16]的研究结果一致,推测VFA浓度的降低应归因于DMI的下降(Kiyoshi Tajima,2007)[17],奶牛的采食量下降,瘤胃内可利用的能量减少,影响了瘤胃内微生物的数量和活性。同时乙酸的百分含量下降,这与Bernabucci(1999)[18]的研究结果一致。瘤胃内AC/PC的比值呈下降的趋势。即热应激改变了瘤胃的发酵模式。添加二氢吡啶后VFA的浓度有显著的增高趋势,同时也显著提高了乙酸丙酸比,降低了丙酸和丁酸的比例。
4 结论
热应激导致奶牛瘤胃液pH值下降,NH3-N浓度升高,VFA的浓度降低,同时乙酸的百分含量下降,丙酸和丁酸的百分含量小幅上升。添加二氢吡啶有降低瘤胃pH值的趋势,但均在瘤胃微生物活动的适宜范围内;降低NH3-N的浓度,促进了瘤胃对NH3-N的利用;提高VFA的产量和乙酸丙酸比。
[1] 边连全,袁 丹,刘显军,等.二氢吡啶对育肥猪生长性能、肉品品质及肌肉组织抗氧化性能的影响[J].河南畜牧兽医,2009,30(5):5-7.
[2] 申 超,袁 缨,崔 雷,等.二氢吡啶对肉仔鸡生长性能和抗氧化性能的影响[J].中国家禽,2009,31(8):25-26.
[3] 武现军,李成会,庞新位,等.二氢吡啶对雏鸡免疫功能的影响[J].中国兽医学报,2000,20(4):386-389.
[4] 曹 丹,罗光彬.日粮中添加二氢吡啶对雄性小鼠生殖激素的影响[J].黑龙江动物繁殖,2005,13(l):6-7.
[5] 贾 斌,石月英,王志祥,等.二氢吡啶对绵羊小肠移行性综合肌电的影响[J].石河子大学学报(自然科学版),2001,5(3):228-230.
[6] 刘 琴,高俊波.二氢吡啶在畜牧业生产中的应用概况[J].饲料广角,2003,19(9):44-48.
[7] 李成会,王继龙,朱莲英,等.二氢吡啶在奶牛养殖中的应用研究[J].中国奶牛,2004,22(1):21-23.
[8] 陈桂荣,王宏岩,贾文娟,等.应用二氢吡啶饲喂奶牛效果观察[J].黑龙江畜牧兽医,2004,47(10):25-26.
[9] 朱莲英,李成会,贾久满,等.二氢吡啶对奶牛隐性乳房炎防治作用的研究[J].饲料工业,2004,25(7):60-62.
[10] 曹 杰.日粮中添加二氢吡啶对奶牛生产性能、抗氧化和抗热应激能力的影响[D].硕士学位论文.湖北武汉:华中农业大学,2010.
[11] 冯宗慈,高 民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学,1993,21(4):40-41.
[12] 曹庆云,周武艺,朱贵钊,等.气相色谱测定羊瘤胃液中挥发性脂肪酸的方法研究[J].中国饲料,2006,17(24):26-28.
[13] Michael Brouk.Evaluating and selecting cooling systems for different climates.Proceeding of the 7th Western Dairy Management Conference.Reno,2005,9:33-40.
[14] Bhatta R,Tajima K,Kurihara M.Influence of temperature and pH on fermentation pattern and methane production in the rumen simulating fermenter(RUSITEC).Asian Aust J.Anim Sci,2006,19:376-80.
[15] Kristensen N B,Harmon D L,et al.Splanchnic metabolism of volatile fatty acids absorbed from the washed reticulorumen of steers.J.Anim Sci,2004,82:33-42.
[16] Bandaranayaka D D,Holmes C W.Changes in the composition of milk and rumen contents in cows exposed to a high ambient temperature with controlled feeding.Tropical Animal Health and Production,1976,8:38-46.
[17] Kiyoshi Tajima,Itoko Nonaka,Kouji Higuchi,et al.Influence of high temperature and humidity on rumen bacterial diversity in Holstein heifers,Anaerobe,2007,13:57-64.
[18] Bernabucci U,Bani P,Ronchi B,et al.Influence of short and long term exposure to a hot environment on rumen passage rate and diet digestibility by Friesian heifers.J.Dairy Sci,1999,82:967-973.

