山生柳SSR-PCR反应体系优化
郭 敏,李 毅,马彦军
(甘肃农业大学林学院,甘肃 兰州730070)
山生柳(Salix oritrepha)属杨柳科柳属多年生灌木,主要分布于海拔3 000~3 700m的高山山脊、山坡[1],是高寒灌丛群落的主要优势种之一,常与高山绣线菊(Spiraea alpina)、金露梅(Potentilla fruticosa)、沙棘(Hippophae rhamnoides)、甘肃杜鹃(Rhododendron potaninii)、窄叶鲜卑花(Sibiraea angustata)、锦鸡儿(Caragana sinica)等组成高寒灌丛[2]。山生柳也是防护林、薪炭林、水土保持林及用材林的重要造林树种,是重要的能源林树种,具有较高的生态和经济价值[3]。
简单重复序列(Simple Sequence Repeat,SSR)分子标记是近年来迅速发展起来的建立在PCR精确扩增基础上的第二代分子标记[4]。SSR分子标记技术在小麦(Triticum aestivum)[5]、水稻(Oryza sativa)[6]、大豆(Glycine max)[7]等农作物基因图谱的建立上的应用已初具成效。近几年来甘肃农业大学“东祁连山高寒灌丛生态系统特征及放牧管理策略”项目组对祁连山脉的山生柳资源进行了较多研究,并对分布于张掖境内核桃沟的山生柳进行了梯度式考察取样并作了细致的群落调查[8-9]。目前,在分子方面对高寒山生柳遗传多样性及基因漂流方面的研究相对较少,高效的山生柳SSR-PCR反应体系及其优化方法的研究也未见报道。鉴于以上因素,本研究测试和优化山生柳SSR-PCR反应体系中每个组合及成分的浓度,利用正交设计分析法,及单一因素分析法建立并优化适宜山生柳遗传分析的高效稳定的SSR-PCR技术体系,以期为SSR标记在山生柳的遗传多样性分析、功能基因比较、重要性状定位等方面的应用奠定基础和提供依据。
1 材料与方法
1.1 样地设置与取样方法 在全面勘察祁连山山生柳分布情况的基础上,选择山生柳分布较为广泛的祁连山自然保护区作为试验区,首先在海拔2 800~3 500m范围内设样线,在各样线上沿海拔梯度大约每100m设置16m×16m的样地1块。然后在各地内,对山生柳进行取样。
取样时,分别取健康植株当年生枝条上的嫩叶、嫩芽和种子,供后续DNA检测用。所有材料均用液氮保存带回。SSR-PCR体系优化选取4个海拔梯度进行,海拔从高到低依次为:1号取样地(P1),海拔3 520m;3号取样地(P3),海拔3 380m;5号取样地(P5),海拔3 281m;7号取样地(P7),海拔3 220m。引物设计来自 http://www.ornl.gov/sci/ipgc/ssr_resource.htm(USA),由北京天埂集团公司合成。
1.2 山生柳不同组织基因DNA的提取及比较 采用CTAB法对不同海拔梯度山生柳基因组DNA 进行 提取[10],提取 了嫩芽、嫩叶、种 子的DNA,以期选取最优质的DNA。用紫外分光光度法和琼脂糖凝胶电泳法检测其质量,稀释到所需浓度后置于-20℃冷藏。
1.3 PCR扩增反应和聚丙烯酰胺凝胶电泳检测 PCR的预扩增程序参考冯亮亮等[11]的试验步骤,稍作改动。94℃先预变性45s,然后94℃变性30s,引物SHUK123退火温度56℃,退火45s,再72℃延伸10min,循环数30个,最后72℃延伸5 min,扩增产物需尽快电泳,否则在4℃进行保温。用8%聚丙烯酰胺凝胶电泳跑胶,用固定液,银染液处理胶片检测PCR的产物[12]。

表1 SSR反应体系中各因素及其水平Table 1 Factors and levels in SSR reaction
1.4 SSR-PCR体系优化 采用P1海拔的山生柳母本DNA为体系优化模板,P2、P3、P4为检验模板。引物SHUK123上游:ATCGCATTTGTTCTTGAATCT;下游:GCTTAGGGTCTCTGTGGTGAG。选用L9(34)正交设计(表2),结合单因子试验对PCR反应的Taq酶、Mg2+、dNTPs、模板浓度4个因素的3个水平进行试验[13],并对反应的扩增程序进行优化,对PCR反应的变性时间、退火时间、延伸时间、循环数4个因素的3个水平进行试验(表3)。对正交结果和单因素得到的结果进行综合性直观分析,得到山生柳SSR-PCR反应各因素的最佳水平。
1.4.1 SSR-PCR 各组分体系优化正交试验 依照L9(34)正交表(表2)对4个因素的3个不同水平进行试验,对每个水平的处理进行重复性试验3次。PCR产物经8%变性聚丙烯酰胺凝胶电泳[14]跑胶,并染色拍照保存,供后续试验数据的分析。
1.4.2 单因子试验 在单因子反应中采用的初始反应体系,各组分添加浓度:0.5μmol·L-1上下游引物各2μL;DNA 模板1μL,30ng左右;0.5U 的Taq聚合酶1μL;2.5mmol·L-110×PCR Buffer 2μL;0.2mmol·L-1dNTPs 2.5mmol·L-1Mg2+;加ddH2O调整体系最终体积至20μL。
在SSR-PCR反应体系中分别对4个因素的影响进行分析(表1),每个组合设3个重复。每当其中一种水平进行变化时,体系中其他成分的水平保持不变。产物电泳检测方法和扩增的程序与正交试验相同。对跑胶的结果进行直观评价,同时将单因子试验的结果与正交试验结果进行综合分析比较,从而在正交和单因子水平两个方面建立山生柳SSR-PCR反应的最优体系。
表2 PCR反应体系组分的正交试验设计Table 2 Orthogonal design of PCR reaction system
1.4.3 SSR-PCR 扩增程序优化的正交试验 在SSR-PCR反应中,PCR扩增时的关键因素,如变性时间、退火时间、延伸时间及循环数对扩增的优劣起到了重要的作用。采用优化后的反应体系进行PCR扩增反应,本试验的扩增程序优化同样选用L9(34)正交试验设计(表 4)。产物检测方法与1.4.2相同,对结果进行直观分析,从而确定最终的PCR反应程序。
1.4.4 退火温度的优化 引物SHUK123的退火温度确定为(55±4)℃,设退火梯度(不同退火温度分别设置),PCR仪自动形成1~12个梯度,确定最佳退火温度。
2.1 阴道镜诊断与组织病理诊断结果的比较 98例病理诊断典型病例中,慢性宫颈炎7例(7.14%),CIN 75例(76.53%,包括CINⅠ29例,CINⅡ28例,CINⅢ18例),宫颈癌(均为宫颈鳞癌)16例(16.33%)。阴道镜下对慢性宫颈炎、CINⅠ、CINⅡ、CINⅢ及宫颈癌的诊断符合率分别为100.00%、93.10%、89.29%、88.89%及100.00%。见表1。

表3 PCR扩增程序中各因素及其水平Table 3 Factors and levels in the PCR procedure
1.4.5 上样量对电泳检测结果的影响 SSR-PCR体系建设的优劣关键在于扩增程序的掌控和反应体系浓度的大小,与上样量的多少没有直接的关系。而本试验在进行跑胶电泳检测时,发现上样量的大小对反应的优劣同样起关键作用,于是对扩增产物的上样量做了6个不同的处理,分别为1~6μL,用于测定上样量的不同对跑胶结果的影响。
2 结果
2.1 DNA提取结果 以嫩芽为材料所提的DNA量最多,没有蛋白质、无机盐及RNA等杂质,质量最好;嫩叶所提DNA量稍少于嫩芽,且有微量杂质,可能由于山生柳属于高海拔植物,其自身蜡质含量高;种子提出的DNA量较少,含有少量蛋白质和无机盐,且RNA较多,质量比嫩叶的差;果实所提的DNA量最少,杂质最多,质量最差(因为果实质量很差,基本拍不出图像,山生柳果实很难采取,不适合提取DNA)。试验结果显示(图1),嫩芽和嫩叶是提取DNA的最理想材料,并且在质量和数量上均能满足SSR扩增的需要,其次为老叶、种子、果实。综合上述,采用CTAB法可以提取高质量的DNA。

图1 3种材料山生柳组织DNA提取电泳图Fig.1 Electrophoresis of DNA of three Salix oritrepha materials
2.2 反应组分正交设计电泳结果 编号1、2、3、4、6、8的水平组合中都可以扩增出谱带,但编号1、2、3组合扩增谱带目标带不明显,拖尾比较严重。同时编号4、6组合的谱带较弱,几乎看不清谱带的扩增情况。编号5、7、9的组合几乎扩增不出谱带,一般可排除扩不出目标带的组合认为。编号8的组合扩增谱带最清晰且分辨率较高,综合比较,编号8的扩增带最好,条带清晰,非特异带少,颜色较深,即Taq酶 1.0U·μL-1,Mg2+2.0mmol·L-1,dNTP 0.1mmol·L-1,DNA 浓度 20ng·μL-1(图3)。
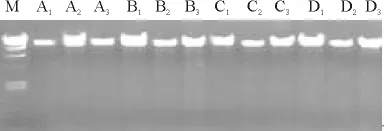
图2 不同海拔山生柳DNA电泳图Fig.2 Electrophoresis of DNA of Salix oritrepha
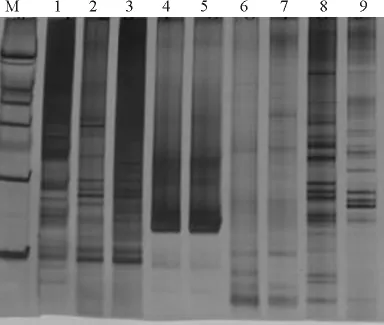
图3 SSR-PCR反应正交设计电泳结果Fig.3 Electrophoresis of SSR-PCR by orthogonal design
2.3 单因子试验结果分析
2.3.1 Taq聚合酶对山生柳SSR-PCR 扩增的影响
扩增谱带的依次减弱是因为酶的用量有所减少而导致的,Taq酶用量在0.5U时条带最清晰且没有拖尾现象,从而确定Taq酶的最佳用量为0.5U(图4)。
2.3.2 Mg2+浓度对山生柳SSR-PCR扩增的影响

图4 反应体系中各因素在不同浓度下对3 520m处山生柳PCR产物的影响Fig.4 Effects of factors in orthogonal design on the PCR production of Salix oritrepha from an altitude of 3 520m
2.3.3 dNTPs浓度对山生柳SSR-PCR扩增的影响
3种不同浓度dNTPs下扩增的结果优劣有明显差异,浓度过低会没有谱带(图4)。因此,确定0.10 mmol·L-1为山生柳20μL反应体系中的最佳浓度。
2.3.4 DNA浓度对山生柳扩增的影响 随着DNA模板浓度的升高,扩增条带弥散现象比较严重,同时出现拖尾现象。因而采用20ng·μL-1的DNA浓度即可。以上结果显示,单因子试验可以对反应体系中每一个因素的不同水平进行比较直观的分析,而对各个因素水平的组合实验可以利用正交设计。在单因子试验中,与正交试验相比,其余的组分浓度基本相同,只有酶的用量略有降低,为0.5U。综合两种试验结果,确定山生柳20μL SSR-PCR反应体系中几个关键的影响因子分别为0.5UTaq聚合酶,2.0mmol·L-1Mg2+,0.10mmol·L-1dNTP,20ng·μL-1DNA模板。
2.4 反应程序的正交试验设计电泳结果
SSR-PCR反应程序正交设计9个组合的扩增显示(图5),扩增谱带的深浅、优劣不同,原因是变性时间、退火时间、延伸时间以及循环数的组合不同。编号2、3、6组合的谱带较弱,编号4、5组合没有扩出目标带。编号1、7、8、9组合都可以扩增出较清晰谱带,但1、8、9组合扩增背景不清,较弥散并且带有杂带,颜色较深。综合正交试验结果和以往经验,得出第7组为反应程序最佳方案,即变性时间45s,退火时间45s,延伸时间30s,循环数30个。

图5 SSR-PCR反应程序的正交试验设计电泳结果Fig.5 Electrophoresis of SSR-PCR by orthogonal design
2.5 不同退火温度的优化 在梯度试验中引物SHUK123基本上均能扩增出条带,但在56℃时扩增出的带型整齐、清楚,特异带明显,无拖尾现象(图6),此温度与引物两条链的较低的理论熔解温度[Tm=2(A+T)+4(G+C)]相近。而在59℃时产生了一定的弥散现象,条带拖尾比较严重。故采用56℃退火温度即能得到很好的扩增结果。综上所述,山生柳优化后的反应程序:94℃高温预变性时间3min,94℃变性45s,Tm退火时间45s,72℃延伸30s,循环数30个,最后72℃后延伸时间5min,4℃保温。
2.6 不同上样量对聚丙烯酰胺电泳结果的影响 在8%的丙烯酰胺凝胶上,上样4μL以下的条带由于染色背景较浅,扩增的分子量相差较小,所以无法显示。上样量大于5μL时背景颜色太深,产生弥散效果。上样5μL效果最好,条带较清晰,区分度强,目标带明显(图7)。因此最佳上样量最佳为5μL。
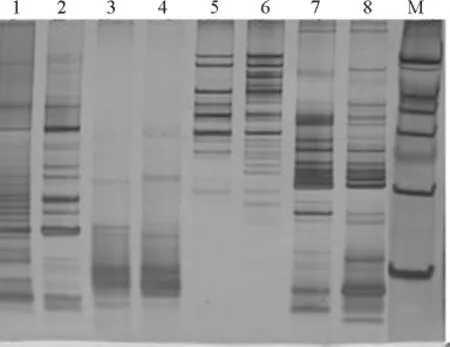
图6 引物不同退火温度的电泳图Fig.6 Electrophoresis of SHUK123with different annealing temperatures

图7 不同上样量对聚丙烯酰胺电泳结果的影响Fig.7 Effects of loading amount on the polyacrylamide gel electrophoresis
2.7 体系优化后的扩增结果 综上利用优化后的SSR-PCR反应体系对4个不同海拔山生柳材料进行了PCR扩增,各海拔梯度的扩增条带均很清晰,每个泳道有谱带15~22条,反应体系的特异性、可重复操作性和稳定性较好(图8)。这表明不同海拔的山生柳品种优化后的体系是稳定可靠的。谱带的丰富性从另一方面也反映了山生柳具有较丰富的遗传多样性。

图8 用优化体系对4个海拔梯度山生柳扩增的结果Fig.8 Amplification results of Salix oritrepha from 4altitudes with optimized system
3 讨论
山生柳是我国祁连山脉特有高寒防御树种,筛选其SSR引物及建立优化的反应体系是SSR-PCR的关键所在,这也是SSR分子标记多态性应用的必要环节和基础[15]。但在影响扩增优劣的各个影响因子中,由于SSR反应体系所含组分比较繁多,各组分的含量大小和反应时间长短均可能对扩增的产物及跑胶的优劣产生影响[16]。所以本研究中采用正交试验设计和单因子试验综合考虑的方法,可有效地节省试验时间并节约成本,对SSR-PCR试验的有效性和严谨性提供了支持[17]。
PCR反应的扩增效率及谱带的优劣是反应体系中各因素综合作用的结果,各因素要综合考虑。Taq酶用量是其中的重要因子,它直接影响扩增结果和产物多态性的检出率、重复性和有效性。Mg2+浓度是影响Taq酶活性的主要因子,Mg2+浓度过高会使非特异性扩增产物增加,过低则造成扩增产物减少,甚至不能扩增。这是因为Mg2+是TaqDNA聚合酶的激活剂,其浓度的高低不仅影响引物与模板的结合效率和产物的特异性,而且还会影响酶的活性和扩增的可靠性,所以Mg2+的浓度大小直接影响了反应的特异性和扩增片段的产率[18-19]。本研究结果是在2.0mmol·L-1时扩增产物最清晰,Mg2+为2.5mmol·L-1时扩增结果不稳定,由于高浓度Mg2+影响了Taq酶的活性,所以适当降低Mg2+的浓度有助于扩增的效果。
引物浓度和质量也会直接影响PCR扩增结果的优劣,如果引物浓度过高会产生非特异性扩增,还会增加背景的弥散程度导致拖尾现象的产生[20]。浓度过高的dNTPs会竞争 Mg2+,降低游离 Mg2+浓度,从而导致扩增效果不理想,而当组分含量dNTPs的浓度过低时会影响SSR-PCR扩增的效率。
在各种影响因素中,考虑适宜的退火温度也是关键所在,它会影响反应的准确率和扩增效果。退火温度过低会促使引物二聚体的产生,杂带太多,对结果分析产生影响。而当退火温度过高时,模板与引物在扩增过程中不能积极退火,反应迟缓无法继续进行;扩增结果显示,有的引物(WPMS13、WPMS14)在退火温度为55℃时没有扩增带,退火温度降到50℃时就能扩增出产物。值得注意的是,引物在有些情况下没有扩增出来产物也是其多态性的体现。一般可以以Tm值为PCR退火温度[21]。当引物两条链的Tm不同时,可以以平均值为准或适当降低其退火温度也会得到很好的特异性条带。总之,在SSR-PCR扩增中,应综合考虑各因素的组分浓度和反应时间,从而加强扩增的有效性和结果检验的真实性。
[1] 吴海艳,马玉寿,王彦龙,等.黄河源区山生柳灌丛草甸植物群落多样性及植物量组成[J].草业科学,2008,25(5):55-59.
[2] 王芳,陈文业,才让卓玛,等.高寒区山生柳硬枝扦插灰色系统理论分析研究[J].草业科学,2010,27(9):86-90.
[3] 关传友.中国植柳史与柳文化[J].北京林业大学学报(社会科学版),2006,5(7):8-15.
[4] 解新明,卢小良.SSR和ISSR标记及其在牧草遗传与育种研究中的应用前景[J].草业科学,2005,22(2):30-35.
[5] 陈新民,何中虎,史建荣.利用SSR标记进行优质冬小麦品种(系)的遗传多样性研究[J].作物学报,2003,29(1):13-19.
[6] 杨官品,张启发.水稻——多拷贝微卫星DNA多态性分析[J].遗传,1998,20(2):27-30.
[7] 海林,王克晶,杨凯.半野生大豆种质资源SSR位点遗传多样 性 分 析 [J].西 北 植 物 学 报,2002,22(4):751-757.
[8] 李毅,胡自治,王志泰.东祁连山高寒地区山生柳种群分布格局研究[J].草业学报,2002,11(3):49-54.
[9] 王志泰.东祁连山高寒阴湿地区山生柳种群年龄结构和空间分布格局[D].兰州:甘肃农业大学,2001.
[10] 刘恩英.簸箕柳×绵毛柳遗传框架图谱的构建[D].南京:南京林业大学,2008.
[11] 冯亮亮,唐红,李毅,等.甘肃红砂不同种群遗传多样性的ISSR分析[J].草业学报,2011,20(1):125-129.
[12] 张道远,张元明,曹同.耐寒苔藓植物DNA提取及优化RAPD、ISSR 反应体系 的建立 [J].中国沙 漠,2006,26(9):827-831.
[13] 易金鑫,侯喜林,冷月祥.茄子基因组DNA提取及RAPD-PCR体系的优化[J].江苏农业科学,2004(3):50-52.
[14] Liu Y,Chen H Y,Wei Y T,et al.Construction of a genetic map and localization of QTLs for yield traits in tomato by SSR markers[J].Progress in Natural Science,2005,15(9):793-797.
[15] 常宏,王汉宁,张金文,等.玉米品种真实性和纯度鉴定的SSR标记多重PCR体系优化[J].草业学报,2010,19(2):204-211.
[16] 沈紫微,陈本建,康俊梅,等.红豆草ISSR体系优化及其在航天诱变种质鉴定中的应用[J].草业科学,2010,27(12):66-71.
[17] 郑轶琦,王志勇,郭海林,等.正交设计优化假俭草SRAP-PCR反应体系及引物筛选[J].草业学报,2008,17(4):110-117.
[18] 何庆元,吴萍,张晓红,等.不同秋眠性苜蓿SRAP体系优化及遗传多样性分析[J].草业学报,2011,20(2):201-209.
[19] 乔玉山,章镇,房经贵,等.李种质资源ISSR反应体系的建立[J].果树学报,2003,20(4):270-274.
[20] 王志勇,袁学军,刘建秀,等.狗牙根SRAP-PCR反应体系优化及引物筛选[J].草业学报,2008,17(3):79-85.
[21] 刘晓丽,何天明,张美勇,等.核桃SSR反应体系的优化[J].果树学报,2007,24(2):140-145.

