基于叶绿体atpB-rbcL序列探讨猬草属和赖草属植物的系统发育和母系起源
刘静,张海琴,凡星,沙莉娜,曾建,周永红,4*
(1.四川农业大学成都校区小麦研究所,四川 成都611130;2.四川农业大学生命科学与理学院,四川 雅安625014;3.四川农业大学成都校区资源与环境学院,四川 成都611130;4.四川农业大学作物基因资源与遗传改良教育部重点实验室,四川 成都611130)
小麦族(Triticeae)是禾本科(Poaceae)植物中十分重要的类群,既包含有重要的粮食作物如小麦(Triticum aestivum)、大麦(Hordeum vulgare),也有许多优良的牧草资源如羊草(Leymus chinensis)和老芒麦(Elymus sibiricus)等[1]。基于麦类作物和牧草资源的开发、生态保护与重建的需要,理清小麦族内物种分类问题及系统发育关系尤为重要。
猬草属(Hystrix)是小麦族的一个多年生小属,Moench[2]根据颖强烈退化或缺失的特征以Hystrix patula为模式种建立。根据Baden等[3]的分类系统,猬草属有6种3变种:Hystrix patula、猬草(H.duthiei)、长芒猬草(H.duthiei ssp.longearistata)、H.duthiei ssp.japonica、东北猬草(H.komarovii)、高丽猬草(H.coreana)、H.sibirica和H.californica。L9ve[4]认为猬草属模式种 H.patula具有与披碱草属(Elymus)相同的StH染色体组组成,将猬草属作为披碱草属的一个组处理。然而,Jensen和 Wang[5]根据染色体组分析结果认为,高丽猬草和H.californica含有与赖草属(Leymus)植物相同的NsXm染色体组组成,并将它们组合到赖草属中。Zhang等[6]根据细胞遗传学和染色体组原位杂交资料,报道H.patula含有StH染色体组,而猬草和长芒猬草含有NsXm染色体组。Ellneskog-Staam等[7]通过基因组原位杂交(GISH)和Southern杂交分析认为,猬草、长芒猬草和高丽猬草含有Ns1Ns2染色体组,而东北猬草具有与猬草属模式种H.patula相似的StH染色体组。因此,猬草属不是一个单系类群,自建属以来,属的界限和分类地位以及物种的染色体组组成,一直处于争论之中。
赖草属是小麦族中重要的多年生异源多倍体属,该属植物约有30个种,从北海的沿岸地区,越过中亚到东亚直至阿拉斯加和北美西部的广阔地域均有分布。赖草属物种倍性变化从四倍体(2n=4x=28)到十二倍体(2n=12x=84),由2个基本的染色体组Ns和Xm组成[1,8]。通过形态学观察、染色体组分析及分子资料分析,认为Ns染色体组来源于新麦草属(Psathyrostachys)[1,4,8-12],而 Xm 染色体组的来源尚不确定[8]。迄今为止,来源于拟鹅观草属(Pseudoroegneria)的St染色体组[13]、冠麦草属(Lophopyrum)的Ee染色体组[14]、Eb染色体组[4]、新麦草属的Ns染色体组[15]、冰草属(Agropyron)的P染色体组和旱麦草属(Eremopyrum)的F染色体组[11-19]被推测是Xm染色体组的供体来源。
细胞核基因资料已广泛应用于小麦族植物的遗传多样性和系统进化研究[11,16-18],而细胞质基因组具有单拷贝及母系遗传的特征,在植物系统与进化研究中具有更好的利用价值。rbcL、ndhF、trnL-F等叶绿体基因或基因间隔区序列已成功应用于研究小麦族赖草属、披碱草属等类群的系统关系、网状进化及母系起源问题[19-23]。Sha等[19]利用单拷贝核基因DMC和叶绿体trnL-F分子序列对猬草属和赖草属系统分析时发现,猬草属物种具有不同的母本起源,猬草、长芒猬草及欧亚分布的赖草属植物的母本来源为新麦草属植物,高丽猬草和东北猬草与北美分布的赖草的母本来源可能是冰草属的P染色体组。Liu等[20]根据ITS及叶绿体trnL-F序列分析发现:欧亚分布的赖草属植物母本起源为新麦草属,而北美分布的赖草属植物母本来源仍然未知,但推测不为新麦草属。
叶绿体atpB-rbcL序列是位于编码ATP合成酶β亚基和核酮糖1,5二磷酸羧化酶大亚基基因之间的非编码区域,Nishikawa等[24]利用该序列探讨了大麦属的系统与进化。本研究利用叶绿体atpB-rbcL序列对猬草属及其近缘属植物进行系统发育分析,主要目的在于:1)分析猬草属和赖草属植物的系统关系;2)探讨猬草属与赖草属植物可能的母本起源。
1 材料与方法
1.1 供试材料
供试材料共46份,包括5个猬草属物种、来自北美、中亚及青藏高原的22个赖草属物种、2个披碱草属物种,以及来自小麦族8个不同基本染色体组的17个二倍体材料,包括4个新麦草属(Ns染色体组)、2个拟鹅观草属(St染色体组)、2个大麦属(Hordeum,H染色体组)、3个冰草属(P染色体组)、2个旱麦草属(F染色体组)、反颖南麦(Australopyrumretrofractum,W 染色体组)、簇毛麦(Dasypyrumvillosum,V 染色体组)、长穗冠麦草(Lophopyrumelongatum,Ee染色体组)、百萨冠麦草(L.bessarabicum,Eb染色体组)等物种。旱雀麦(Bromus tectorum)作为外类群。所有材料的物种名称、采集编号、来源及GenBank号列于表1。染色体组符号依照Wang等[8]的命名标准。所有材料均种植于四川农业大学小麦研究所多年生种质圃,凭证标本藏于四川农业大学小麦研究所标本室(SAUTI)。
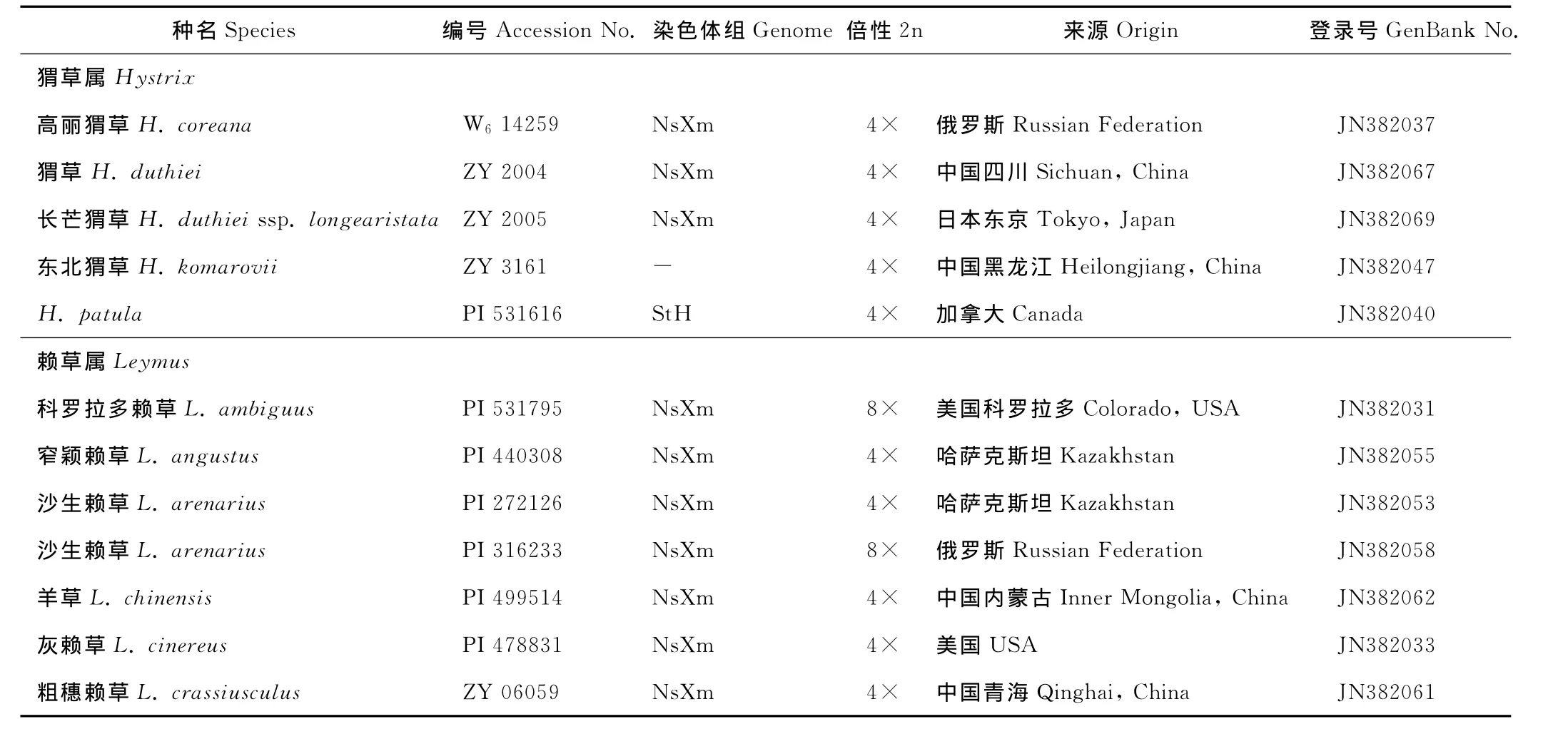
表1 供试材料Table 1 The materials used in this study

续表1 Continued
1.2 DNA提取、扩增和测序
DNA提 取 采 用 改 良 的 CTAB 法[25]。PCR 扩 增 引 物 序 列 为 P1:5′-ACATCGTAAGTACGTGGACCAATAA-3′和P2:5′-TTGGATTCTAAAGCTGGTGTT-3′[24]。PCR扩增反应在 ABI 9700型PCR仪上进行。反应体积为50μL,包括3μL DNA模板(约0.5μg,由Gel Doc图像分析仪测得),10×ExTaq缓冲液(5μL),2.5mmol/L MgCl2(4.0μL)、2.5mmol/L 4种dNTP混合液(pH 8.0)(4.0μL)、15μmol/L正、反向引物(各1.5μL),5U/μL ExTaq酶(0.6μL)和ddH2O(30.4μL)。PCR反应条件为:94℃预变性4min;94℃变性1min,50℃复性1min,72℃延伸2min,35个循环;最后72℃延伸10min。PCR产物用1.2%的琼脂糖进行电泳,用OMEGA试剂盒(OMEGA Bio-Tek)进行割胶回收。然后,以pMD18-T载体(Takara)为连接载体,DH10B作为宿主菌,对目的片段进行克隆。每份材料选取3~5个阳性克隆用于DNA序列测序。序列测定由上海华大生物技术有限公司完成。所有序列均进行双向测序。DNA提取到测序完成于2009年3-11月。
1.3 基因序列分析
根据新麦草(Psathyrostachys juncea)的atpB-rbcL序列(GenBank序列号 AB078409)[24]对本研究获得的序列进行确认。采用DNAMAN软件包(version 5.2.10;Lynnon Biosoft,http://www.lynnon.com)对序列进行多重排定后再辅以手工校正,并进行序列长度变异、插入/缺失(Indel)分析。序列的碱基组成及替代用MEGA 4.0(Kumar S,Tamura K,Jakobsen I,Nei M,http://www.megasoftware.net)进行统计。序列变异位点采用PAUP4.0b10(Swofford D L,Sinauer Associates,http://www.sinauer.com)进行统计。基于转换和颠换与遗传距离的线性关系,采用DAMBE(V4.1.33)[26]替代饱和性分析,选用的进化模型是F84。
1.4 系统发育分析
系统发育分析采用最大简约法(maximum parsimony,MP)和贝叶斯推断(bayesian inference,BI)。MP分析由PAUP4.0b10Win(Swofford,2003)软件进行,采用启发式(Heuristic)搜索,gap作为缺失(missing)处理,数据随机添加(addseq=random),重复次数(nreps)为100,树等分与重连分之交换法(TBR)构建系统树,计算50%多数一致树和严格一致树,并采用1 000次重复抽样(replicates)的自展分析(bootstrap,BS)来检验。贝叶斯推断采用 MrBayes 3.1.2[27]软件分析。利用 Modeltest 3.7[28]进行模型和参数估计,基于hLRT 标准选择的最适碱基替代模型是 K81UF。BI分析中,4条马尔可夫链式反应(Markov Chain Monte Carlo,MCMC)运行1 500 000代,以随机树为起始树,每100代取样1次,开始的250个样本作为老化样本(burn-in samples)舍弃,剩下的树用于构建50%多数一致性树(BI树),并以后验概率(posterior probability,PP)来评估其拓扑结构的有效性。
2 结果与分析
2.1 序列分析
叶绿体atpB-rbcL基因间隔区序列长度变异为773~813bp,平均GC含量30.5%。所有序列排序后共得到831个排列位点,其中保守位点764个,可变位点46个,简约信息位点21个。序列饱和性分析显示转换和颠换与遗传距离F84呈线性关系(图1),表明不同序列和不同位点间突变没有达到饱和,可用于系统发育分析。
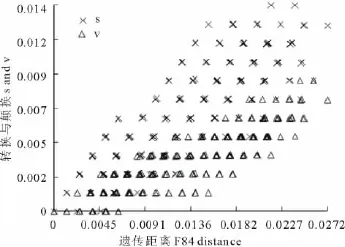
图1 atpB-rbcL序列的饱和性检测结果Fig.1 Substitution saturation analysis of atpB-rbcL
2.2 系统发育关系
采用MP和BI两种方法构建atpB-rbcL系统发育树。MP分析获得1 632棵最大简约树,树长(tree length)为72,一致性指数 CI(consistency index)为0.944 4,保持性指数 RI(retention index)为0.966 7,50%多数一致性树与通过BI分析得到的系统发育树的拓扑结构基本一致。图2显示的是BI系统发育树。
在构建的BI树中,所有供试物种分别聚为A、B两个分支。分支A包括:2个猬草属物种(猬草、长芒猬草)、4个新麦草属物种、所有欧亚分布的赖草属物种以及来自北美的滨麦(L.mollis),统计支持率(97%PP,65%BS),羊草位于该分支底部。分支A中的物种其atpB-rbcL序列上均含有1个5bp的ATATA插入。分支B中,猬草属模式种H.patula与含StH染色体组的加拿大披碱草(E.canadensis)聚为姊妹支(支持率为100%PP,85%BS),再与含St染色体组的穗状拟鹅观草(P.spicata)、拟鹅观草(P.strigosa),以及簇毛麦(V)、长穗冠麦草(Ee)和百萨冠麦草(Eb)聚为亚支Ⅰ;冰草属(P染色体组)、旱麦草属(F染色体组)物种和反颖南麦(W染色体组)聚为亚支Ⅱ;3个北美赖草无芒赖草(L.triticoides)、灰赖草(L.cinereus)、盐生赖草(L.salinus)聚为亚支Ⅲ;剩下的2个猬草属物种(高丽猬草、东北猬草)、2个北美分布的赖草属物种新枝赖草(L.innovatus)、科罗拉多赖草(L.ambiguus)以及2个大麦属物种布顿大麦(H.bogdanii)、智利大麦(H.chilense)与3个亚支形成平行分支(图2)。
3 讨论
3.1 猬草属和赖草属植物的系统关系
猬草属因以其颖退化乃至缺失的形态特征区别于小麦族其他属,Baden等[3]认为猬草属是一独立有效的属。然而,染色体组分析和分子系统学研究表明:模式种H.patula含StH染色体组,东北猬草具变异的StH染色体组,而猬草属的猬草、长芒猬草和高丽猬草含有与赖草属一致的NsXm染色体组[5-7,29,30]。
本研究中,猬草属物种聚成不同的分支。猬草属模式种H.patula与披碱草属(StH染色体组)及拟鹅观草属(St染色体组)物种聚为一支,表明H.patula与披碱草属植物有较近的亲缘关系,支持细胞学及分子系统学研究结果[18,23,29,30],将H.patula组合到披碱草属中。猬草、长芒猬草、高丽猬草和东北猬草则与新麦草属(Ns染色体组)和赖草属(NsXm染色体组)聚在一起,表明该4种猬草属物种与新麦草属和赖草属植物的系统关系较近,支持猬草、长芒猬草、高丽猬草含NsXm染色体组,并将它们组合到赖草属中的分类处理[5,6]。
关于东北猬草的染色体组组成,有不同的报道。Ellneskog-Staam等[7]认为东北猬草的染色体组组成为StH;而分子系统学研究及染色体组特异RAPD分析表明,东北猬草与含Ns染色体组的新麦草属和赖草属亲缘关系较近[30-32]。本研究中,东北猬草与高丽猬草及北美分布的赖草属物种聚在一支,而没有与含StH染色体组的披碱草属及H.patula聚类,表明东北猬草与赖草属物种关系较近,而与含StH染色体组的披碱草属物种亲缘关系较远。
猬草和长芒猬草与柴达木赖草(L.pseudoracemosus)等中亚分布的赖草属物种及含Ns染色体组的新麦草属物种聚为一支,高丽猬草、东北猬草则与北美分布的赖草属物种处于另一分支,表明猬草、长芒猬草与中亚分布的赖草属物种关系更为紧密,而高丽猬草和东北猬草与北美分布的赖草属物种关系密切。单拷贝核基因DMC1和Acc1的分子数据也显示赖草属物种存在欧亚和北美类群的差异[11,19]。Fan等[11]对世界范围内的赖草属植物分子系统与进化研究推测:北美赖草属植物很可能是从东亚经由白令陆桥向北美扩散的。从地理分布上看,高丽猬草、东北猬草处于欧亚大陆东端,与白令海峡接近。本研究结果也表明高丽猬草、东北猬草与北美赖草具有较近的亲缘关系。
Wen[33]指出相似的生境可能产生相似的选择压,从而导致物种形成相近的形态变异。猬草属植物常生长于温暖、潮湿的自然环境中,含不同染色体组组成的物种其形态上的相似可能是自然选择中趋同进化的结果。
3.2 猬草属和赖草属植物可能的母本起源
细胞遗传学资料表明:H.patula含有与披碱草属植物相同的StH染色体组,其中St染色体组起源于拟鹅观草属,H染色体组来源于大麦属[1,4,29]。在本研究中,H.patula与含StH染色体组的披碱草属及拟鹅观草属(St)物种聚为一支,表明H.patula及披碱草属的母本供体为拟鹅观草属植物。本研究结果与前人对披碱草属母本来源的研究结果一致[21,34,35]。同时,拟鹅观草属物种与含Ee、Eb及V染色体组的物种聚为一支,表明拟鹅观草属的St染色体组和长穗冠麦草的Ee染色体组、百萨冠麦草的Eb染色体组及簇毛麦的V染色体组关系密切,这一结果与基于叶绿体trnL-F序列对相关类群进行的聚类结果一致[20,36]。
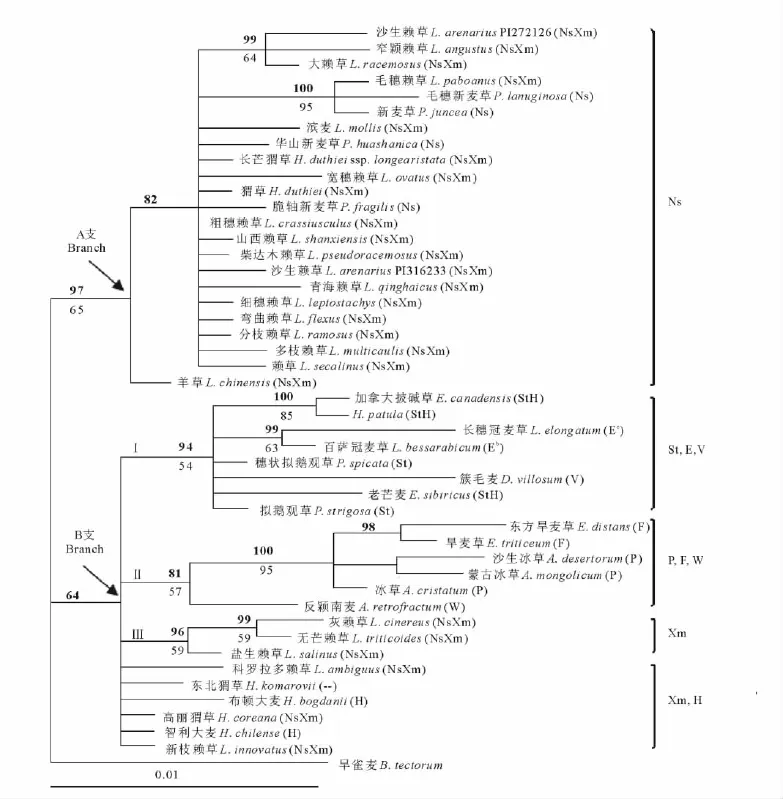
图2 atpB-rbcL序列的BI系统发育树Fig.2 BI tree inferred fromatpB-rbcL sequences
Sha等[19]和Liu等[20]基于叶绿体trnL-F序列的分析,认为猬草属及赖草属物种的母本起源存在多元性。Sha等[19]认为猬草、长芒猬草及欧亚分布的赖草属植物的母本来源为新麦草属植物,高丽猬草和东北猬草与北美分布的赖草的母本来源可能是冰草属的P染色体组。Liu等[20]研究认为欧亚分布的赖草属植物母本起源为新麦草属,而北美分布的赖草属植物母本来源仍然未知,但推测不为新麦草属。本研究中,具NsXm染色体组的物种其叶绿体atpB-rbcL序列明显聚为2个分支,其中:猬草、长芒猬草及所有欧亚分布的赖草属物种与4个新麦草属植物聚为一个分支(Ns支),而高丽猬草、东北猬草和5个来自美洲的赖草属物种处于另一分支。结果表明猬草、长芒猬草及欧亚分布的赖草属物种以新麦草属(Ns)作为母本供体,而高丽猬草、东北猬草及北美分布的赖草属植物的母本来源可能为Xm染色体组。由于Xm染色体组确切的二倍体供体物种未知,所以高丽猬草、东北猬草及北美分布的赖草属植物的母本来源还有待进一步研究。
本研究中,来自北美的滨麦在atpB-rbcL序列上缺少其他北美赖草所共有的7bp(TGAAAAA)的插入片段,而和欧亚赖草聚在一起。从地理分布看,滨麦不仅分布于北美,也广泛分布于中国北方沿海地区、俄罗斯远东地区、朝鲜和日本[37];从形态上看,滨麦与欧亚的沙生赖草(L.arenarius)、大赖草(L.racemosus)形态相似,甚至曾作为沙生赖草的亚种ssp.mollis处理[38]。因此,尽管滨麦来自北美,但与欧亚赖草有更近的亲缘关系,其母本供体仍为Ns染色体组。
[1] Dewey D R.The genome system of classification as a guide to intergeneric hybridization with the perennial Triticeae[A].In:Gustafson J P.Gene Manipulation in Plant Improvement[M].New York:Plenum Press,1984:209-279.
[2] Moench C.Methods Plantas Horti botanici et Agri marburgensis a Staminum Situ Describendi[M].Margburgi Cattorum:in Officina Nova Libraria Academiae,1794.
[3] Baden C,Frederiksen S,Seberg O.A taxonomic revision of the genus Hystrix (Triticeae,Poaceae)[J].Nordic Journal of Botany,1997,17:449-468.
[4] L9ve.Conspectus of the Triticeae[J].Feddes Repert,1984,95:425-521.
[5] Jensen K B,Wang R R C.Cytological and molecular evidence for transferring Elymus coreanus and Elymus californicus from the genus Elymus to Leymus(Poaceae:Triticeae)[J].International Journal of Plant Sciences,1997,158:872-877.
[6] Zhang H Q,Yang R W,Dou Q W,et al.Genome constitutions of Hystrix patula,H.duthiei ssp.duthiei and H.duthiei ssp.longearistata (Poaceae:Triticeae)revealed by meiotic pairing behavior and genomic in-situ hybridization[J].Chromosome Research,2006,14:595-604.
[7] Ellneskog-Staam P,Bothmer R von,Anamthawat-Jónsson,et al.Genome analysis of species in the genus Hystrix (Triticeae;Poaceae)[J].Plant Systematic and Evolution,2007,265:241-249.
[8] Wang R R C,Bothmer R von,Dvorak J,et al.Genome symbols in the Triticeae(Poaceae)[A].In:Wang R R C,Jensen K B,Jaussi C.Proceedings of the 2ndInternational Triticeae Symposium[C].Utah:Logan,USA,1994:29-34.
[9] Wang R R C,Hsiao C.Morphology and cytology of interspecific hybrids of Leymus mollis[J].Journal of Heredity,1984,75:488-492.
[10] Wang R R C,Zhang J Y,Lee B S,et al.Variations in abundance of 2repetitive sequences in Leymus and Psathyrostachys species[J].Genome,2006,49:511-519.
[11] Fan X,Sha L N,Yang R W,et al.Phylogeny and evolutionary history of Leymus(Triticeae;Poaceae)based on a singlecopy nuclear gene encoding plastid acetyl-CoA carboxylase[J].BMC Evolutionary Biology,2009,9:247.
[12] Wang R R C,Jensen K B.Absence of the J-genome in Leymus species(Poaceae,Triticeae)evidence from DNA hybridization and meiotic pairing[J].Genome,1994,37:231-235.
[13] Shiotani I.Species differentiation in Agropyron,Elymus,Hystrix,and Sitanion[A].Proceedings of the 12th International Congress of Genetics[C].Tokyo:The Science Council of Japan,1968:184.
[14] Sun G L,Wu B H,Liu F.Cytogenetic and genomic relationships of Thinopyrum elongatumwith two Psathyrostachys species and with Leymus secalinus (Poaceae)[J].Plant Systematics and Evolution,1995,197:225-231.
[15] Zhang H B,Dvorak J.The genome origin of tetraploid species of Leymus(Poaceae:Triticeae)inferred from variation in repeated nucleotide sequences[J].American Journal of Botany,1991,78:871-884.
[16] 鄢家俊,白史且,张新全,等.青藏高原东南缘老芒麦自然居群遗传多样性的SRAP和SSR分析[J].草业学报,2010,19(4):122-134.
[17] Zhang H Q,Fan X,Sha L N,et al.Phylogeny of Hystrixand related genera(Poaceae:Triticeae)based on nuclear rDNA ITS sequences[J].Plant Biology,2008,10:635-642.
[18] 王晓丽,凡星,张春,等.用nrDNA ITS序列探讨小麦族含StH染色体组物种的系统发育[J].草业学报,2009,18(6):82-90.
[19] Sha L N,Fan X,Yang R W,et al.Phylogenetic relationships between Hystrixand its closely related genera(Triticeae;Poaceae)based on nuclear Acc1,DMC1and chloroplast trnL-F sequences[J].Molecular Phylogenetics and Evolution,2010,54:327-335.
[20] Liu Z P,Chen Z Y,Pan J,et al.Phylogenetic relationships in Leymus(Poaceae:Triticeae)revealed by the nuclear ribosomal internal transcribed spacer and chloroplast trnL-F sequences[J].Molecular Phylogenetics and Evolution,2008,46:278-289.
[21] Mason-Gamer R J,Orme N L,Anderson C M.Phylogenetic analysis of North American Elymus and the monogenomic Triticeae(Poaceae)using three chloroplast DNA data sets[J].Genome,2002,45:991-1002.
[22] Mason-Gamer R J.Reticulate evolution,introgression,and intertribal gene capture in an allhexapolid grass[J].Systematic Biology,2004,53:25-37.
[23] 张春,凡星,莎莉娜,等.基于叶绿体trnL-F序列对广义披碱草属物种的系统进化研究[J].草业学报,2011,20(3):162-173.
[24] Nishikawa T,Salomon B,Komatsuda T,et al.Molecular phylogeny of the genus Hordeumusing three chloroplast DNA sequences[J].Genome,2002,45:1157-1166.
[25] Doyle J J,Doyle J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochemical Bulletin,1987,19:11-15.
[26] Xia X,Xie Z.DAMBE:Software package for data analysis in molecular biology and evolution[J].Journal of Heredity,2001,92:371-373.
[27] Huelsenbeck J P,Ronquist F R.MrBayes:Bayesian inference of phylogenetic trees[J].Bioinformatics,2001,17:754-755.
[28] Posada D,Crandall K A.Modeltest:testing the model of DNA substitution[J].Bioinformatics,1998,14:817-818.
[29] Zhang H Q,Zhou Y H.Meiotic pairing behavior reveals differences in genomic constitution between Hystrix patulaand other species of the genus Hystrix Moench(Poaceae:Triticeae)[J].Plant Systematic and Evolution,2006,258:129-136.
[30] Fan X,Zhang H Q,Sha L N,et al.Phylogenetic analysis among Hystrix,Leymus and its affinitive genera(Poaceae:Triticeae)based on the sequences of a gene encoding plastid acetyl-CoA carboxylase[J].Plant Science,2007,172:701-707.
[31] Zhang H Q,Fan X,Sha L N,et al.Phylogeny of Hystrixand related genera(Poaceae:Triticeae)based on nuclear rDNA ITS sequences[J].Plant Biology,2008,10:635-642.
[32] 黄燕,张海琴,刘静,等.利用RAPD特异标记分析东北猬草染色体组成[J].西北植物学报,2009,29:1538-1543.
[33] Wen J.Evolution of eastern Asian and eastern North American disjunct pattern in flowering plants[J].Annual Review of E-cology and Systematics,1999,30:421-455.
[34] Liu Q L,Ge S,Tang H B,et al.Phylogenetic relationships in Elymus(Poaceae:Triticeae)based on the nuclear ribosomal internal transcribed spacer and chloroplast trnL-F sequences[J].New Phytologist,2006,170:411-420.
[35] Yen N,Asamoah-Odei N,Sun G L.Maternal origin,genome constitution and evolutionary relationships of polyploid Elymus species and Hordelymus europaeus[J].Biologia Plantarum,2011,55:68-74.
[36] Zhang C,Fan X,Yu H Q,et al.Different maternal genome donor to Kengyiliaspecies inferred from chloroplast trnL-F sequences[J].Biologia Plantarum,2009,53:759-763.
[37] Wu Z Y,Peter H R,Hong D Y.Flora of China Illustrations[M].Beijing:Science Press,2006:386-394.
[38] Hulten E,Fries M.Atlas of North European Vascular Plants[M].Konigstein:Koeltz Scientific Books,Germany,1986:140.

