无芒雀麦对Cd和Zn胁迫的生理响应及富集作用
蔡 卓,毛培春,田小霞,干友民,孟 林
(1.四川农业大学动物科技学院,四川 雅安625014;2.北京市农林科学院北京草业与环境研究发展中心,北京100097)
近年来,重金属污染已成为当今土壤污染中,面积最大、危害最严重的环境问题之一。利用植物从土壤中吸收金属污染物,并转运到植株地上部分,对植株地上部分收获后进行处理,从而降低土壤中重金属的含量[1],是目前研究最多且最有前景的方法。Cd和Zn一般为Zn矿采矿区及冶炼厂所排污水和污泥农用的典型污染物,且在我国分布面积很广,开展Cd和Zn污染生态研究,对调控防治土壤重金属污染具有十分重要的意义[2]。前人研究已经证实,低浓度的Cd和Zn能促进植物生长,而高浓度的Cd和Zn则会引起植物膜脂过氧化作用,丙二醛含量上升,叶绿素含量降低[3-4],并导致保护酶系统超氧化物歧化酶活性下降,过氧化物酶活性升高[5-6]。不同的耐性机制使植物对重金属的吸收、转移和积累特征表现出较大的差异,可分为富集型、根部囤积型和规避型[7]。
无芒雀麦(Bromus inermis)系禾本科多年生草本植物,广泛分布于我国北方地区,具有抗逆性好、耐贫瘠、生物产量高等优点。由于其根系发达、再生能力强、枝叶茂盛、具有较强的固土能力,因此,多用于公路、水库、湖泊等的边坡防护和沙地固沙[8]。但目前还没有研究数据表明无芒雀麦对何种重金属具有一定的富集性,以及其可以作为一种潜在的重金属修复植物。本研究旨在温室盆栽试验条件下,探讨不同浓度的Cd和Zn胁迫下,无芒雀麦植株的叶绿素含量、丙二醛含量、超氧化物歧化酶和过氧化物酶活性的变化,以及无芒雀麦对不同浓度Cd和Zn的吸收富集作用。
1 材料与方法
1.1 试验材料 选取饱满的无芒雀麦种子为试验材料。无芒雀麦种子由北京克劳沃集团提供。
1.2 试验方法
1.2.1 育苗 试验在北京市农林科学院草业中心日光温室中进行。将园土自然风干,捣碎,剔除杂物后过5mm筛,与草炭按照体积比1∶1的比例混合配制育苗基质,并测定其基本理化性质,pH值6.98,有机质、碱解氮、速效磷、速效钾含量分别为2.80、119.30、12.48和200.48mg·kg-1,Cd和Zn含量分别为0.83和221.18mg·kg-1。选用素烧泥盆(内径21.5cm、高18.5cm)作栽培容器(盆下放塑料蓄水垫盘),每盆装入育苗基质4kg。
1.2.2 Cd和Zn的胁迫方法 Cd和Zn分别设置4个处理质量浓度,即Cd为200、400、600和800 mg·kg-1;Zn为400、800、1200和1 600mg·kg-1。且分别以CdCl2·2.5H2O和ZnCl2的形式提供,均匀拌到育苗基质中,拌入量以纯Cd和纯Zn的量为准。以0为对照,每个处理重复3次。盆土浇清水至田间最大持水量的60%左右。平衡一周后,开始播种,每盆播种60粒,待到三叶期时进行间苗。适量浇水,使盆土的土壤含水量保持在最大持水量的60%左右。待胁迫至60d时测定各指标。
1.2.3 指标测定方法 叶绿素含量采用乙醇丙酮浸提法[9]测定;丙二醛积累量采用硫代巴比妥酸(TBA)显色法[10]测定;超氧化物歧化酶活性采用氮蓝四唑(NBT)光化还原法[10]测定;过氧化物酶活性采用愈创木酚法[10]测定。
Cd和Zn含量:植物样品采用HNO3-HClO4湿法消煮,土壤采用热硝酸法消煮,最后用HITACHI(Z-5000)原子分光光度计测定样品中重金属含量[11],并计算转运系数(TF)和富集系数(AF)。


1.2.4 数据分析 数据采用 Microsoft Excel 2003进行方差分析,SAS 8.2软件进行显著性检验,Origin8Pro SR4作图。
2 结果与分析
2.1 Cd和Zn胁迫对叶绿素含量的影响 Cd和Zn胁迫下,无芒雀麦叶绿素a、b和总量变化随处理质量浓度的增加均呈先增后减的趋势(图1)。当Cd和Zn浓度分别为200和800mg·kg-1时,叶绿素a、b和总量均达最大;Cd处理下三者较对照分别增加1.00%、3.41%和1.67%,Zn处理下三者较对照分别增加2.11%、4.77%和1.67%。Cd质量浓度为600和800mg·kg-1时,叶绿素a含量与对照相比降幅分别为23.56%和42.83%,叶绿素总含量降幅分别为14.72%和27.33%,且差异均显著(P<0.05);800mg·kg-1处理下,叶绿素b含量与对照相比降幅为40.30%,差异也显著。Zn质量浓度达1 600mg·kg-1时,叶绿素a、b和总量均最低,与对照相比降幅分别为27.89%、30.31%和19.68%。
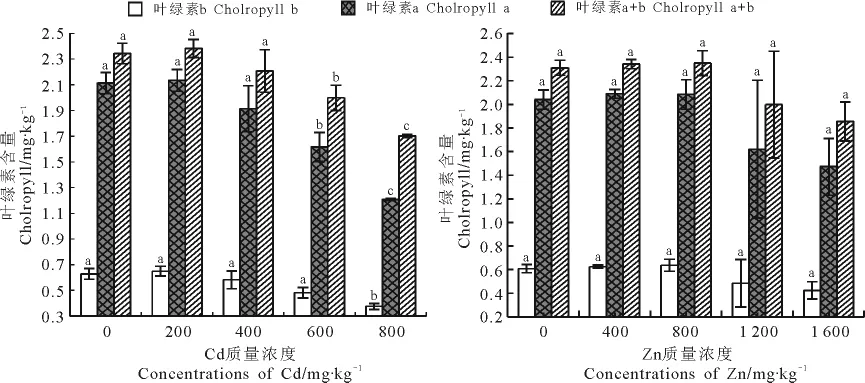
图1 Cd和Zn单一胁迫对无芒雀麦叶绿素含量的影响Fig.1 Effects of Cd,Zn stress on cholropyll content of Bromus inermis
2.2 Cd和Zn胁迫对丙二醛含量的影响 随Cd和Zn胁迫质量浓度的增加,丙二醛含量均呈上升趋势(图2)。在Cd质量浓度600和800m g·kg-1处理下,丙二醛含量与对照相比差异显著(P<0.05),分别为对照的6.70和9.98倍。而Zn处理下,丙二醛含量影响与对照相比,差异均不显著,其中1 600mg·kg-1浓度胁迫下增幅最大,为对照的8.55%。充分表明无芒雀麦所受伤害均随Cd和Zn浓度增加而加剧。
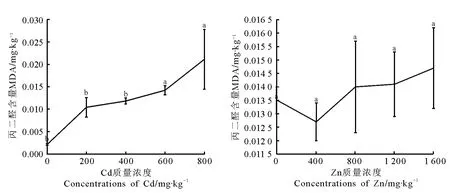
图2 Cd和Zn单一胁迫下无芒雀麦丙二醛含量变化Fig.2 Effects of Cd、Zn single stress on MDA content of Bromus inermis
2.3 Cd和Zn胁迫对超氧化物歧化酶和过氧化物酶活性的影响 随Cd和Zn质量浓度的增加,超氧化物歧化酶和过氧化物酶活性均呈先增后减的变化趋势(图3)。Cd胁迫下,超氧化物歧化酶酶活性在200mg·kg-1时达到峰值,增幅为36.82%;600和800mg·kg-1质量浓度时超氧化物歧化酶酶活性均低于对照,降幅分别为10.82%和12.49%。Zn胁迫下超氧化物歧化酶活性则整体高于对照,在400mg·kg-1处理下增幅最大,为68.83%。
在Cd处理下过氧化物酶活性均高于对照,且差异显著(P<0.05),并在质量浓度为200 mg·kg-1时增幅最大,为147.17%。而在Zn处理下,1 200和1 600mg·kg-1时均低于对照,降幅分别为27.86%和27.99%,且与对照差异显著(图3)。
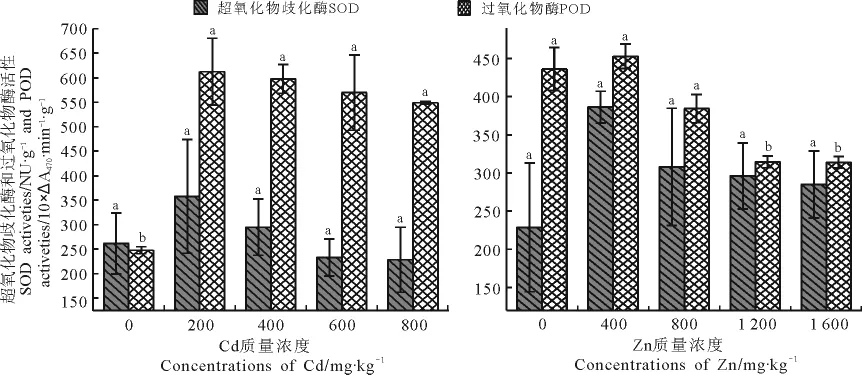
图3 Cd和Zn单一胁迫下无芒雀麦超氧化物歧化酶和过氧化物酶活力变化Fig.3 The effect of Cd、Zn single stress on SOD and POD activity of Bromus inermis
2.4 无芒雀麦对Cd和Zn的富集作用
2.4.1 无芒雀麦对Cd的富集作用 随Cd质量浓度的升高,无芒雀麦地上部分的Cd富集质量浓度随之升高(表1)。当Cd质量浓度400、600和800 mg·kg-1时,Cd的富集质量浓度分别为200 mg·kg-1时的3.33、4.06和14.67倍,且差异显著(P<0.05)。而地下部分则呈先升后降的趋势,400 mg·kg-1时富集质量浓度最大,600mg·kg-1时次之,分别为200mg·kg-1时的1.58和1.52倍,为800mg·kg-1时的1.91和1.83倍,且差异显著。其转运系数和富集系数均随Cd质量浓度的升高而增加。单株富集量在400mg·kg-1时达到最大,显著高于其他质量浓度处理下的富集量,地上富集量分别是200、600和800mg·kg-1处理下的2.33、2.55和1.40倍;地下富集量则分别为其1.00、1.58和6.50倍。
2.4.2 无芒雀麦对Zn的富集作用 随Zn质量浓度的升高,无芒雀麦地上和地下部分Zn的富集质量浓度均随之增加(表2)。与对照相比,各质量浓度胁迫下的Zn富集质量浓度差异显著(P<0.05)。地上部分Zn含量依次是对照的5.18、8.18、10.36和12.00倍。地下部分Zn含量依次是对照的3.79、5.44、6.98和7.44倍。各质量浓度胁迫下单株富集量差异不显著,但较对照差异显著。地上部分单株富集量依次为对照的7.67、8.51、9.79和8.84倍,地下部分单株富集量依次为对照的2.59、2.31、2.72和2.18倍。
3 讨论
3.1 Cd和Zn重金属胁迫对植物生理特性的影响 叶绿素含量的高低直接反映植物光合作用水平的强弱。本试验中,低质量浓度Cd(200 mg·kg-1)和Zn(800mg·kg-1)胁迫促进了叶绿素的合成,而高质量浓度Cd和Zn胁迫则抑制了叶绿素的合成,可能是因为过量的Cd和Zn抑制了原叶绿素酸酯还原酶(Protochlophyllide Reductase)的活性和影响 了 氨 基-r-酮 戊 酸 (Im Inolaevulinic Acid)的合成,而这2个酶对于叶绿素的合成是必需的[12]。植物遭遇逆境胁迫时,自由基和活性氧将导致膜脂过氧化作用,丙二醛则是膜脂过氧化产物,丙二醛在植物组织中积累量可以代表膜脂过氧化作用的程度[13],经常用来代表植物受伤害的程度。本试验发现,在高质量浓度Cd胁迫下,丙二醛积累量较高,无芒雀麦受伤害程度显著。而Zn和低质量浓度Cd处理下,无芒雀麦仍可以正常生长,说明与Zn相比,Cd处理对无芒雀麦植株体细胞伤害更大。
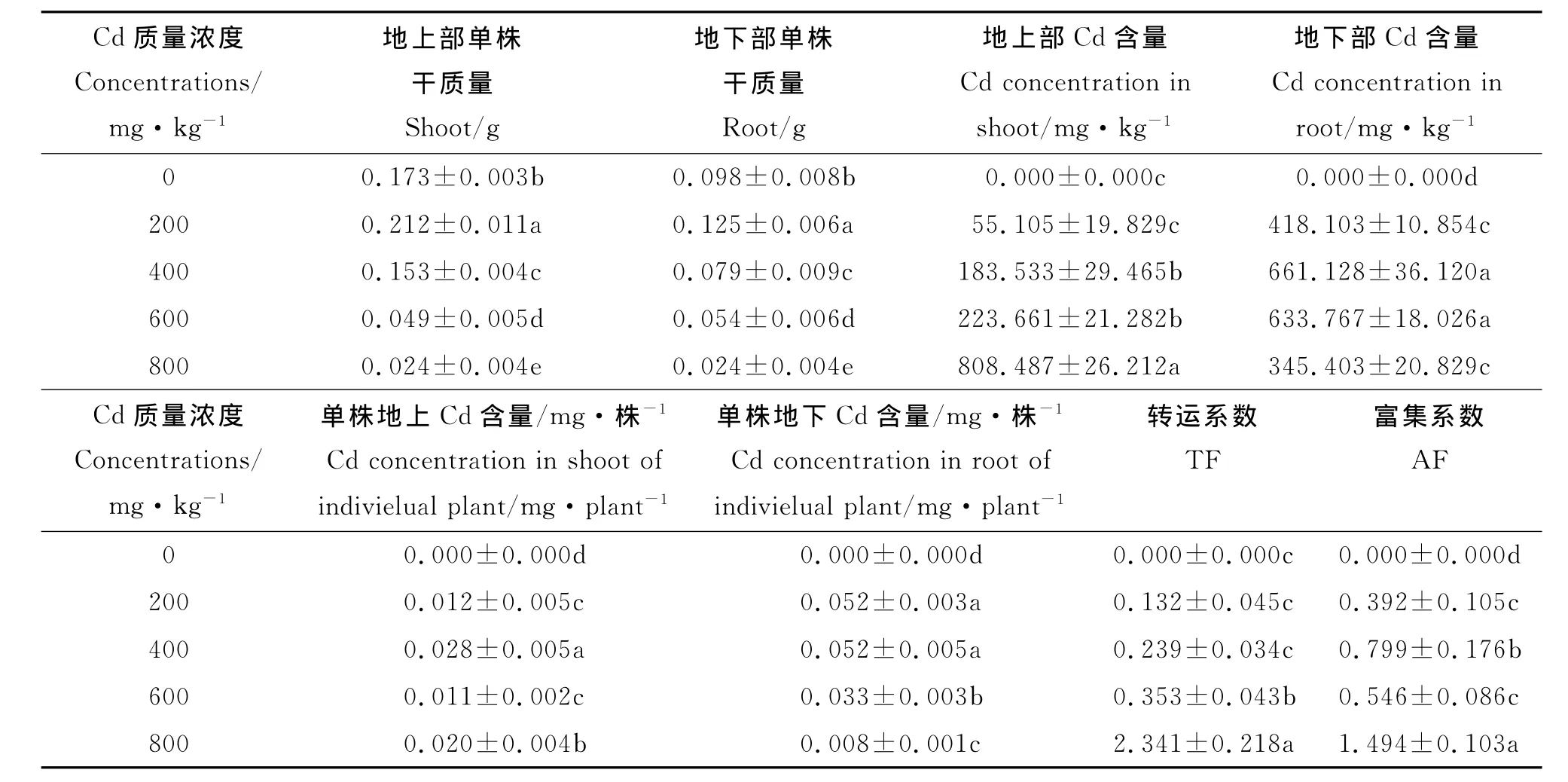
表1 Cd不同质量浓度处理下无芒雀麦对Cd的富集作用Table 1 Concentrations of Cd in Bromus inermis under different treatments
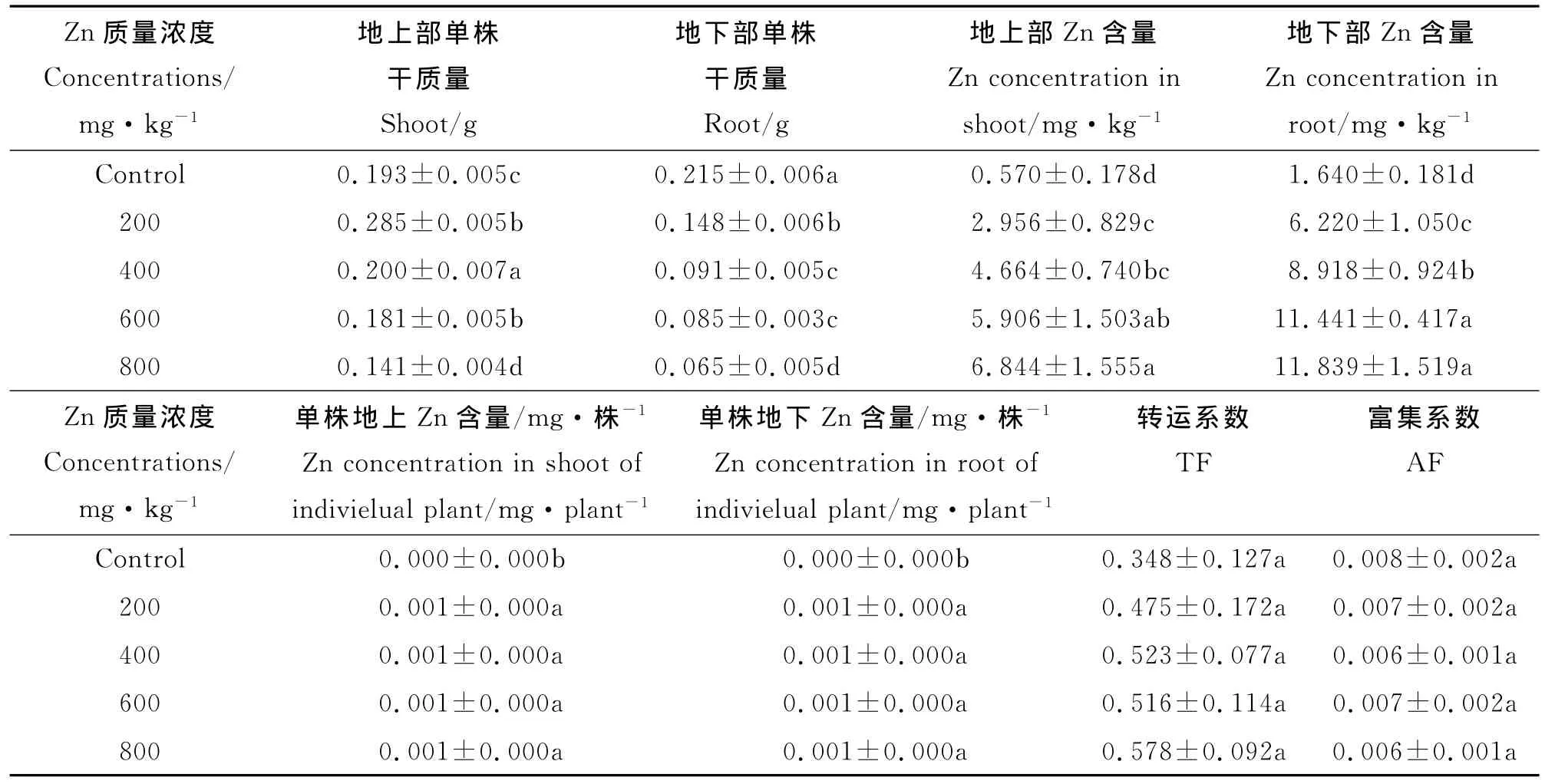
表2 Zn不同质量浓度处理下无芒雀麦对Zn的富集作用Table 2 Concentrations of Zn in Bromus inermis under different treatments
超氧化物歧化酶和过氧化物酶活性的变化,既可以表示逆境胁迫的强弱,也可以反映植物自身的抗逆能力[14]。超氧化物歧化酶可以将植物体内的超氧阴离子自由基歧化为H2O2,以减缓膜所受的伤害[15-16]。本试验表明,Cd和Zn重金属胁迫下,植物体内产生大量超氧阴离子自由基,诱导超氧化物歧化酶活性增加。随Cd和Zn浓度的增加,植物体受伤害程度加大,超氧化物歧化酶遭到破坏而导致酶活性降低。过氧化物酶是一种氧化还原酶类,在自由基的消除、延缓衰老等方面发挥重要的作用[17]。本试验中,过氧化物酶和超氧化物歧化酶活性随Cd和Zn胁迫质量浓度的增加均呈先增后减的趋势。低浓度重金属胁迫下,保护酶活性升高,是因为植物体内采取各种措施,提高抗性以适应不良环境,这是无芒雀麦对低质量浓度的重金属胁迫做出的应激反应,但随着胁迫质量浓度的增加,超过了无芒雀麦的耐受极限,植物体受到了严重的损伤,其保护酶受到相应损害,甚至死亡,继而转化为重金属对无芒雀麦的抑制效应。这与马文丽等[18]用Cd处理乌麦(Secale cereale)种子萌发幼苗,研究其抗氧化酶活性变化的结果相符。
研究还证实,低质量浓度的Cd和Zn重金属处理能促进植物的生长,可能是因为Zn是碳酸酐酶(CAs)、谷氨酸脱氢酶 (GDH)、色氨酸合 成酶(TSB)等与植物生长密切相关的酶的组成成分,这些酶在植物的光合作用、氮素代谢、蛋白质合成以及激素代谢过程中发挥着重要作用,从而促进植物的生长、发育和产量提高。也有研究报道,低浓度Cd对某些植物的生长有一定的促进作用,这种现象在毒性生理学上被称为毒物刺激效应(Hormesis)[19],但机理目前尚不清楚。低剂量有害物质刺激机体产生有益反应,正常功能得以加强,使机体更好地抵御以后的刺激[20]。而高质量浓度Cd和Zn重金属处理抑制植物生长,降低其生物量的积累,这与陈良等[21]对Cd胁迫下菊芋(Helianthus tuberosus)生物量降低的研究结果是一致的。可能是因为Zn过量时,首先会抑制光合作用,减少CO2固定;其次影响韧皮部的输送作用,改变细胞膜渗透性,从而导致生长减缓,受阻和失绿症,影响植物细胞的结构和功能,对植物产生毒害。当植物组织中Cd含量达到10-6mg·kg-1时,有些植物就会受害甚至减产,且表现出明显的受害症状,如失绿、矮化、物候期延迟和生物量下降甚至死亡[22]。当Cd进入植物体后,可占据酶活性位置并取代许多Zn酶中的Zn或Mg,激活酶中的Mg,还可以与许多酶的巯基结合,使酶活性受到抑制,甚至导致酶蛋白变性,造成植物生化过程紊乱,从而对植物的水分和矿质元素吸收、光合作用、呼吸作用等生理代谢过程产生影响。
3.2 植物对Cd和Zn重金属富集吸收的规律
目前,超富集植物至少应同时具有两个基本特征:其一是临界含量特征,即植物地上部干物质中重金属富集的临界含量,Cd为100mg·kg-1,Zn为10 000mg·kg-1;其二是转移特征,即植物地上部重金属含量大于其根部重金属含量[23-24]。本研究结果显示,800mg·kg-1Cd处理下,无芒雀麦符合Cd的超富集植物特征,即地上部分干物质质量浓度超过100mg·kg-1,且地上部分富集质量浓度大于地下部分,有作为Cd富集植物的潜力。然而富集量由富集浓度和单株生物量决定。400mg·kg-1Cd处理时,由于生物量积累的优势,地上部分单株富集量达到最大(183.533mg·kg-1),是 800 mg·kg-1Cd处理的1.40倍,可最大限度地回收处理Cd。因此,无芒雀麦作为Cd的超富集植物,400 mg·kg-1为其最佳生长质量浓度。
虽然不同质量浓度Zn处理下,无芒雀麦对土壤Zn的吸收与对照存在显著差异,但对其富集量均很低,未达到Zn的超富集植物标准,即地上部分干物质中质量浓度超过10 000mg·kg-1。规避型植物能抵制植物根系对重金属的吸收,并常常将土壤重金属沉淀在根系表面,而植物体内只吸收很少量的重金属。本试验结果显示,无芒雀麦地下和地上部分 Zn含量均很低,只有0.570~10.839 mg·kg-1,单株吸收量更为稀少,仅0.001mg左右。由此可见,无芒雀麦为Zn规避型植物。综合无芒雀麦在Zn胁迫下生长良好且只吸收少量的Zn,可考虑作为Zn污染土壤上的水土保持和饲草作物。
4 结论
1)低质量浓度Cd(≤200mg·kg-1)和Zn(≤800mg·kg-1)能促进无芒雀麦的生长,而高质量浓度Cd(≥200mg·kg-1)和Zn(≥800mg·kg-1)则会抑制无芒雀麦的光合作用,加剧其膜脂过氧化作用和破坏其体内的抗氧化保护酶系统。
2)无芒雀麦属于Cd富集型植物和Zn规避型植物,当Cd浓度400mg·kg-1时,对Cd的富集潜力最佳,可以作为Cd污染地区的修复植物,Zn污染地区的水土保持和饲草作物。
[1] 武强,孙录科.矿区土壤重金属污染的植物修复研究进展明[J].有色金属,2008,60(1):125-128.
[2] 黄雪夏,白厚义,陈佩琼.Cd、Zn污染对玉米的毒害效应[J].广西农业生物科学,2003,22(4):280-283.
[3] 陶毅明,陈燕珍,梁士楚,等.镉胁迫下红树植物木榄幼苗的生理生化特性[J].生态学杂志,2008,27(5):762-766.
[4] 孙天国,沙伟,接晶.锌胁迫对甜瓜幼苗的生理活性的影响[J].北方园艺,2010(16):51-53.
[5] 陈平,张伟锋,余土元,等.镉对水稻幼苗生长及部分生理特性的影响[J].仲恺农业技术学院学报,2001,14(4):18-21.
[6] 孔德政,裴康康,李永华,等.铅、镉和锌胁迫对荷花生理生化的影响[J].河南农业大学学报,2010,44(4):402-407.
[7] 雷梅,岳庆林,陈同斌,等.湖南柿竹园矿区重金属含量及植物吸收特征[J].生态学报,2005,258(5):1146-1151.
[8] 赵云鹏,齐宝林,高国臣,等.水土保持优良牧草——无芒雀麦[J].吉林林业科技,2005,34(6):5-12.
[9] 张志良,瞿伟菁.植物生理学试验指导[M].第3版.北京:高等教育出版社,2003:67-70,123-124.
[10] 郝再彬.植物生理试验[M].哈尔滨:哈尔滨工业大学出版社,2004:113-116.
[11] 周小勇.长柔毛委陵菜(Potentilla griffithii var.velutina)对复合污染的响应及其修复潜力的研究[D].广州:中山大学,2007:53-54.
[12] Stobart A K,Grifiths W T,Ameen-Bukhari I,et al.The effect of Cd2+on the biosynthesis of chlorophyll in leaves of barley[J].Plant Physiology,1985,63:293-298.
[13] 徐勤松,施国新,周红卫,等.Cd,Zn复合污染对水车前叶绿素含量和活性氧清除系统的影响[J].生态学杂志,2003,22(1):528.
[14] 徐旭,潘远智,孙振元.园林植物对重金属胁迫的响应研究现状[J].世界林业研究,2007,20(6):36-41.
[15] 邓碧玉,袁勤生,李文杰.改良的连苯三酚自氧化测定超氧化物歧化酶活性的方法[J].生物化学与生物物理进展,1991,18(2):163.
[16] 杜栋,王有年,于继洲,等.水分胁迫下外源甜菜碱对桃叶片光合作用的影响[J].北京农业学院学报,2004,19(2):1-5.
[17] Politycka A.Peroxidase zctivity and llipid peroxodation in toots of cucumber seedlings influenced by derivatives of cinnamic and benzoic acids[J].Acta Phvsiologiae Plantarum,1996,18(4):365-370.
[18] 马文丽,金小弟,王转花.镉处理对乌麦种子萌发幼苗的生长及抗氧化酶的影响[J].农业环境科学学报,2004,23(1):55-59.
[19] Calabrese E J,Baldwin L A.Hormesis as biological hypothesis[J].Environ Health Perspectives,1998,106(supplement 1):357-362.
[20] Calabrese E J,Baldwin L A.Defining hormesis[J].Human Experimental Toxicology,2002,21:91-97.
[21] 陈良,隆小华,郑晓涛,等.镉胁迫下两种菊芋幼苗的光合作用特征及镉吸收转运差异的研究[J].草业学报,2011,20(6):60-67.
[22] 任继凯,陈清朗,陈灵芝,等.土壤中镉、铅、锌及其相互作用对作物的影响[J].植物生态学与地植物学丛刊,1982,6(4):320-329.
[23] Baker A J M,Brooks R R.Terrestrial higher plants which hyperacuumulate elements——A review of their distribution,ecology and phytochemistry[J].Biorecovery,1989,1:81-126.
[24] Brooks R R,Chambers M F,Nicks L J,et al.Phytomining[J].Trends Plant Science,1998,3(9):59-361.
——黔南扁穗雀麦

