饲料中添加氧化三甲胺对哲罗鱼生长性能、肌肉成分、消化道脂肪酶活性和血清生化指标的影响
王常安 徐奇友 许 红 尹家胜 王 洋
(1.中国水产科学研究院黑龙江水产研究所,哈尔滨 150070;2.东北林业大学野生动物资源学院,哈尔滨 150040)
氧化三甲胺(trimethylamine oxide,TMAO),分子式为(CH3)3NO,化学结构与甲基供体胆碱、甜菜碱和S-腺苷甲硫氨酸等相似[1],广泛存在于原核生物和真核生物的组织中,是动物体内重要的无毒中间代谢物[2]。TMAO对水产动物有促生长的作用,可提高罗非鱼(Oreochromis niloticus)[2]、鲫(Carassius auratus)[3]等的生长性能。TMAO 还可调节水产动物脂肪代谢,改变其体组成。例如,饲料中添加TMAO可改变虹鳟(Salmo gairdnerii)腹脂率[4],显著降低尼罗罗非鱼肌肉和肝胰脏中粗脂肪含量[2]。此外,TMAO还具有调节鱼体渗透压[5]、提高机体抗氧化性[1]等作用。目前,关于TMAO对冷水性鱼类的促生长及生理生化指标影响的研究较少。哲罗鱼(Hucho taimen)为大型冷水性鱼类,其驯化、养殖已获成功,而在人工养殖过程中低温环境会减缓哲罗鱼的生长,为此,很有必要进行哲罗鱼促生长饲料添加剂的研究,以提高其生长性能。本试验拟在低鱼粉配合饲料中添加TMAO,通过饲喂哲罗鱼,研究TMAO对哲罗鱼生长性能、肌肉成分、消化道脂肪酶活性及血清生化指标的影响,以期为TMAO在哲罗鱼饲料中的应用提供依据。
1 材料与方法
1.1 试验材料
初重为(4.15±0.15)g的哲罗鱼由中国水产科学研究院黑龙江水产研究所渤海冷水鱼试验站提供,TMAO购于济南诚和生物科技有限公司,纯度为98.0%。
1.2 生长试验
试验选取1 800尾健康哲罗鱼,随机分为6组(Ⅰ~Ⅵ组),每组3个重复,每个重复100尾鱼。Ⅰ~Ⅵ组试验鱼分别饲喂含0、0.02%、0.05%、0.10%、0.20%和 0.50%TMAO 的试验饲料。试验饲料组成及营养水平见表1。试验鱼以重复为单位在室内玻璃钢水族箱(直径90 cm,水深45 cm)中流水饲养,以基础饲料驯化14d后开始正式试验。试验水为涌泉水,水温 13.3~18.1 ℃,pH 7.2 ~7.5,溶氧 >6.0 mg/L,氨氮 <0.2 mg/L。光周期为12明12暗。日投喂2次,投饲率为体重的3%,每次投喂结束40 min后收集残饵,饲养期为56d。养殖试验结束后,试验鱼饥饿24 h,用鱼安定(MS-222,化学名为间氨基苯甲酸乙酯甲磺酸盐)麻醉试验鱼,采集样本,分析肌肉成分、消化道脂肪酶活性和血清生化指标。

表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimentaldiets(air-dry basis) %
1.3 指标测定
1.3.1 生长性能测定
试验开始时,称量每水族箱鱼总重,每组平均体重作为初重;试验结束时,统计养殖周期内试验鱼死亡数和每水族箱鱼饲料摄入量,称量每水族箱鱼总重,每组平均体重作为终重。每重复取10尾鱼测定体长和体重,解剖鱼体,分离肝脏并称重,取其整个内脏团并称重。根据以下公式计算试验鱼的生长性能指标。
增重率(weight gain rate,WGR,%)=100×(Wt-W0)/W0;
成活率(survival rate,SR,%)=100×Nf/Ni;
肥满度(condition factor,CF)=100 ×Wt/L3
t;
饲料系数(Feed conversion ratio,FCR)=F/(Wt-W0);
肝体指数(liver somatic index,LSI,%)=
1
00×Wl/Wq;
脏体指数(visceral somatic index,VSI,%)=100 ×Wv/Wq。
式中:W0为初重(g);Wt为终重(g);Nf为终末尾数(尾);Ni为初始尾数(尾);Lt为试验结束时体长(cm);F为饲料摄入量(g);Wl为肝脏重(g);Wv为内脏重(g);Wq为去内脏重(g)。
1.3.2 肌肉成分测定
每个水族箱随机取6尾鱼的背部肌肉用于肌肉成分分析。取一份肌肉样品,以105℃干燥恒重法测定水分含量;凯氏定氮法(总氮×6.25)测定粗蛋白质含量;索氏抽提法测定粗脂肪含量;马福炉灼烧法(550℃)测定灰分含量。另取一份肌肉样品,研成粉末,索氏抽提法脱脂,依据GB/T 5009.124—2003酸水解法以日立L-8900氨基酸分析仪测定氨基酸组成,色氨酸被破坏,未检。
1.3.3 消化道脂肪酶活性测定
每个水族箱随机取4尾鱼,于冰盘上分别取前肠+幽门盲囊、后肠和胰腺,0.86%冰浴生理盐水洗净,滤纸吸干,称重。按1∶9质量体积比加入预冷生理盐水,以FJ-200CL高速组织匀浆机匀浆(15 000 r/min,3 min)稀 释,4 ℃ 条 件 下4 000 r/min离心10 min,取上清液放入1.5 mL离心管中,-80℃冷冻保存,待测前肠+幽门盲囊、后肠和胰腺脂肪酶活性。脂肪酶活性测定采用聚乙烯醇橄榄油乳化液水解法[6]。脂肪酶活性单位定义:在37℃下,脂肪酶水解脂肪每分钟产生1 μg脂肪酸所消耗的酶量为1个活性单位。
1.3.4 血清生化指标测定
每个水族箱随机取4尾鱼,尾柄采血,4℃冰箱中静置30 min,3 000 r/min离心15 min,取血清置于1.5 mL离心管中,-80℃冷冻保存,待测胆固醇(cholesterol,CHOL)、甘油三酯(triglyceride,TG)、高密度脂蛋白(highdensity lipoprotein,HDL)、低密度脂蛋白(lowdensity lipoprotein,LDL)和葡萄糖(glucose,GLU)含量。其中,CHOL、TG和GLU含量以酶法测定,HDL和LDL含量以直接法测定,均使用贝克曼试剂盒以全自动生化分析仪(贝克曼ProCX4,美国)测定。
1.4 数据处理和统计分析
结果以平均值±标准差表示。数据采用SAS 9.1.3进行单因素方差分析,并采用Duncan氏法进行多重比较,显著性水平为P<0.05,并以增重率为指标进行折线模型分析。
2 结果
2.1 饲料中添加TMAO对哲罗鱼生长性能的影响
由表2可知,饲料中添加 0.02% ~0.20%TMAO后,哲罗鱼的增重率显著升高(P<0.05),当添加量为0.05%时达最大值。TMAO添加量为0.50%时,哲罗鱼的增重率与对照组相比无显著差异(P >0.05)。饲料中添加 0.02% ~0.50%TMAO对哲罗鱼的饲料系数、肥满度、成活率、肝体指数和脏体指数均无显著影响(P>0.05)。

表2 饲料中添加TMAO对哲罗鱼生长性能的影响Table 2 Effects of TMAO supplementation on growth performance of taimen(Hucho taimen)
以TMAO添加量为自变量(X),增重率为因变量(Y)进行折线模型分析,得到增重率在最大值时TMAO的添加量为0.025%(图1)。

图1 TMAO添加量与哲罗鱼增重率的折线模型分析Fig.1 Broke-line analysis between TMAO supplementation and weight gain rate of taimen(Hucho taimen)
2.2 饲料中添加TMAO对哲罗鱼肌肉营养组成的影响
由表3可知,饲料中添加0.02% ~0.50%TMAO后,哲罗鱼肌肉中粗脂肪含量显著降低(P<0.05),当添加量为0.50%时降至最低值。饲料中添加0.02% ~0.50%TMAO对哲罗鱼肌肉中水分、粗蛋白质和灰分含量均无显著影响(P >0.05)。
2.3 饲料中添加TMAO对哲罗鱼肌肉氨基酸组成的影响
由表4可知,饲料中添加 0.02% ~0.50%TMAO对哲罗鱼肌肉氨基酸组成及含量未产生显著影响(P >0.05)。
2.4 饲料中添加TMAO对哲罗鱼消化道脂肪酶活性的影响
由表 5可知,饲料中添加0.02% ~0.50%TMAO后,前肠+幽门盲囊脂肪酶活性先升高后降低,在添加量为0.02% ~0.20%时显著高于对照组和0.50%添加组(P<0.05)。后肠脂肪酶活性在0.02%添加组达最高值,显著高于其他各组(P<0.05)。此外,0.20%添加组后肠脂肪酶活性显著高于对照组和0.50%添加组(P<0.05)。饲料中添加0.02% ~0.50%TMAO对哲罗鱼胰腺脂肪酶活性无显著影响(P>0.05)。
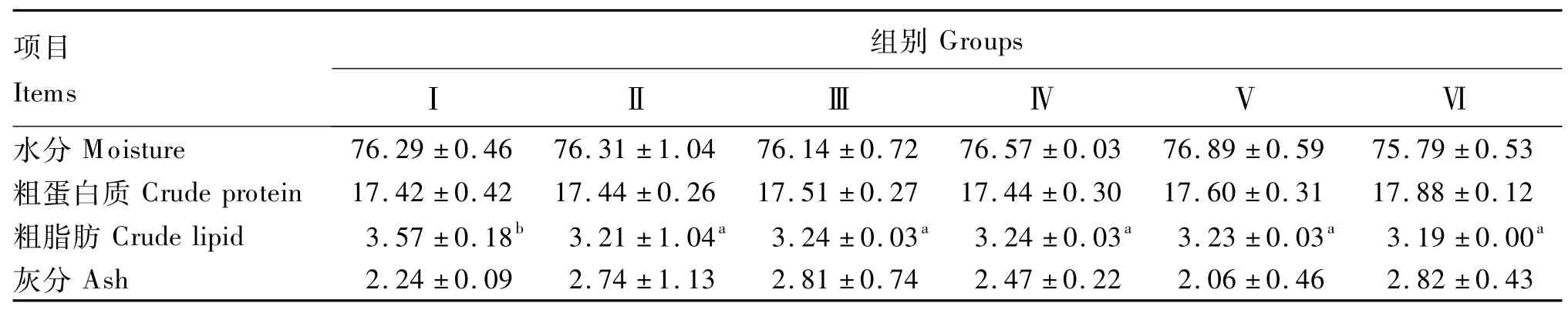
表3 饲料中添加TMAO对哲罗鱼肌肉营养组成的影响(湿重基础)Table 3 Effects of TMAO supplementation on nutrient composition in muscle of taimen(Hucho taimen)(wet weight basis) %
2.5 饲料中添加TMAO对哲罗鱼血清生化指标的影响
由表6可知,饲料中添加0.02% ~0.50%TMAO后显著降低了哲罗鱼血清CHOL、TG、LDL含量(P <0.05)。饲料中添加 0.02% ~0.05%TMAO后提高了哲罗鱼血清HDL含量,且在添加量为0.05%和0.50%时达到显著水平(P<0.05)。饲料中添加 0.02% ~0.50%TMAO 对哲罗鱼血清CLU含量未产生显著影响(P>0.05)。
3 讨论
3.1 饲料中添加TMAO对哲罗鱼生长性能的影响
已有研究表明,育肥猪饲粮中添加1%TMAO后,TMAO组试验猪日增重提高了7.5%,饲料转化效率提高了7%[7];饲料中添加TMAO可提高罗非鱼[8]、凡纳滨对虾(Litopenaeus vannamei)[9]等水产动物的生长性能和饲料利用率。本试验结果显示,饲料中添加0.02% ~0.20%TMAO可显著提高哲罗鱼增重率,而饲料系数变化不大。蔡英华等[10]报道指出,TMAO对鱼类具有促生长效果,可较大幅度地降低饲料系数,提高饲料的利用率和转化率,而本试验中TMAO对哲罗鱼的饲料系数影响不大,说明TMAO对哲罗鱼的促生长作用是通过提高摄食水平而实现的[11]。TAMO还可通过增强肌肉细胞的增殖来促进肌肉组织生长,进而提高动物生长[12]。Baskakov 等[13]研究发现,TMAO可使2种非折叠蛋白折叠成有功能的自然品种蛋白,并使糖皮质激素受体片段的残基1~500和残基77~262重新结合,因而在蛋白质的形成过程中起协同作用,促进动物的生长。TMAO是否促进哲罗鱼肌肉细胞增殖,作为肌肉蛋白质的稳定剂参与甲基代谢及其他方面的作用有待进一步证实。另外,本试验以增重率为指标进行折线模型分析得出哲罗鱼饲料中TMAO的最适添加量为 0.025%,该结果比罗非鱼(0.2%)[8],南美白对虾(0.6%)[9]等的最适添加量低,这可能与罗非鱼[14]和南美白对虾[15]等对TMAO的需要量较多有关。

表4 饲料中添加TMAO对哲罗鱼肌肉氨基酸组成的影响Table 4 Effects of TMAO supplementation on amino acid composition in muscle of taimen(Hucho taimen) %

表5 饲料中添加TMAO对哲罗鱼消化道脂肪酶活性的影响Table 5 Effects of TMAO supplementation on gastrointestinal lipase activity of taimen(Hucho taimen) U/g

表6 饲料中添加TMAO对哲罗鱼血清生化指标的影响Table 6 Effects of TMAO supplementation on serum biochemical indices of taimen(Hucho taimen) mmol/L
3.2 饲料中添加TMAO对哲罗鱼肌肉成分的影响
已有研究表明,饲料中添加0.2%、0.4%和0.8%TMAO均可显著降低罗非鱼肌肉和肝胰脏中粗脂肪含量[8]。本试验结果表明,饲料中添加0.02% ~0.50%TMAO可使哲罗鱼肌肉中粗脂肪含量显著降低,与罗非鱼[8]的研究结果相似,但与虹鳟[4]的研究结果不一致。Rorvik等[4]认为,TMAO提高了饲料中脂肪的利用率,进而导致虹鳟肌肉中脂肪沉积增加。本试验中哲罗鱼肌肉中粗脂肪含量的降低可能与其添加量有关。Overland 等[7]研究发现,饲粮中添加 0.1%、0.2% 和0.5%TMAO均降低了猪胴体脂肪含量,而添加1.0%TMAO则显著增加了猪肌肉脂肪沉积量,表明TMAO的添加量和肌肉脂肪含量呈现折线剂量效应关系。由此推论,添加高剂量TMAO可能会使哲罗鱼肌肉中脂肪沉积量增加。Overland等[7]研究还发现,饲粮中添加TMAO不影响猪胴体氮的沉积。本试验中,哲罗鱼肌肉中粗蛋白质含量亦未发生显著变化,进一步分析其肌肉氨基酸组成与含量发现,饲料中添加0.02% ~0.50%TMAO对哲罗鱼肌肉氨基酸组成及含量亦无显著影响。可见,TMAO的添加未使哲罗鱼肌肉氨基酸营养价值发生改变。
3.3 饲料中添加TMAO对哲罗鱼消化道脂肪酶活性和血清生化指标的影响
鱼类消化酶主要由胰腺分泌后进入肠道发挥消化作用,消化酶活性可以反映鱼类的消化能力[16]。研究发现,TMAO显著提高了南美白对虾消化腺中的蛋白酶、淀粉酶和脂肪酶活性[9]。作者前期的试验表明,饲料中添加TMAO显著影响哲罗鱼消化道脂肪酶活性,而对蛋白酶和淀粉酶活性无显著影响[11]。本试验中,饲料中添加0.02% ~0.50%TMAO后,哲罗鱼前肠+幽门盲囊和后肠脂肪酶活性显著升高,这可能是由于TMAO保持了机体胃肠道内环境平衡,促进了消化道内源性消化酶的分泌,进而提高了消化酶的活性[17],这利于脂肪的消化吸收,从而促进鱼体生长。
血脂包括TG、磷脂、CHOL和非酯化脂肪酸等,其代谢水平可直接反映全身脂类代谢状况。研究表明,TMAO可促进动物机体脂肪代谢,但随添加量不同而有所变化。饲粮中添加0.1%、0.2%和0.3%TMAO 可使猪血清 TG、CHOL和游离脂肪酸的含量显著提高[18],而添加量为0.5%时则使TG的含量显著下降[7],出现了折线剂量效应关系。本试验中饲料中添加0.02% ~0.50%TMAO后,哲罗鱼血清CHOL、TG和LDL含量显著降低,HDL含量提高,说明饲料中添加TMAO可促进哲罗鱼机体脂肪代谢。但本试验中未呈现折线剂量效应关系,可能设计的TMAO添加量未达到出现折线剂量的阈值,需进一步研究。目前,关于TMAO促进鱼类脂类代谢的研究甚少,其脂质代谢的影响和作用机制尚需进一步深入研究。此外,GLU是鱼体能量的主要来源,其含量的变化反映了机体所处的生理状态[19]。在本试验中,各组试验鱼血清GLU含量比较稳定,说明TMAO对哲罗鱼血清GLU含量影响不大,此时哲罗鱼自身调节能力以及对饲料的消化吸收符合生长的要求。
4 结论
① 饲料中添加0.02% ~0.20%TMAO可促进哲罗鱼生长,而添加量为0.50%时促生长作用不明显。
② 饲料中添加0.02% ~0.50%TMAO可降低哲罗鱼肌肉中粗脂肪含量,但对肌肉其他营养成分无显著影响。
③ 饲料中添加0.02% ~0.20%TMAO可改善哲罗鱼消化道脂肪酶活性,但添加量为0.50%时对消化道脂肪酶活性无显著影响。
④ 饲料中添加0.02% ~0.50%TMAO可降低哲罗鱼血脂水平。
⑤以增重率为指标,经折线模型分析得出哲罗鱼饲料中TMAO适宜添加量为0.025%。
[1] 徐春兰,胡晓蕾,汪以真.氧化三甲胺对水产动物作用的研究进展[J].中国饲料,2004(16):25-27.
[2] 孙海香,宋保强,夏枚生,等.TMAO对罗非鱼的诱食活性研究[J].水利渔业,2005,25(5):83 -84.
[3] 吕民主,李梅姿,韦勇.氧化三甲胺不同添加量对鱼类促生长的研究[J].饲料研究,2004(5):41-43.
[4] RORVIK K A.Urea and trimethylamine oxide indiets for seawater farmed rainbow trout:effect on fat belching,skin vesicle,winter ulcer and quality grading[J].Aquaculture Nutrition,2000,6(4):247 -254.
[5] KELLY R H,YANCEY P H.High contents of trimethylamine oxide correlating withdepth indeep-sea teleost fishes,skates anddecapod crustaceans[J].The Biological Bulletin,1999,196(1):18 -25.
[6] 朱俭,曹凯鸣,周润琦,等.生物化学试验[M].上海:上海科学技术出版社,1981:190-193.
[7] OVERLAND M,RORVIK K A,SKREDE A.Effect of trimethylamine oxide and betaine in swinediets on growth performance,carcass characteristics,nutrientdigestibility and sensory quality of pork[J].Journal of Animal Science,1999,77:2143 -2153.
[8] 孙海香,夏枚生,胡彩虹.氧化三甲胺对罗非鱼生长和鱼体营养成分组成的影响[J].淡水渔业,2005,35(3):17-19.
[9] 朱兴一,夏枚生,胡彩虹.氧化三甲胺对南美白对虾生长、养分消化率和消化酶活性的影响[J].西北农林科技大学学报,2005,33(11):43 -48.
[10] 蔡英华,舒绪刚,廖列文,等.氧化三甲胺在动物养殖中的应用研究进展[J].广东饲料,2009(3):32-35.
[11] 王常安,徐奇友,畅雅萍,等.不同促摄食物质对哲罗鲑生长、体成分、消化酶和血液生化指标的影响[J].安徽农业大学学报,2011,38(1):65 -71.
[12] BAKER J R,STRUEMPLER A,CHAYKIN S.A comparative study of trimethylamine-N-oxide biosynthesis[J].Biochimica et Biophysica Acta,1963,71:58-64.
[13] BASKAKOV I V,KUMAR R,SRINIVASAN G,et al.Trimethylamine N-oxide-induced cooperative folding of anintrinsically unfold transcription-activating fragment of human glucocorticoid receptor[J].Journal of Biological Chemistry,1999,274(106):93 -96.
[14] NIIZEKI N,DAIKOKU T,HIRATA T,et al.Mechanism of biosynthesis of trimethylamine oxide from choline in the teleost tilapia,Oreochromis niloticus,under freshwater conditions[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2002,131(3):371 -386.
[15] GIBB S W,HATTON A D.The occurrence anddistribution of trimethylamine-N-oxide in Antarctic coastal waters[J].Marine Chemistry,2004,91(1/2/3/4):65-75.
[16] CAHU C,RØNNESTAD I,GRANGIERA V,et al.Expression and activities of pancreaticenzymes indeveloping sea bass larvae(Dicentrarchus labrax)in relation to intact and hydrolyzeddietary protein;involvement of cholecystokinin[J].Aquaculture,2004,238(1):295-308.
[17] YANCEY P H,CLARK M E,HAND S C,et a1.Living with water stress evolution of osmolyte systems[J].Science,1982,217:1214 -1222.
[18] 许梓荣,汪以真,朱梅.氧化三甲胺对生长肥育猪胴体组成的影响[J].中国畜牧杂志,2002,38(4):19-20.
[19] 张祥.不同乳铁蛋白含量的代乳粉对犊牛生长发育的影响[D].硕士学位论文.扬州:扬州大学,2007:22.

