黄颡鱼三倍体人工诱导方法的比较研究
李永仁 董少杰 陈丽梅 杨 广
黄颡鱼三倍体人工诱导方法的比较研究
李永仁 董少杰 陈丽梅 杨 广
(天津农学院a.水产科学系,b.天津市水产生态及养殖重点实验室,天津300384)
应用热休克、冷休克、6-DMAP和CB处理黄颡鱼受精卵,探讨诱导三倍体的适宜方法.4种方法均能诱导黄颡鱼受精卵形成三倍体胚胎.受精卵经热休克处理(受精后第8min,40℃处理2min),诱导率为93.3%,孵化率为78.6%;冷休克法(受精后第3min,4℃处理15min)诱导率为63.3%,孵化率为82.3%;受精卵经6-DMAP和CB处理得到的诱导率较低,分别为26.7%和10.0%.综合考虑,热休克法及冷休克法为诱导黄颡鱼三倍体的适宜方法.
黄颡鱼;三倍体;诱导
黄颡鱼(Pelteobagrus fulvidraco)俗称黄腊丁、黄鼓鱼等,属鲶形目、鲿科、黄颡鱼属[1],是目前国内重要淡水养殖鱼类,具有较好的市场前景[2].但是,由于该鱼生长速度慢、个体规格偏小,影响了该品种养殖的经济效益.人工诱导的三倍体鱼具有不育、个体大、生长快、寿命长、肉质好、成活率高等优良品性[3],因此,有望利用三倍体诱导技术培育出优质黄颡鱼苗种.
国内外通过多种方式对不同鱼类开展了三倍体诱导实验:杨彩卿等[4]应用6-DMAP诱导三倍体黄颡鱼;宋立民等[5]应用冷、热休克法诱导三倍体黄颡鱼;尤锋[6]利用冷休克法诱导黑鲷三倍体;林琪、桂建芳等[7-8]应用静水压休克法分别对大黄鱼和水晶彩鲫开展三倍体诱导;Ojima、Peter等[9-10]应用温度休克法获得了鲤鱼和美洲红点鲑三倍体.
本文应用冷休克、热休克、6-DMAP以及CB等不同处理方式,诱导黄颡鱼三倍体,以期选择实用、高效的三倍体诱导方法.
1 材料与方法
1.1 材料
黄颡鱼亲鱼取自天津市漳河水产养殖有限公司养殖池,2龄,雌雄各30尾,雌鱼体重98±18g,雄鱼体重158±28g,性腺发育良好.
诱导试剂:6-二甲基氨基嘌呤(6-DMAP)、细胞松弛素B(CB),均为美国Sigma公司产品.
1.2 实验方法
1.2.1 实验设计
亲鱼注射绒毛膜促性腺激素(HCG)+马来酸地欧酮(DOM),20h后挤压取卵,解剖取精,并进行人工授精.受精卵均匀散布于60目网片上,每个网片作为一组进行处理.
受精卵经过温度休克及药物处理过程诱导三倍体,其中热休克法设3个温度梯度,3个起始时间梯度和3个持续时间梯度.每组设平行,具体操作见表1.
1.2.2 倍性鉴定
受精150d后,幼鱼体长达7~10cm,采用流式细胞术检测倍性.具体方法为:每组取幼鱼30尾,尾柄取血,多聚甲醛固定,自然沉降;吸除上清,悬浮于PBS;用质量分数0.1%triton X-100透化处理20min,10mg/L PI染色30min;离心弃上清,血细胞悬浮于PBS,细胞终浓度106~107个/mL.以流式细胞仪(美国Betecton Dickinson公司FACS tar Puls)于波长488nm下检测细胞DNA相对含量,处理组样品若为对照组样品DNA含量的
1.5倍,即可判定为三倍体.
1.3 数据处理
不同处理组受精卵分别培育,统计受精率、孵化率、畸形率以及三倍体诱导率等数据.
受精率为原肠期存活胚胎数与总卵数之比;孵化第2天统计畸形率,畸形仔鱼与孵出仔鱼总数之比为畸形率;诱导率为三倍体仔鱼数与正常仔鱼数之比.
2 实验结果
2.1 三倍体诱导效果
流式细胞术测定黄颡幼鱼二倍体和三倍体各30尾,测定结果表明:二倍体DNA相对含量为196~198、均值为196.57;三倍体DNA相对含量为278~293、均值为283.60,流式细胞术测定幼鱼倍性的直方图结果如图1,横坐标代表单细胞内DNA的相对含量.
对各实验组分别统计受精率、孵化率、畸形率以及三倍体诱导率,结果如表1.
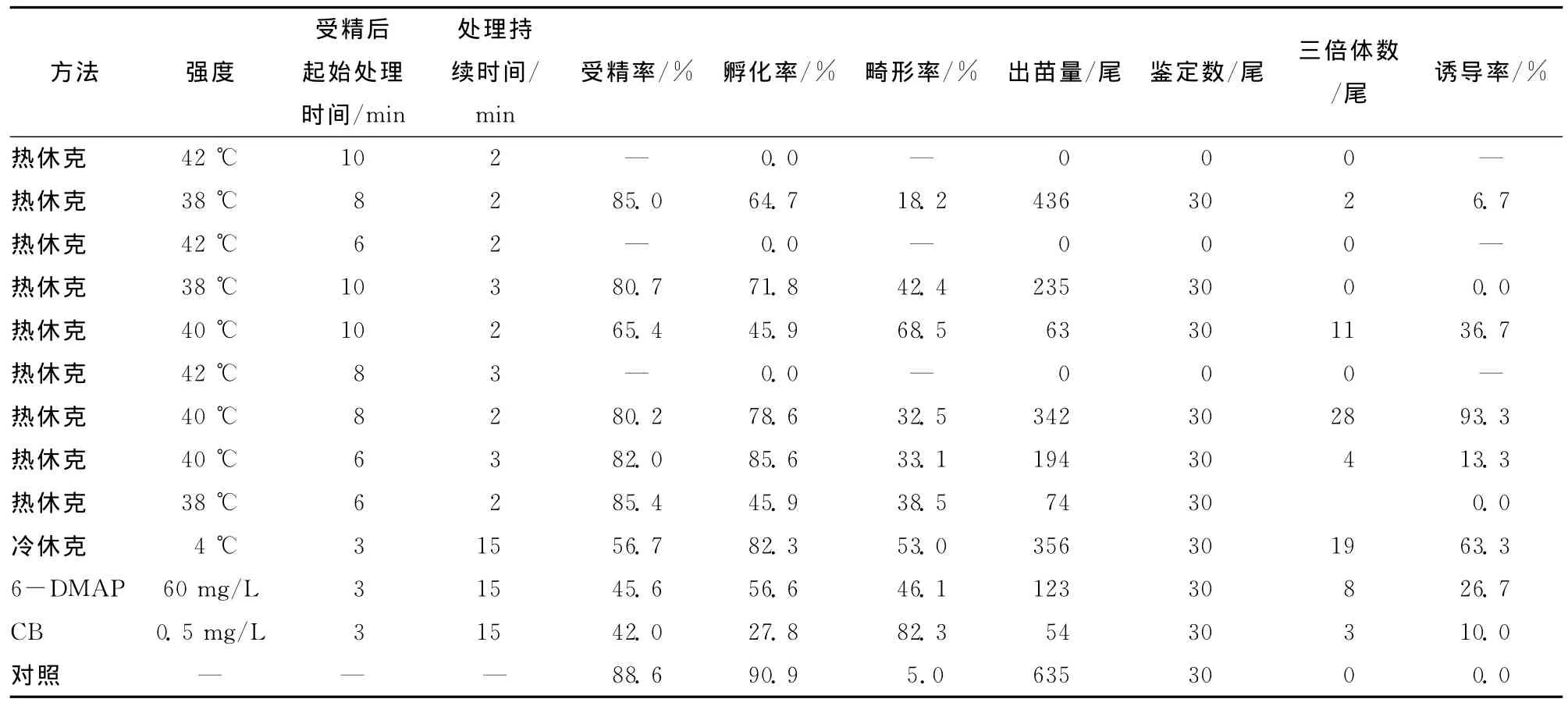
表1 各实验组胚胎发育及三倍体诱导率Tab.1 Embryo development and triploid inductivity in test groups
2.2 诱导方法的选择
如表1所示,在热休克各组中,42℃处理组胚胎没有孵出仔鱼;38℃处理组虽然孵化率较高,但倍化率低;6min处理组倍化率较低,10min处理组孵化率低,且新生仔鱼畸形率较高;在处理持续时间方面,2min组优于3min组.因此,应用热休克法诱导黄颡鱼三倍体的适宜条件为受精8min后,40℃温水中处理2min,倍化率达到93.3%,是黄颡鱼三倍体诱导的最佳方法.
冷休克组倍化率低于热休克组,为63.3%,但孵化率较高,达82.3%,较适于黄颡鱼三倍体诱导.诱导剂对比发现,6-DMAP处理组与CB处理组不但诱导率低、孵化率低,而且畸形率高,加之药品价格昂贵,不适于开展大规模诱导.
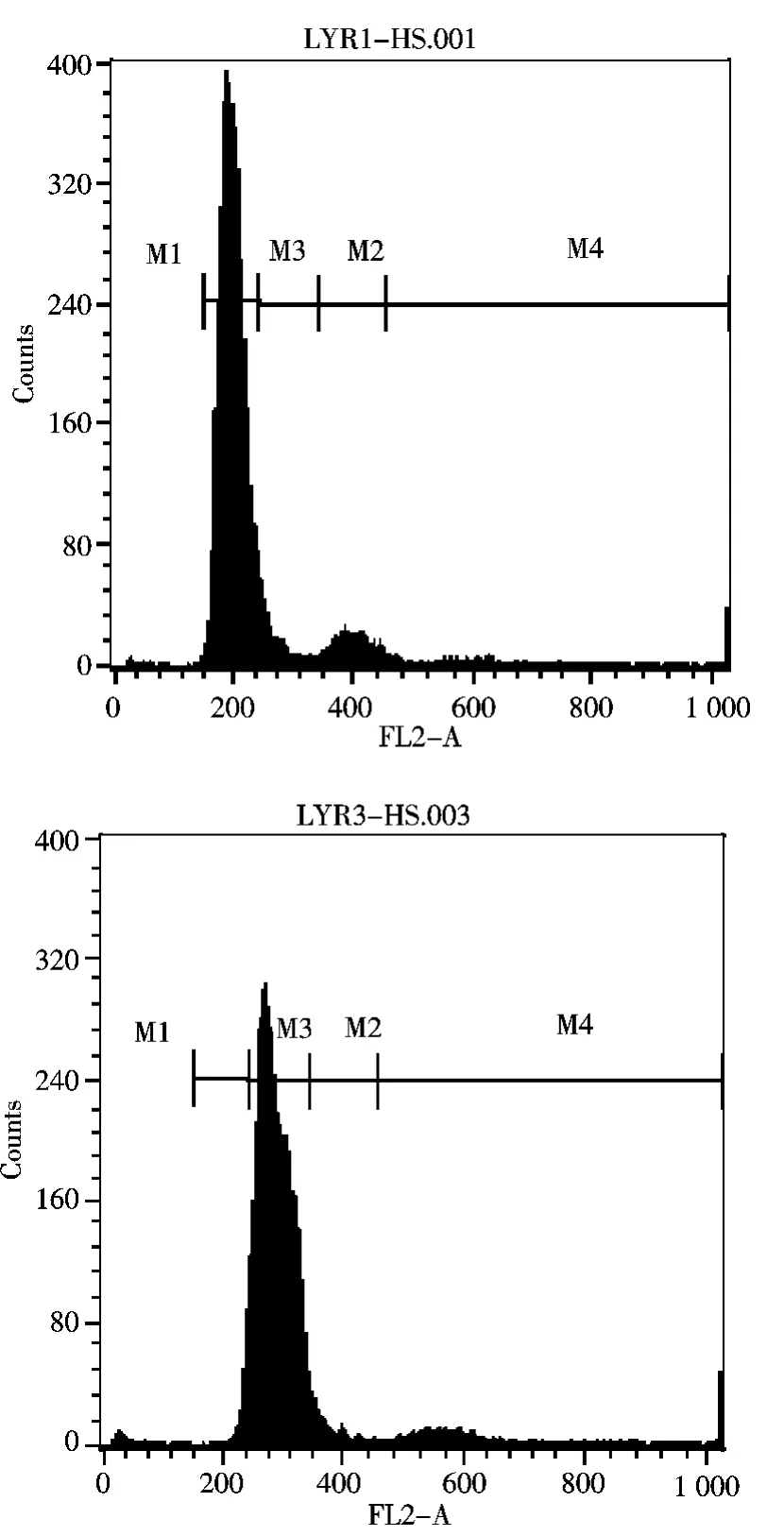
图1 二倍体及三倍体黄颡鱼DNA的相对含量Fig.1 DNA relative content of diploid and triploid Pelteobagrus fulvidraco
3 讨论
3.1 黄颡鱼三倍体诱导的适宜方法
人工诱导鱼类多倍体的常用的方法是温度休克和静水压休克,由于静水压休克设备要求高,目前的报道以温度休克为多.热休克方法首次被用来处理三刺鱼卵,获得了三倍体成鱼[11];随后,在鲟鱼、虹鳟和罗非鱼方面也获得了三倍体[12-14].冷休克方法:采用受精3min的三棘刺鱼卵,0℃休克1.5~3.0h,获得了三倍体幼鱼[11];对受精10min后的鲤鱼卵采用0℃休克10min,获得了三倍体幼鱼及成鱼[9];以4~5℃水在受精后5min处理黑鲷受精卵10~15min,从而获得三倍体[6].本实验表明,热休克及冷休克处理黄颡鱼受精卵均能在胚胎发育基本正常的前提下获得较高的三倍体诱导率.条件适当的热休克处理使黄颡胚胎倍化率达到了90%以上,超过其他任何诱导方式,为黄颡鱼三倍体诱导的适宜方法.冷热休克均能对黄颡受精卵第二极体(PB2)的释放产生抑制,这可能与黄颡鱼属温水性鱼类有关[3].
6-DMAP为嘌呤毒素类似物,能够抑制蛋白质磷酸化,通过作用于特定的酶,破坏微管聚合中心,阻止纺锤体形成,从而抑制极体释放[15].6-DMAP作为诱导剂广泛应用于贝类和鱼类多倍体的诱导[3,15].杨彩卿等[4]应用6-DMAP诱导黄颡鱼三倍体,得到与本实验相似的结果,但倍化率较低.CB是诱导水产动物多倍体的一种常用药物,它的作用机理是通过阻遏新微丝的形成,促进旧微丝解聚,使细胞分裂末期的收缩环难以形成,进而造成极体不能释放,染色体加倍[16].CB毒性较大,且有致癌性,水溶性较差,价格昂贵,不适合大规模生产[3].本实验表明,以CB诱导黄颡鱼三倍体,畸形率高、孵化率低、倍化率低.
3.2 黄颡鱼三倍体诱导的特点
常重杰等[17]应用热休克法对黄鳝的三倍体诱导率超过90%,静水压法对鳙鱼三倍体的诱导率为80%~100%[18],而该实验表明,热休克诱导黄颡鱼三倍体最高为93.3%,与其他三倍体诱导的鱼类相比,黄颡鱼的诱导率较高.
必须指出,在开展冷、热休克法黄颡鱼三倍体诱导得到高诱导率的同时,也容易造成较高的胚胎畸形率:40℃热休克造成的畸形率为32.5%~68.5%,冷休克法的畸形率为53.0%,CB处理组畸形率高达82.3%.因此,选择适宜的诱导方式不应仅考虑诱导率1个因素.
对黄颡鱼开展三倍体诱导时,温度休克的诱导效果明显优于化学药物.6-DMAP与CB大量应用于贝类多倍体诱导[19],贝类三倍体诱导率远高于其对黄颡鱼的诱导率.推测原因可能为:硬骨鱼类受精卵体积远大于贝类受精卵,且具有壳膜等附属保护性构造,导致在药物处理时,受精卵内药物浓度较低,无法有效抑制PB2的释放.
受精卵发育同步性是提高三倍体诱导效率的关键[19],因此鱼卵的质量与受精同步性尤为重要.实验过程中,6月上旬鱼卵质量较好,以后次之;注射激素后19~20h催产较好,时间过长导致卵子过熟;精子在生理盐水中不能久存,用刚解剖出来的精子进行授精最好.
借助人工干预受精过程的方法,诱导黄颡鱼三倍体,受人工授精和诱导技术的限制,容易造成较高的畸形率和较低的孵化率,且诱导率难以达到100%.多倍体育种实践表明,四倍体和二倍体杂交可生产100%三倍体[20],若人工诱导四倍体成功,将可探讨通过四倍体和二倍体杂交产业化生产三倍体的可能性.
[1] 尹洪滨,孙中武,姚道霞,等.黄颡鱼受精早期精子卵扫描电镜观察[J].动物学杂志,2007,42(4):95-100.
[2] 苏雪红.黄颡鱼人工繁殖及批量育苗技术研究[J].中国水产,2005(9):28-30.
[3] 谢湘筠.三倍体技术在鱼类育种中的应用[J].宁德师专学报:自然科学版,2006,18(4):361-364.
[4] 杨彩卿,韩烁.黄颡鱼三倍体的诱导[J].安徽农业科学,2008,36(19):8118-8119.
[5] 宋立民,袁立来,刘肖莲,等.2种鉴定黄颡鱼三倍体个体方法的比较[J].华中农业大学学报,2009,28(2):207-209.
[6] 尤锋.黑鲷三倍体的人工诱导研究[J].海洋与湖沼,1993,24(3):248-255.
[7] 林琪,吴建绍,曾志南.静水压休克诱导大黄鱼三倍体[J].海洋科学,2001,25(9):6-9.
[8] 桂建芳,肖武汉,梁绍昌,等.静水压休克诱导水晶彩鲫三倍体和四倍体的细胞学机理初探[J].水生生物学报,1995,19(1):49-55.
[9] OKIMA Y,MAKINO S.Triploidy induced by cold shock in fertilized eggs of the carp[M].Proc Japan Acadser B,1978(54):359-362.
[10] GALBREATH P F,SAMPLES B L.Optimization of thermal shock protocols for induction of triploidy in brooktrout[J].N Am J Aquacult,2000,62(4):249-259.
[11] SWARUP H.Production of heteroploidy in the three-spined stickleback Gosterosteus aculeatus(L)[J].Nature,1956, 178:1124-1125.
[12] VASETSKII S G.Changes in the ploidy of sturgeon larvae induced by heat treated of eggs of different stages of development[J].Dokl Akad Nauk,1967,172:1234-1237.
[13] CHOURROUT D.Tetraploidy induced by heat shocks in the rainbow trout(Salmo gairdneri R.)[J].Rep Nut Dev,1982,22(3):569-574.
[14] DON J,AVTALION R R.The induction of triploidy in Oreochromis aureus by heat shock.[J].Theor Appl Genet,1986,72:186-192.
[15] DESORSIER S R,GERARD A,PEIGNON J M.A novel method to produce triploids in bivalve molluscs by the use of 6-demethylaminopurine[J].J Exp Mar Boil Ecol,1993,170(1):29-43.
[16] GUO X,ALLEN S K Jr.VIABEL tetraploids in pacific oyster Crassostrea gigas(Thunberg)produced by inhibiting polor body I in eggs from triploids[J].Mol Mar Biol Biotech,1994,3(1):42-50.
[17] 常重杰,杜启艳,卢龙斗,等.热休克诱导三倍体黄鳝的研究[J].河南师范大学学报:自然科学版,1997,25(2):60-63.
[18] ALDRIDGE F J,MARSTON R Q,SHIREMAN J V.Induced triploids and tetraploids in Bighead carp,Hypophthalmichthys nobilis,verified by multi-Embryo cytofluorometric analysis[J].Aquaculture,1990,87(2):121-131.
[19] 李永仁,阙华勇,张国范.抑制栉孔扇贝第一极体对受精卵染色体行为及胚胎倍性组成的影响[J].海洋科学,2005,29(8):66-70.
[20] 阙华勇,张国范,刘晓,等.雄性四倍体与雌性二倍体杂交培育全三倍体长牡蛎(Crassostrea gigas)的研究[J].海洋与湖沼,2003,34(6):656-662.
(责任编校 纪翠荣)
Comparative study on triploid inducement methods in Pelteobagrus fulvidraco
LI Yong-ren,DONG Shao-jie,CHEN Li-mei,YANG Guang
(a.Department of Fishery Sciences,b.Tianjin Key Laboratory of Aqua-ecology and Aquaculture,Tianjin Agricultural College,Tianjin 300384,China)
Heat shock,cold shook,6-DMAP and CB were used for triploid inducement in Pelteobagrus fulvidraco to ascertain a feasible method.The result indicated that all the four methods can induce triploid embryo from zygotes.The induction rate and hatching rate were 93.3%and 78.6%respectively from the zygotes treated by heat shock for 2minutes with 40℃water after fertilization 8minutes,and cold shock for 15minutes with 4℃water after fertilization 3minutes cause 63.3%of induction rate and 82.3%of hatching rate.Lower induction rate were 26.7%and 10.0%from the zygotes treated by 6-DMAP and CB respectively.In balance,the feasible methods for triploid inducement in Pelteobagrus fulvidraco were heat shock and cold shock.
Pelteobagrus fulvidraco;triploids;inducement
book=2012,ebook=77
Q953.3
A
1671-1114(2012)02-084-04
2011-08-31
天津市基础研究与前沿计划资助项目(08JCYBJC27800);天津市教委基金资助项目(2008ZD21).
李永仁(1978-),男,讲师,从事水产动物遗传育种方面的研究.
杨 广(1965-),男,教授.主要从事水产养殖与病害防治方面的研究.

