卵巢肿瘤干细胞中趋化因子的表达与细胞侵袭转移能力的关系
李 青 汪 艳 张 曦 朱慧芬 唐良萏
1.重庆医科大学附属第一医院妇产科,重庆 400016;2.安徽医科大学附属安庆医院妇产科,安徽安庆 246000
卵巢肿瘤干细胞中趋化因子的表达与细胞侵袭转移能力的关系
李 青1,2汪 艳2张 曦2朱慧芬2唐良萏1▲
1.重庆医科大学附属第一医院妇产科,重庆 400016;2.安徽医科大学附属安庆医院妇产科,安徽安庆 246000
目的探讨卵巢肿瘤干细胞中趋化因子的表达与细胞侵袭转移能力的关系,为卵巢肿瘤的治疗提供新的研究思路和药物作用靶点。 方法 采用流式细胞术与RT-PCR方法检测卵巢肿瘤干细胞系CAOV-3中CXCR4的表达,通过体外微孔隔离室(Transwell)检测CXCR4对CAOV-3细胞侵袭转移能力的影响。 结果 CXCR4在CAOV-3中细胞呈阳性表达,CXCL12可促进CAOV-3细胞的迁移,CXCR4的封闭能抑制CXCL12对CAOV-3迁移的促进作用。 结论CXCL12-CXCR4相互作用可促进卵巢肿瘤干细胞侵袭转移,在卵巢肿瘤的生长和侵袭转移过程中起着重要作用。
卵巢肿瘤干细胞;CXCL12;CXCR4;CAOV-3;侵袭转移
▲通讯作者:唐良萏,教授,博士生导师。
随着社会经济的发展与环境的各种影响,当前我国卵巢肿瘤发病率越来越高,并且预后严重。2009年有调查显示,我国卵巢肿瘤死亡率居女性生殖道恶性肿瘤之首。众所周知,卵巢肿瘤一个很重要的特征就是容易发生细胞侵袭转移,这种转移特性除了与患者自身原因有关外,卵巢肿瘤干细胞中的趋化因子发挥了重要的作用[1]。已有研究表明多种趋化因子可在卵巢恶性肿瘤中高表达,如近年研究较多且作用较肯定的有白细胞介素8(IL-8)、单核细胞趋化蛋白-1(MCP-1)和巨噬细胞炎性蛋白-1(MIP-1)等。 CXCR4(CXC chemokinereceptor 4)是一种趋化因子受体,能在卵巢肿瘤干细胞上特异表达,是当前研究的14个趋化因子受体中唯一在卵巢肿瘤干细胞上表达的;趋化因子CXCL12族(过去又称SDF-1,stromal cell derived factor-1)与其特异性受体CXCR4所构成的复合体在多卵巢肿瘤的分布与侵袭转移中发挥着重要的作用[2]。本研究从体外实验水平探讨卵巢肿瘤干细胞CXCR4表达变化对卵巢肿瘤细胞侵袭转移的影响,希望为卵巢肿瘤的治疗提供新的研究思路和药物作用靶点。
1 资料与方法
1.1 卵巢肿瘤干细胞的培养
本实验所用CAOV-3卵巢细胞株和Anglne细胞株分别购自中国科学院上海细胞所与北京微生物所,将细胞分别接种于含10%胎牛血清标准培养基中,在37℃、5%CO2、饱和湿度环境中培养24 h,确保细胞数不少于1×104个。
1.2 卵巢肿瘤干细胞稳定表达CXCR4体系的建立
取 2×107细胞,PBS(磷酸盐缓冲液)洗 2 次,SIGMA Trizol试剂盒一步法提取卵巢肿瘤干细胞总RNA。Promega反转录试剂盒进行反转录-聚合酶链反应(RT-PCR),以tubulin作为内参照,取2.5 μL反转录PCR产物在1.5%琼脂糖凝胶上电泳,溴化乙啶染色,紫外光检测仪观察PCR合成结果。引物(北京三博合成):正向 5’-TACCATGCCAGGGGATCA-3’,反向 5’-CTTGGCCTGTGACTGTT-3’,PCR 产物长度约为450 bp。同时也采用免疫荧光标记流式细胞术分析法检测卵巢肿瘤干细胞CXCR4的表达。
1.3 趋化活性检测
本组卵巢肿瘤干细胞达CXCR4体系趋化活性检测采用Transwell分析:细胞稳定生长至70%~90%融合时,PBS清洗两遍,然后用无血清培养液把多细胞组合培养成单细胞悬液,显微镜下计数细胞,PBS清洗浓度调至1×106细胞/mL。将Transwell侵袭小室放入24孔板内,卵巢肿瘤干细胞接种于Transwell侵袭小室的上室,每上室加0.2 mL单细胞悬液,下室加0.4 mL无血清培养液,然后分为5组:(1)上室为包含单细胞悬液的无血清培养液,下室纯为无血清培养液。(该组为对照组)(2)上室为包含单细胞悬液的无血清培养液,下室包含CXCL12(浓度为10 ng/mL)的无血清培养液。(3)上室为包含单细胞悬液的无血清培养液,下室为包含CXCL12(浓度为100 ng/mL)的无血清培养液。(4)上室为包含CXCR4中和抗体(浓度为10 μg/mL)的无血清培养液,下室为包含CXCL12(浓度为10 ng/mL)的无血清培养液。(5)上室为包含CXCR4拮抗剂AMD3100(浓度为10 μg/mL)和单细胞悬液的无血清培养液,下室为包含CXCL12(浓度为100 μg/mL)的无血清培养液。培养后将上面5种方法培养后的细胞用PBS冲洗2次,棉拭子擦去未侵袭转移的细胞,无菌风干后用0.1%结晶紫染色20 min,然后用自来水冲洗干净。400倍显微镜下每张切片随机记录3个视野的侵袭转移细胞数,然后进行平均统计,观察CXCR4的表达对卵巢肿瘤干细胞侵袭转移的影响。
1.4 统计学处理
应用SPSS 15.0统计软件进行数据处理,侵袭转移数据均以均数±标准差(±s)表示,两两比较应用 χ2检验,P < 0.05代表差异有统计学意义。
2 结果
2.1 CXCR4的表达
流式细胞术检测结果提示,CAOV-3卵巢细胞株表达中等量的CXCR4分子,RT-PCR则进一步证实该细胞存在一定量的CXCR4分子的转录。而在Anglne细胞中CXCR4无表达。具体情况见图1。
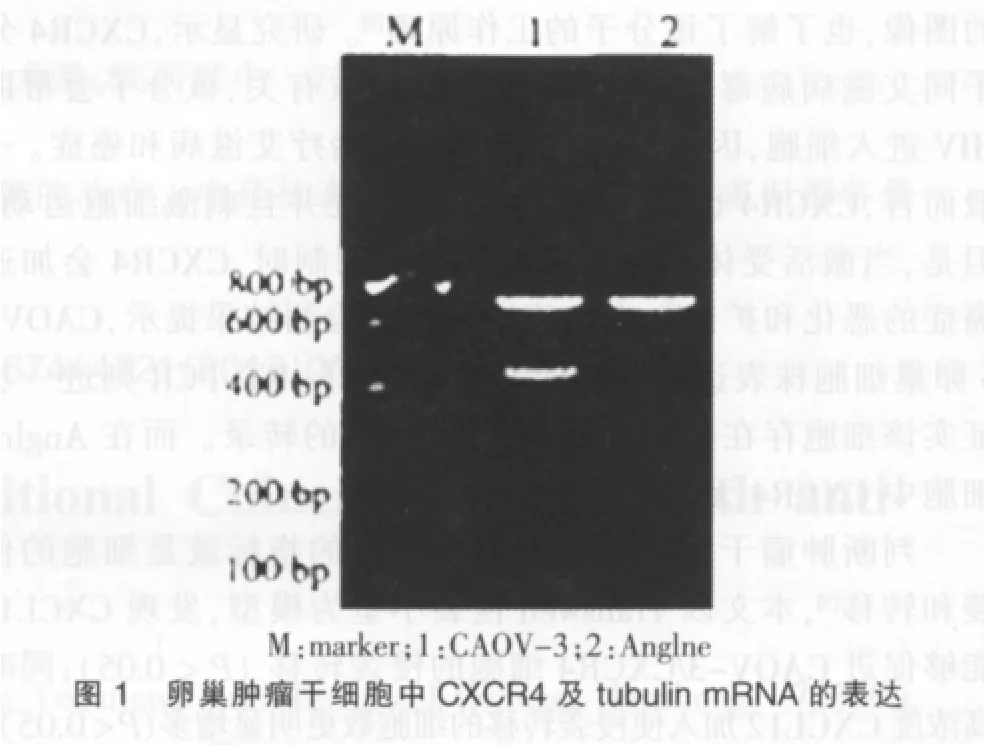
2.2 CXCR4的表达对卵巢肿瘤干细胞侵袭转移的影响
对于CAOV-3/CXCR4细胞来说,当Transwell小室的下室中加入10 ng/mL的CXCL12时,发生侵袭转移的细胞数与对照组相比增多(P<0.05);100 ng/mL CXCL12加入使侵袭转移的细胞数更明显增多(P<0.05),也明显高于10 ng/mL CXCL12组;不过当上室加入10 ng/mLCXCR4中和抗体或10 μg/mL CXCR4拮抗剂AMD3100时,能抑制CXCL12对卵巢肿瘤干细胞的趋化性侵袭转移 (P<0.05),同时拮抗剂AMD3100加入时下降趋势更加明显(P<0.05)。具体情况见表1。
3 讨论
众所周知,肿瘤的发生转移是一个复杂的、微观的、多信号的连续多阶段过程,肿瘤发生转移过程涉及肿瘤干细胞的发生、成熟、运动、侵袭、转移、黏附和消亡。与其他多种类型的肿瘤细胞不同,卵巢肿瘤干细胞具有独特的侵袭转移规律,这种转移特性除了与患者自身原因有关外,卵巢肿瘤干细胞中的趋化因子发挥了重要的作用[3]。
表1 CXCR4的表达对卵巢肿瘤干细胞侵袭转移的影响(±s)

表1 CXCR4的表达对卵巢肿瘤干细胞侵袭转移的影响(±s)
注:与对照组相比,*P<0.05;与10 ng/mL CXCL12组相比,#P<0.05;与100 ng/mL CXCL12组相比,△P<0.05
项目 对照组 10 ng/mL CXCL12组 100 ng/mL CXCL12组 CXCR4抗体组 AMD3100组CAOV-3 CAOV-3/CXCR4 185.62±8.56 226.01±15.96 175.62±15.12 249.21±13.21*178.62±17.10 581.62±16.32#178.12±18.21 246.21±15.24△169.25±18.32 145.26±30.02△
趋化因子(chemokines)是一类具有趋化作用的细胞因子,是指具有吸引白细胞移行到感染部位的一些低分子量趋化因子(多为 8-10KD)的蛋白质(如 IL-8、MCP-1等),在炎症反应中具有重要作用[4]。趋化因子的主要作用是趋化细胞的迁移,细胞沿着趋化因子浓度增加的信号向趋化因子源处的迁徙[5]。有些趋化因子在免疫监视过程中控制免疫细胞趋化,如诱导淋巴细胞到淋巴结。有些趋化因子在发育中起作用;他们能刺激新血管形成;提供具体的关键信号而促成细胞成熟。其他趋化因子可以因应对细菌感染、病毒感染由多种细胞释放;也可以因非感染性的刺激如二氧化硅吸入,尿路结石等而释放。炎性趋化因子的主要作用是趋化白细胞从血循环到感染或组织损伤部位。有的趋化因子也可以促进伤口愈合[6]。
CXCR4是白细胞中的一种受体,在免疫系统中起着调整细胞运动的重要作用。当前大量的研究提示CXCR4有可能在肿瘤发生、侵袭转移中发挥重要的作用。Vanderbilt-Ingram癌症中心的科学家们发现,CXCR4作为受体,在神经胶质瘤的扩散过程中扮演着极其关键的角色[7]。但研究者们也表示,阻止CXCR4发挥受体的功能,虽然能大大削弱癌细胞扩散的能力,但不能完全制止它们的扩散。国外还有研究显示约80%卵巢肿瘤组织中有CXCL12的受体CXCR4的表达,在95%卵巢肿瘤腹水中发现CXCL12,而在正常卵巢上皮中却没有表达[8]。2010年10月8日报道,美国科学家在最新出版的《科学》杂志报告称,他们获得了CXCR4分子结构的图像,也了解了该分子的工作原理[9]。研究显示,CXCR4分子同艾滋病病毒(HIV)感染和癌症扩散有关,该分子会帮助HIV进入细胞,因此,阻断该分子有望治疗艾滋病和癌症。一般而言,CXCR4也有助于激活免疫系统并且刺激细胞运动,但是,当激活受体的信号没有被正确调制时,CXCR4会加速癌症的恶化和扩散[7]。本文流式细胞术检测结果提示,CAOV-3卵巢细胞株表达中等量的CXCR4分子,RT-PCR则进一步证实该细胞存在一定量的CXCR4分子的转录。而在Anglne细胞中CXCR4无表达[10]。
判断肿瘤干细胞恶性程度最准确的指标就是细胞的侵袭和转移[9],本文以Transwell侵袭小室为模型,发现CXCL12能够促进CAOV-3/CXCR4细胞的侵袭转移 (P<0.05);同时高浓度CXCL12加入使侵袭转移的细胞数更明显增多(P<0.05),也明显高于10 ng/mL CXCL12组;不过当上室加入10 ng/mL CXCR4中和抗体或10 μg/mL CXCR4拮抗剂AMD3100时,能抑制CXCL12对卵巢肿瘤干细胞的趋化性侵袭转移(P<0.05),同时拮抗剂AMD3100加入时下降趋势更加明显(P<0.05)。表明CXCL12-CXCR4生物轴对卵巢肿瘤干细胞的侵袭转移有重要的影响。
总之,CXCL12-CXCR4相互作用可促进卵巢肿瘤干细胞侵袭转移,在卵巢肿瘤的生长和侵袭转移过程中起着重要作用。因此我们推断抑制肿瘤细胞表面CXCR4的表达,干扰CXCL12-CXCR4的相互作用可能是抗肿瘤转移的一个有意义的研究思路和药物作用靶点。同时本研究成功构建高表达CXCR4的卵巢肿瘤干细胞株CAOV-3/CXCR4,为后续研究提供平台和工具。
[1]Taichan RS,Cooper C,Keller ET,et al.Use of the stromal cell-derived factor-1/CXCR4 pathway in prostate cancer metastasis to bone[J].Cancer Res,2002,62(2):1832-1837.
[2]Burger M,Glodek A,Hartmann T, et al.Functional expression of CXCR4(CD184)on small-cell lung cancer cells mediates migration,integrin activation and adhesion to stromal cells[J].Oncogene,2003,22 (6):8093-8101.
[3]Zeelenberg IS,Ruuls-Van Stalle L, Roos E,et al.The chemokine receptor CXCR4 is required for outgrowth of colon carcinoma micrometastases[J].Cancer Res,2003,63(13): 3833-3839.
[4]Kijima Z,Maulik G,Ma PC,et al.Regulation of cellular proliferation,cytoskeletal function,and signal transduction through CXCR4 and-c-Kit in small cell lung cancer cells[J].Cancer Res,2002,62(21):6304-6311.
[5]Jiang YP,Wu XH,Shi B,et al.Expression of chemokine CXCL12 and its receptor CXCR4 in human epithelial ovarian cancer:An independent prognostic factor for tumor progression[J].Gynecol Oncol,2006,103(1):226-233.
[6]王晓翊,卢实,林晓琰,等.SDF-1/CXCR4对卵巢上皮性癌细胞增殖和侵袭的影响[J].现代妇产科进展,2008,17(4):254-258.
[7]王琪,张玮,黎丹戎,等.两种卵巢恶性肿瘤潜在血清标记物的纯化鉴定及临床验证[J].中华医学杂志,2008,15(9):1012-1016.
[8]Antoine WT,Robbert V,Linda MP,et al.Novel insights in the regulation of CCLl 8 secretion by monocytes and dendritic cells via cytokines,Toll-like receptors and rheumatoid synovial fluid[J].BMC Immunol,2006,7(23):1-12.
[9]Beili Wu,Ellen Y.T.Chien,Clifford D,et al.Structures of the CXCR4 Chemokine GPCR with Small-Molecule and Cyclic Peptide Antagonists[J].Science,2010,10(11):26-30.
[10]Alfonso P,Latre P,Bias I.Clinical Evaluation of CCLl8/PARC and Chitotriosidase Biomarkers in Gaucher Disease[J].Blood(ASH Annual Meeting Abstracts),2005,106(2):3885-3890.
The relation of chemokine expression and cell invasion and metastasis in the ovarian cancer stem cells
LI Qing1,2WANG Yan2ZHANG Xi2ZHU Huifen2TANG Liangdan1
1.Department of Obstertrics and Gynecology,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China;2.Department of Obstertrics and Gynecology,the Affiliated Anqing Hospital of Anhui Medical University,Anqing 246000,China
ObjectiveTo investigate the ovarian tumor stem cells chemokine expression and cell invasion and metastasis ability of relation,for the treatment of ovarian tumors to provide new research ideas and targets of drug action.Methods Expression of CXCR4 in ovarian cancer cellline CAOV-3 was detected by reverse transcriptase—polymerase chain reaction(RT-PCR)and flow cytometry;Transwell was used to analyze the invasion and metastasis of CAOV-3 cells in presence of CXCL12 or when CXCR4 was blocked by anti-CXCR4.Results CXCR4 in CAOV-3 cells showed positive expression,CXCL12 induced the invasion and metastasis of CAOV-3 cells,which could be effectively blocked by anti-CXCR4.Conclusion CXCL12-CXCR4 interactions may promote ovarian tumor stem cells invasion and metastasis,in ovarian tumor growth and metastasis plays an important role in the process.
Ovarian cancer stem cells;CXCL12;CXCR4;CAOV-3;Invasion and metastasis
R737.31
A
1674-4721(2012)06(a)-0010-03
安徽省2010年度第四批科技计划项目(10020503083)。
李青(1970-),男,在读博士,副主任医师。
2012-05-14 本文编辑:马 双)

