Akt/GSK-3β介导高糖上调肾小管上皮细胞Snail1的表达*
余 红, 石明隽, 肖 瑛, 刘瑞霞, 王圆圆, 郭 兵, 张国忠
(贵阳医学院病理生理学教研室,贵州贵阳550004)
我们前期的研究发现,在高糖培养和糖尿病肾病(diabetic nephropathy,DN)大鼠肾小管上皮细胞中Snail1表达上调[1],以siRNA抑制Snail1表达后,肾小管上皮细胞上皮-间充质转化(epithelial-mesenchymal transition,EMT)标志蛋白表达出现逆转[2]。并且有研究表明Snail1在人IgA肾病和糖尿病肾病患者肾小管上皮细胞表达增多[3],提示Snail1促进肾小管上皮细胞EMT,参与了糖尿病肾损伤的病理过程。但对DN时Snail1表达上调的机制认识还十分有限。最近研究报道,DN肾小管上皮细胞EMT过程常常伴有蛋白激酶B(Akt)和糖原合成激酶3β(glycogen synthase kinase 3β,GSK-3β)的激活或异常表达[4,5],提示它们参与了 DN 的发病机制。本研究旨在观察Snail1、Akt和GSK-3β在高糖培养肾小管上皮细胞的表达变化,分析Akt/GSK-3β途径与Snail1表达的关系。
材料和方法
1 材料
1.1 主要抗体和试剂 兔抗大鼠Akt1单克隆抗体、小鼠抗大鼠β-actin单克隆抗体、链亲和素-生物素-过氧化物酶(SABC)试剂盒、生物素标记羊抗兔或羊抗小鼠IgG-HRP和兔抗羊IgG-HRP(武汉Boster);兔抗大鼠p-Akt(Ser473)多克隆抗体和ECL化学发光试剂盒(江苏碧云天生物技术研究所);兔抗大鼠p-GSK-3β(Ser9)多克隆抗体(Cell Signal);羊抗大鼠GSK-3β多克隆抗体和羊抗大鼠Snail1多克隆抗体(Santa Cruz);低糖DMEM培养基和胰蛋白酶(HyClone);胎牛血清(fetal bovine serum,FBS;Gibco);转铁蛋白(Sigma);LY294002(Calbiochem);总RNA提取试剂盒、蛋白质 marker、2×Taq PCR MasterMix和600 bp DNA marker(天根);RevertAidTMFirst Strand cDNA Synthesis Kit(Fermentas)。PVDF膜、3 mm Whatman滤纸(Millipore)。
1.2 动物 雄性SD大鼠,清洁级,鼠龄20 d,体重(40±10)g,由贵阳医学院实验动物中心提供。
2 方法
2.1 大鼠原代肾小管上皮细胞(renal tubular epithelial cells,RTECs)的培养和鉴定 大鼠乙醚麻醉后股动脉放血处死。无菌取肾后,除去肾髓质部分,分离、剪碎肾皮质并置于80目、100目不锈钢网筛过滤,分离肾小管节段。加入0.25%胰蛋白酶37℃水浴消化30 min,1 000 r/min离心,弃上清。加入含有10%FCS的DMEM培养液,接种于25 cm2培养瓶中。置孵育箱(37℃、5%CO2)培养。72 h后全量更换培养液,以后每2~3 d换1次培养液。第5~6 d细胞贴壁生长达瓶底面积的80% ~90%时以0.5 mL 0.25% 胰蛋白酶消化液消化、传代。倒置显微镜观察细胞形态和生长特性,免疫细胞化学检测CK-18和α-SMA表达,鉴定所培养的细胞[2]。取第3代细胞实验。
2.2 实验分组 细胞生长融合至约90%时,换无血清DMEM培养基培养24 h,使细胞生长同步将细胞分为:(1)对照组:DMEM(含糖5.5 mmol/L)+2%FBS培养;(2)高渗组:20 mmol/L D-mannitol+DMEM+2%FBS培养;(3)高糖组:20 mmol/L D-glucose+DMEM+2%FBS培养,分别在30 min、2 h、6 h、12 h、24 h、48 h 和 72 h 收集细胞提取蛋白和RNA;(4)LY294002抑制剂组:LY294002稀释为 25 μmol/L,预处理细胞 50 min,再以 25 μmo/L LY294002+DMEM+2%FCS+20 mmo/L D-glucose 5 mL培养细胞24 h。24 h后收集细胞蛋白。每一实验组均重复3次。
2.3 免疫细胞化学 细胞爬片经4%多聚甲醛固定,0.5%Triton X-100打孔,3%H2O2去除内源性过氧化物酶,血清封闭后,分别加入抗 CK-18(1∶100)和抗 α-SMA(1∶200)抗体,4 ℃孵育过夜,加入生物素化Ⅱ抗,室温下孵育40 min。DAB显色。PBS代替Ⅰ抗作阴性对照。
2.4 RT-PCR 按照试剂盒说明提取原代培养肾小管上皮细胞总RNA,并逆转录为cDNA。以cDNA为模板扩增 Snail1、Akt1、GSK-3β 和 β-actin,天根公司2×Taq MasterMix试剂盒行PCR扩增。引物由上海捷瑞生物工程技术服务有限公司合成,引物序列见表1。PCR扩增条件:95℃ 5 min预变性,94℃ 45 s变性,45 s退火,70℃ 45 s延伸,72℃ 10 min总延伸。1.5%琼脂糖凝胶电泳检测反应产物,凝胶成像系统扫描并分析扩增产物的积分吸光度值,以目标产物/β-actin积分吸光度比值表示靶基因的相对水平。
2.5 Western blotting 加 RIPA 裂解液 100 μL,12 000 r/min,4℃离心20 min,取上清。BCA法测蛋白浓度,加样缓冲液变性蛋白,上样,SDS-PAGE凝胶垂直电泳后,电转移至PVDF膜,5%脱脂奶粉室温封闭1 h,含0.05%Tween 20 的 TBS(TBS-T)冲洗后,分别以 anti-Snail1(1∶300)、anti-Akt1(1∶200)、anti-p-Akt(1∶300)、anti-GSK-3β(1∶300)、anti-p-GSK-3β(1∶300)和anti-β-actin抗体(1∶300)与PVDF膜4℃孵育过夜。加入用含1%脱脂牛奶的TBS-T稀释辣根过氧化物酶连接的相应Ⅱ抗,室温孵育2 h,ECL化学发光显影。Bio-Rad凝胶成像系统进行图像采集和分析,以β-actin蛋白条带作内参照,计算靶蛋白条带与βactin蛋白条带灰度的百分比值作为靶蛋白表达的相对水平。

表1 PCR引物序列及扩增条件Table 1.Sequences and conditions of the primers used in PCR
3 统计学处理
结 果
1 大鼠原代肾小管上皮细胞鉴定
倒置显微镜下可见,从培养24 h开始,卵圆形上皮样细胞围绕接种的肾小管节段呈岛屿状长出,约第3~4 d形成集落,形态呈典型的多边鹅卵石样。经胰酶消化传代后,肾小管上皮细胞以单个细胞贴壁并呈对数生长,符合上皮细胞生长特性。免疫细胞化学结果显示培养的细胞胞浆CK18蛋白表达阳性,α-SMA蛋白表达阴性,说明培养细胞为肾小管上皮细胞。
2 高糖培养不同时点原代肾小管上皮细胞Snail1、Akt1和GSK-3β mRNA的表达
在原代培养的RTECs,正常糖对照组Snail1和Akt1 mRNA少量表达,高糖刺激30 min即可检测到Snail1和Akt1 mRNA表达较正常对照组明显增多,差异显著,并随高糖刺激时间的延长逐渐增加。高渗组和正常糖组比较,Snail1、Akt1 mRNA表达无显著差异。高糖刺激后GSK-3β mRNA的表达与正常糖和高渗组比较无显著差异,见图1。
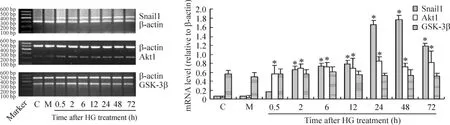
Figure 1.Expression of Snail1,Akt1 and GSK-3β mRNA detected by RT-PCR in primary cultured renal tubular epithelial cells incubated in normal-glucose(control,C),mannitol(M)and high-glucose(HG)media at different time points.±s.n=3.*P < 0.01 vs C.图1 Snail1、Akt1和GSK-3β mRNA在不同处理组原代培养肾小管上皮细胞的表达
3 高糖培养不同时点原代肾小管上皮细胞Snail1、Akt1、p-Akt、GSK-3β和 p-GSK-3β蛋白的表达
Snail1蛋白在正常糖对照组肾小管上皮细胞几乎不表达,高糖培养后Snail1蛋白随培养时间延长而呈递增趋势。从高糖培养30 min起Snail1蛋白表达即较正常糖对照组显著增加,至72 h Snail1蛋白表达虽有减少,但仍高于正常糖组。正常糖组Akt1、p-Akt和p-GSK-3β蛋白有少量表达,高糖刺激30 min始肾小管上皮细胞三者表达均显著增多,Akt1随刺激时间延长逐渐增加,而p-Akt和 p-GSK-3β蛋白于24 h达高峰,此后略有下降。高糖刺激对总GSK-3β蛋白表达无显著影响。各时点高渗组 Snail1、Akt1、p-Akt、GSK-3β 和 p-GSK-3β蛋白的表达与正常糖组比较无明显差异,见图2。

Figure 2.Expression of Snail1,Akt1,p-Akt,GSK-3β and p-GSK-3β proteins detedted by Western blotting in primary cultured renal tubular epithelial cells incubated in normal-glucose(M),mannitol and high-glucose(HG)media at different time points.±s.n=3.#P<0.05,*P<0.01 vs C.图2 Snail1、Akt1、p-Akt、GSK3β和p-GSK3β蛋白在不同处理组原代培养肾小管上皮细胞的表达
4 LY294002 处理对 Snail1、Akt1、p-Akt、GSK-3β和p-GSK-3β蛋白表达的影响
在培养的RTECs,高糖刺激后Snail1、p-Akt和p-GSK-3β蛋白表达明显增加,LY294002处理组Snail1、p-Akt和p-GSK-3β表达较高糖组明显减少。但LY294002对总Akt1和总GSK-3β蛋白的表达没有显著影响,见图3。

Figure 3.Effects of LY294002,a PI3K inhibitor,on Snail1,Akt1,p-Akt,GSK-3β and p-GSK-3β protein expression in primary cultured renal tubular epithelial cells incubated with high glucose.The protein expression was examined by Western blotting assay.C:control;HG:high glucose;In:LY294002+high glucose.±s.n=3.*P<0.05,**P<0.01 vs C;##P <0.01 vs HG.图3 LY294002对高糖培养肾小管上皮细胞Snail1、Akt1、p-Akt、GSK-3β和p-GSK-3β蛋白表达的影响
5 相关性分析
对体外培养各组肾小管上皮细胞中Snail1蛋白与p-Akt和p-GSK-3β蛋白的表达量进行相关性分析,结果发现,Snail1蛋白表达分别和p-Akt、p-GSK-3β 蛋白表达呈正相关(r=0.794,P <0.01;r=0.755,P <0.01)。
讨 论
我们利用原代肾小管上皮细胞研究高血糖引起肾脏损伤的发病机制,相对于细胞株,原代肾小管上皮细胞直接来源于机体组织,更接近和反映体内生长特性。培养的细胞经形态学和免疫细胞化学鉴定,其形态符合小管上皮细胞的特点,上皮细胞标志物CK-18蛋白表达阳性,且未见间质细胞标志蛋白α-SMA表达,证实我们分离培养的细胞为肾小管上皮细胞。研究以相同渗透压的甘露醇为对照,排除渗透压变化的影响,动态观察不同培养条件和不同时点相关指标的变化与高血糖状态的关系。
本研究发现,高糖培养30 min肾小管上皮细胞Snail1蛋白表达开始增加,至24 h时都维持于较高水平,48 h和72 h后表达有所下降,但表达量仍然明显高于对照组。Snail1 mRNA也表现出相似的趋势。这提示Snail1基因在正常肾组织中保持沉默,而在糖尿病时异常激活,通过蛋白表达而发挥作用。与本课题组前期的发现及其他学者的报道一致[1,3]。另外,我们还发现,高糖培养各时点肾小管上皮细胞Snail1蛋白表达上调同时伴有Akt1、p-Akt和p-GSK-3β蛋白表达的增加以及Akt1 mRNA的表达增加,而高渗透压对这些指标没有影响。这说明,糖尿病时,引起 Snail1、Akt1、p-Akt和p-GSK-3β 蛋白或mRNA表达改变的主要原因并非高渗透压,而是高血糖本身;高糖不仅能上调Akt1总蛋白的表达,同时还激活Akt信号分子,但高糖并不影响总GSK-3β蛋白的表达水平,只是使其功能状态发生改变。这种改变可能是高糖激活 Akt后,进而使GSK-3β磷酸化失活的结果。
Snail1 mRNA于高糖刺激2 h开始有意义增高,晚于蛋白的增高,提示高糖引起Snail1蛋白表达上调不仅是通过转录水平调节,还存在其它调节机制。最近对肝细胞癌、皮肤癌等肿瘤的研究表明,Snail1的表达可能受到Akt/GSK-3β介导的翻译后机制调节。活化的Akt能与 GSK-3β结合,诱导 GSK-3β向细胞膜转位,磷酸化其N端的Ser9活性位点使之失活。无活性的p-GSK-3β使Snail1泛素化降解减少,核移位增加,促进EMT标志蛋白的转录调节[6-9]。我们观察到,高糖诱导的肾小管上皮细胞Snail1蛋白过表达同时伴有p-Akt和p-GSK-3β蛋白表达的增加。而最近研究也报道,Akt信号分子及其下游GSK-3β磷酸化后活性改变,与TGF-β1等因素诱导的肾纤维化中肾小管EMT过程有关[10-11]。那么,在糖尿病肾间质纤维化损害中,是否Akt/GSK-3β信号通路也参与了Snail1表达的调节,进而调节EMT?我们以LY294002处理高糖培养的RTECs。LY294002为Akt上游信号分子磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)的特异性抑制剂,以往研究表明,LY294002可通过特异的竞争性抑制PI3K p110亚基的ATP结合位点而抑制PI3K的催化活性,进而抑制Akt的激活。以LY294002处理后,高糖培养的RETCs p-Akt蛋白、p-GSK-3β及Snail1蛋白表达均减少,但总Akt1和GSK-3β蛋白的表达不受影响。而且,相关性分析显示,Snail1蛋白的表达不仅与p-Akt蛋白表达高度正相关,也与p-GSK-3β蛋白表达正相关。这一结果提示,高糖条件下,Akt可能通过PI3K依赖的方式被激活,进而使 GSK-3β磷酸化失功能,Snail1降解减少,促进了Snail1表达上调。最近Lee等[5]分别以Akt抑制剂和GSK-3β抑制剂处理高糖培养的肾小管上皮细胞,Akt抑制剂逆转高糖引起的GSK-3β磷酸化失活,GSK-3β活性受到抑制剂抑制后,则出现Snail1蛋白的蓄积和EMT,与我们的结果相似。
综上所述,我们推测高糖可能经Akt/GSK-3β途径使肾小管上皮细胞Snail1蛋白水平上调。因此,DN时可能存在Akt/GSK-3β/Snail1的功能轴,通过促进肾小管上皮细胞的转化而导致肾纤维化。
[1] 方开云,张国忠,娄晶磊,等.锌指转录因子Snail1在糖尿病大鼠肾组织中的表达[J].中国病理生理杂志,2008,24(4):737-742.
[2] 方开云,石明隽,肖 瑛,等.Snail1 siRNA对高糖诱导肾小管上皮细胞表型转变的影响[J].中国病理生理杂志,2009,25(12):2424-2429.
[3] Ohnuki K,Umezono T,Abe M,et al.Expression of transcription factor Snai1 and tubulointerstitial fibrosis in progressive nephropathy[J].J Nephrol,2012,25(2):233-239.
[4] Hao J,Liu S,Zhao S,et al.PI3K/Akt pathway mediates high glucose-induced lipogenesis and extracellular matrix accumulation in HKC cells through regulation of SREBP-1 and TGF-β1[J].Histochem Cell Biol,2011,135(2):173-181.
[5] Lee YJ,Han HJ.Troglitazone ameliorates high glucose-induced EMT and dysfunction of SGLTs through PI3K/Akt,GSK-3β,Snail1,and β-catenin in renal proximal tubule cells[J].Am J Physiol Renal Physiol,2010,298(5):F1263-F1275.
[6] Maseki S,Ijichi K,Tanaka H,et al.Acquisition of EMT phenotype in the gefitinib-resistant cells of a head and neck squamous cell carcinoma cell line through Akt/GSK-3β/Snail signalling pathway[J].Br J Cancer,2012,106(6):1196-1204.
[7] El Touny LH,Banerjee PP.Akt GSK-3 pathway as a target in genistein-induced inhibition of TRAMP prostate cancer progression toward a poorly differentiated phenotype[J].Carcinogenesis,2007,28(8):1710-1717.
[8] Zhou BP,Deng J,Xia W,et al.Dual regulation of Snail by GSK-3β-mediated phosphorylation in control of epithelial-mesenchymal transition[J].Nat Cell Biol,2004,6(10):931-940.
[9] Wu Y,Zhou BP.TNF-α/NF-κB/Snail pathway in cancer cell migration and invasion[J].Br J Cancer,2010,102(4):639-644.
[10] Kattla JJ,Carew RM,Heljic M,et al.Protein kinase B/Akt activity is involved in renal TGF-β1-driven epithelial-mesenchymal transition in vitro and in vivo[J].Am J Physiol Renal Physiol,2008,295(1):F215-F225.
[11] Li YJ,Tan XY,Dai CS,et al.Inhibition of integrin-linked kinase attenuates renal interstitial fibrosis[J].J Am Soc Nephrol,2009,20(9):1907-1918.

