载药脂质体复合缺钙磷灰石骨水泥支架的研究
梁 伟徐 建葛淑华杜俊杰杨 敏闫 铭罗卓荆*,苏佳灿刘昌胜
(1第四军医大学附属西京医院骨科,西安 710199)
(2上海市第二军医大学附属长海医院骨科,上海 200433)
(3华东理工大学教育部医用生物材料研究中心,上海 200237)
载药脂质体复合缺钙磷灰石骨水泥支架的研究
梁 伟1徐 建1葛淑华1杜俊杰1杨 敏1闫 铭1罗卓荆*,1苏佳灿2刘昌胜3
(1第四军医大学附属西京医院骨科,西安 710199)
(2上海市第二军医大学附属长海医院骨科,上海 200433)
(3华东理工大学教育部医用生物材料研究中心,上海 200237)
采用食盐颗粒浸出法制备了缺钙磷灰石水泥(CPC)多孔支架;用脂质体包裹盐酸万古霉素制备了载药脂质体。将它们两者结合,制备了脂质体载药复合缺钙磷灰石水泥(dl-CPC)支架。结果表明:缺钙CPC多孔支架能够将载药脂质体吸附在其大孔表面或微孔里;dl-CPC支架对MC3T3-E1细胞的生长没有负面影响,显示出良好的细胞相容性。此外,dl-CPC支架具有很好的抗菌性能,能够抑制大肠杆菌生长,抗菌率达99%(12 h)。dl-CPC支架浸泡在磷酸缓冲溶液中,释放药物的速度比较缓慢(前4周);而直接吸附药物的CPC支架,在1周内大部分药物释放出来,出现暴释现象。另结果表明:dl-CPC支架具有缓释药物和骨再生的双重功能,可用于骨缺损的修复及治疗慢性骨髓炎。
磷灰石水泥支架;药物载体;脂质体;抗菌性;药物释放
0 引 言
一般来说,磷酸钙骨水泥(CPC)是由等物质的量的磷酸四钙(TECP)和无水磷酸氢钙(DCPA)通过水化反应生成羟基磷灰石(Ca10(PO4)6(OH)2,),钙磷物质的量比nCa/nP=1.67[1-3]。对于类羟基磷灰石结构的磷酸钙盐,nCa/nP越低,材料溶解性越高,材料植入体内的降解性就越好[4-6]。调整TECP和DCPA的物质的量比,通过磷酸钙水泥的水化反应可以生成nCa/nP低于1.67的类羟基磷灰石,从而提高CPC的降解性[7-9]。因此,本研究将调整CPC的nCa/nP,同时加入致孔剂,使其在模拟生理环境和温度下自行硬化,并最终转化为降解性优良的多孔类羟基磷灰石。
将抗生素等药物引入生物材料中,使材料在修复骨缺损的同时,缓慢释放药物,赋予植入材料兼具骨修复和药物治疗的双重功能,具有重要的临床应用价值[10-12]。将药物与CPC骨水泥粉末均匀混合后,再用固化液固化,药物分散在固化体中[13]。但这种方法有一定的缺陷,由于药物被置于骨水泥水化环境中,它有可能影响水泥的固化过程,从而影响骨水泥的凝结时间和强度;分散在水泥固化体中的药物也不容易释放出来。微球作为一种缓释给药体系,具有能保护药物免遭破坏、控制药物释放速度、延长药物作用时间、减少药物不良反应及降低用药量等优点[14-15]。脂质体是一种无毒、无免疫原性的药物载体,用于药物释放,能提高药效,降低毒副作用[16-17]。本研究将用脂质体包裹抗生素药物(盐酸万古霉素),形成载药脂质体微球,将载药脂质体与缺钙磷灰石水泥多孔支架复合,形成脂质体载药磷灰石水泥支架,用于骨缺损的修复及治疗由于感染而引起的慢性骨髓炎。
1 实验部分
1.1 缺钙磷灰石水泥支架的制备
磷酸四钙(TECP)和磷酸氢钙(DCPA)的制备参见相关文献,将TECP和DCPA粉碎、分级,获得需要粒度的粉末[1-2,18]。将TECP和DCPA按一定的物质的量比混合均匀(钙磷比为1.58),即为本实验制备的缺钙CPC粉末。将缺钙CPC粉末、食盐(450 μm左右)和固化液(水)按一定比例放入玛瑙研钵中调和,调和后的浆体放入不锈钢模具,模具在置于37℃、100%的湿度环境中,使水泥固化;固化48 h后取出,放入水中,每6 h换水1次,换3次,取出支架,放在100℃烘箱中加热12 h,最后得到缺钙磷灰石水泥支架。用同样的方法制备钙磷比为1.67的磷灰石水泥支架作为对照样品。用XRD表征其物相。
1.2 载药脂质体的制备及其与缺钙磷灰石支架的
复合
称取盐酸万古霉素、氢化大豆卵磷脂和胆固醇溶于10 mL无水乙醇中,使盐酸万古霉素的浓度为1 mg·mL-1,氢化大豆卵磷脂和胆固醇的总浓度为10 mg·mL-1,于 40 ℃水浴、转速 150 r·min-1减压蒸除有机溶剂,室温减压干燥12 h。加入含有吐温-80的磷酸盐缓冲溶液(PBS),充分溶胀,于冰浴中超声15 min,将薄膜完全洗脱,再超声2 min,得白色的载药脂质体混悬液。称取1 g缺钙磷灰石支架多个样品,将载药脂质体混悬液滴加支架上,室温干燥,得到脂质体包裹盐酸万古霉素复合缺钙磷灰石支架(ld-CPC),用SEM观测ld-CPC支架的微观结构和形貌。称取1 g缺钙磷灰石支架多个样品,滴加200 μL的盐酸万古霉素溶液 (1 mg·mL-1),室温干燥,得直接载药缺钙磷灰石支架(d-CPC)。通过换算使每克缺钙磷灰石支架载同样量的盐酸万古霉素。用岛津万能材料试验机(AG-2000A型)测试脂质体载药复合缺钙磷灰石支架的抗压强度,样品大小(Ф 5×5 mm),施加荷载速度为 2 mm·min-1,每组数据至少有5个平行实验。缺钙CPC和脂质体载药缺钙磷灰石水泥的孔隙率用阿基米德方法测试,每组数据至少有3个平行实验,结果取平均值。
1.3 细胞在载药缺钙CPC支架上增殖
采用MTT法测定MC3T3-E1细胞在载药缺钙磷灰石水泥支架上的光密度值(OD),表征细胞的增殖情况。将载药支架材料(Ф 5×3 mm)放入24孔的组织培养板中,将MC3T3-E1细胞以3×104数量接种在每孔支架材料上,每孔加入2 mL的细胞培养基;孵育1和3 d。在测试时间点,每孔加入100 μL MTT溶液,继续孵育4 h;弃去培养液,用PBS清洗3遍,然后每孔加入1 mL二甲基亚砜(DMSO),在37℃下静置10 min;用酶标仪在490 nm波长处测定每孔的OD值,采用SPSS统计软件进行数据处理,数据表示成平均值+标准差(±s)。用方差分析,p<0.05为有统计学意义。
1.4 载药缺钙磷灰石水泥支架的抗菌性能
将载药缺钙磷灰石水泥多孔支架材料磨成粉末,取2组粉体。每组称取0.2 g粉体,放入试管中。每试管加入200 μL(107mL-1)浓度的细菌液(大肠杆菌),再加入5 mL生理盐水。将4只试管一起放入37℃恒温培养箱中,培养24 h后,将每只试管里的菌液分别稀释10倍、100倍和1 000倍,各取200 μL涂板,每个浓度涂3块板。将涂好的培养板放入37℃恒温培养箱中,培养12 h,计数培养板上菌株的数量,计算材料的抗菌率,并拍照。
1.5 载药缺钙磷灰石水泥支架的体外药物释放
将直接载药缺钙CPC支架(d-CPC)和脂质体载药复合缺钙CPC(dl-CPC)支架置于50 mL的小烧杯中,加入20 mL的PBS溶液。从开始加入水时开始计时,分别在 1 h,6 h,12 h,24 h,2 d,4 d,7 d,10 d,14 d后,取一定体积的溶液(支架释放盐酸万古霉素后),再补充同样体积的PBS溶液。在280 nm波长下,测定溶液的吸光度值,换算出从缺钙CPC支架材料中释放的盐酸万古霉素量。载药缺钙磷灰石支架释放药物后,用SEM观测支架的微观结构和形貌。
2 结果与讨论
2.1 缺钙磷灰石水泥支架材料的XRD
图1是缺钙磷灰石水泥支架的粉末X射线衍射图,采用nCa/nP=1.67的CPC为对照样,由图可见,缺钙磷灰石水泥支架材料和对照样在 25°,29°,32°,34°,39°,43°,49°等位置的附近都出现了明显的磷灰石特征峰,这些峰的具体位置在两个XRD图中略有不同,这可能是由于它们的Ca/P比不同造成的(材料的晶面间距略有不同)。结果提示:缺钙磷灰石水泥支架材料和CPC(nCa/nP=1.67)都具有磷灰石结构,缺钙磷灰石水泥支架材料是一种类羟基磷灰石,类羟基磷灰石与羟基磷灰石相比,由于钙缺失,造成其磷灰石结构有缺陷,不稳定,其在水中的溶解性比羟基磷灰石高,因而材料在体内具有更好的降解性[19]。

2.2 载药缺钙磷灰石水泥支架的微观形貌及抗压强度
图2a是载药脂质体复合缺钙磷灰石水泥(dl-CPC)支架的照片。图2bc是dl-CPC支架的SEM照片,显示的是载药支架的微观结构和形貌。载药脂质体支架含有不规则的大孔,均匀地分布在多孔支架中,大孔之间相互连通,大孔径在300~500 μm的范围内。大孔的孔壁大约100 μm厚,有些大孔之间有约50~100 μm的连通孔,使得大孔之间相互贯通。高倍电镜下显示:有许多载药脂质体粘附在缺钙CPC支架的大孔壁上,这是由于支架材料表面吸附载药脂质体而形成的。由于缺钙CPC的水化反应以及少量食盐溶于固化液,多孔支架含有大量微孔,这些微孔可以吸附载药脂质体,将载药脂质体吸附在微孔里或其表面,缺钙磷灰石水泥支架不仅具有很好的降解性,而且还具有很好的成骨性,有利于骨缺损的快速修复[20-21]。

表1显示的是dl-CPC对其抗压强度的影响,未载药缺钙CPC支架为对照。由图可见,支架的孔隙率明显影响支架材料的抗压强度,随着dl-CPC支架孔隙率的增加(51%~78%),支架的抗压强度不断降低 (3.2~1.9 MPa)。比较载药脂质体复合缺钙CPC(dl-CPC)支架和未载药缺钙CPC支架,dl-CPC支架对其强度略有提高,但提高的数值不多。这可能是载药脂质体填充了一些多孔支架的孔隙,对支架材料起了一定的增强作用,这对增加支架植入初期的强度是有用的,随着药物的释放及脂质体的快速降解,不影响细胞/组织长入支架材料。

表1 缺钙CPC支架复合载药脂质体的抗压强度Table 1 Compressive strength of scaffold of liposome loaded drug and calcium deficient apatite cement(dl-CPC)
2.3 载药缺钙CPC多孔支架的细胞增殖
图3显示的是通过MTT法测试MC3T3-E1细胞在载药脂质体复合缺钙CPC(dl-CPC)支架上的光密度值(OD值),表示细胞在支架上的增殖情况。对照组:缺钙CPC支架(CPC),直接载药缺钙CPC支架(d-CPC)和组织培养板(TCP)。从图可以看出:所有样品随着细胞培养时间的延长 (1和3 d),OD值都增加,说明所有样品都有很好的细胞相容性,有利于细胞增殖。在第1和第3 d,实验组和对照组的吸光度值没有显著性的差异。结果表明:说明dl-CPC支架没有细胞毒性,细胞相容性良好。

2.4 载药缺钙CPC支架的抗菌性能
图4是载药脂质体复合缺钙CPC(dl-CPC)支架抑制大肠杆菌生长的效果图(实验时间12 h,图片放大倍数都为10倍),图中的白色颗粒为大肠杆菌。12 h后,dl-CPC支架组的细菌几乎不存在,说明dl-CPC支架具有优良的抗菌性能。d-CPC支架组有少量细菌,这可能是由于药物没有本脂质体包裹,药物从支架上释放太快,所以,总的杀菌效果欠佳。而未载药缺钙CPC支架组有大量细菌,说明缺钙CPC没有抗菌性能,不能抑制细菌生长。结果表明:dl-CPC支架有良好的抗菌作用,能有效地抑制大肠杆菌的生长。
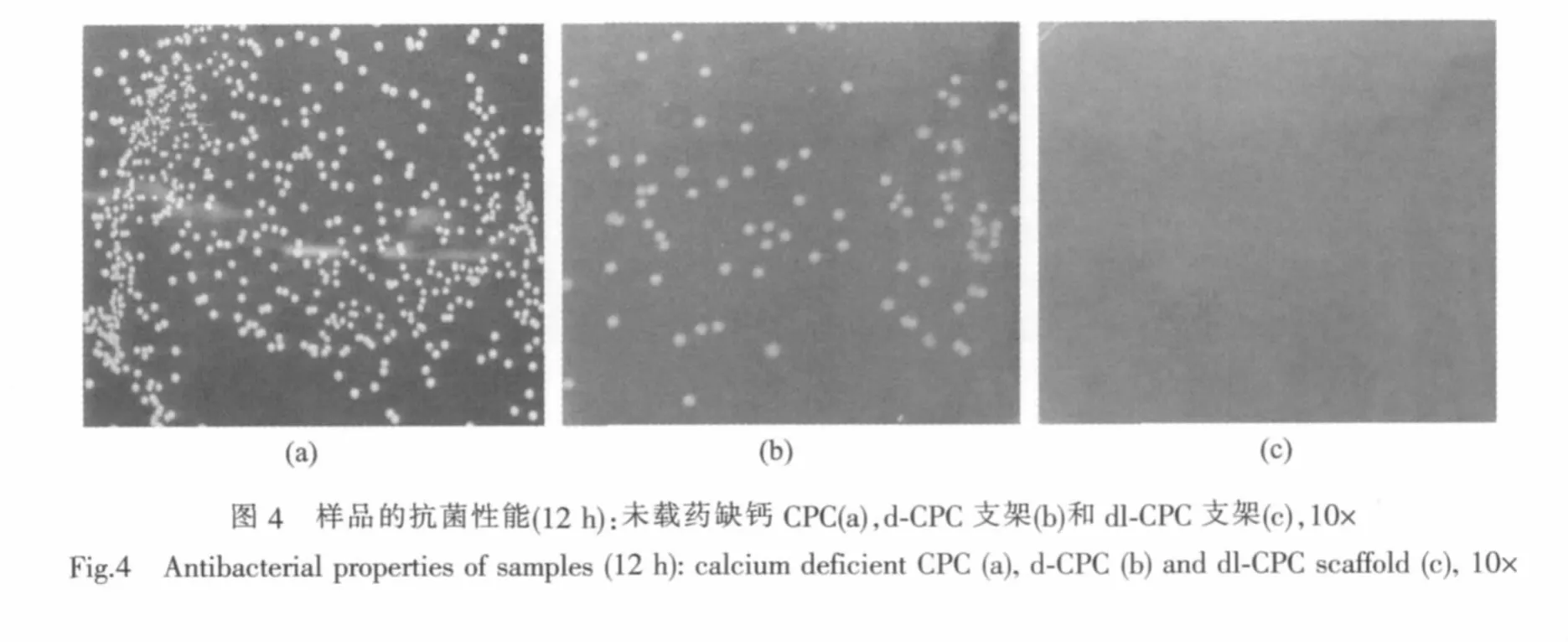
图5显示是载药脂质体复合缺钙CPC(dl-CPC)支架的抗菌率(1和12 h),结果表明:实验1 h后,dl-CPC支架的抗菌率为81%;实验12 h后,其抗菌为99%;而直接载药缺钙CPC支架在1和12 h的抗菌率分别是69%和87%;而未载药缺钙CPC支架在实验1和12 h后的抗菌率为0,表明无抗菌作用。结果表明:dl-CPC支架具有很好的抗菌效果,这可能是由于脂质体载药可以实现药物在支架上缓慢释放,持续地杀死细菌,其抗菌率最高。

2.5 载药CPC支架释放药物及释药后的微观形貌
图6是载药脂质体复合缺钙CPC(dl-CPC)支架在PBS中的药物释放。对于d-CPC支架,在第1周,药物有较快的释放速度,很快达到平台,表明大部分药物已经从支架里释放出来了。d-CPC支架在PBS中存在药物暴释现象,盐酸万古霉素从CPC支架中很快就释放出来了,缺钙CPC支架有较大的孔隙率,不仅能吸附药物,而且能快速地释放药物。相对于d-CPC支架的药物释放,脂质体包裹盐酸万古霉素复合多孔支架的药物释放有明显的差别。在开始阶段,药物释放没有出现暴释现象,药物从支架里缓慢释放出来。4周后,达到平台,表明大部分药物已经从支架里释放出来了,释放周期明显比直接载药缺钙CPC支架长。脂质体是一种人工膜,具有双层脂分子的球形囊泡,将药物包裹在囊泡中,可以缓释药物,从而使药物从支架里缓慢释放出来。相比于支架直接载药,脂质体包裹药物复合CPC支架具有更好的缓释效果,可提高药物的利用度[22]。
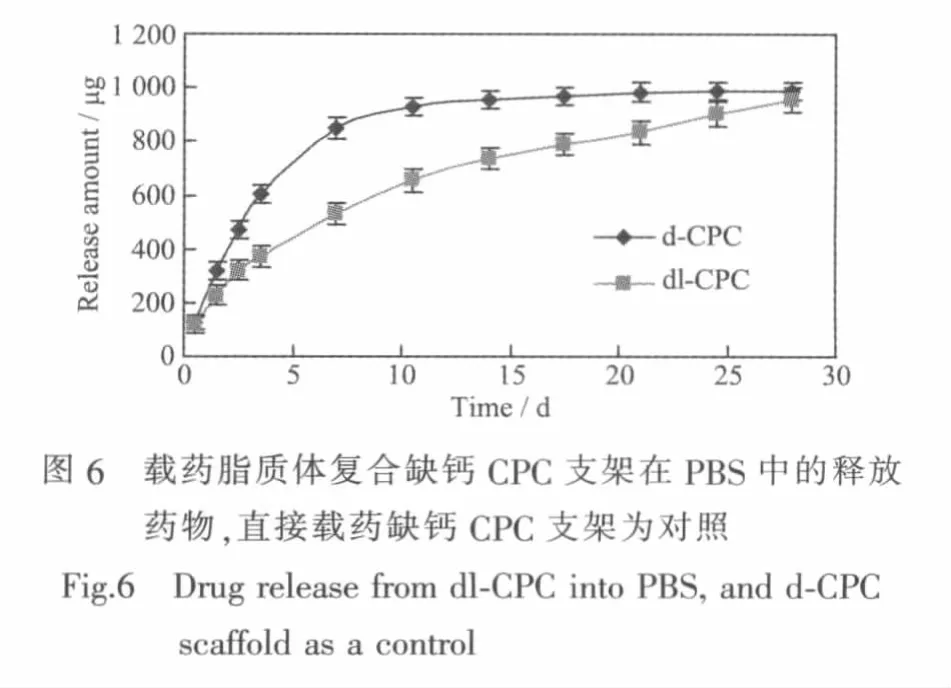
图7是载药脂质体复合缺钙CPC支架(dl-CPC)释药后的微观结构和形貌(SEM照片):从图可以看出,由于脂质体的降解,药物从缺钙CPC支架里缓慢释放出来,支架表面出现了许多微孔,再加上支架材料本身的降解,支架材料表面产生了一些微孔。这些微孔结构有利于细胞/组织粘附在支架材料上,进一步生长和繁殖,形成骨组织。随着支架材料的降解,骨组织最终代替支架材料而修复骨缺损。在载药支架植入体内的前期,缓慢地释放抗生素有利于创伤处的消炎,抑制伤口处细菌生长,因此,dl-CPC支架可用于骨缺损的修复及治疗伴随的慢性骨髓炎。

3 结 论
采用食盐粒子溶出法制备了缺钙磷灰石水泥支架,将脂质体包裹盐酸万古霉素,形成载药脂质体,将载药脂质体与支架复合,制备了载药缺钙磷酸钙水泥支架(dl-CPC)。结果表明:缺钙CPC支架能够吸附载药脂质体;与支架直接吸附药物相比,dl-CPC支架具有很好的抑菌效果,抗菌率达到99%(12 h)。dl-CPC支架具有很好的细胞相容性,对细胞生长没有负面影响。
与直接吸附药物的缺钙CPC支架相比,dl-CPC支架在PBS溶液中的释放药物比较缓慢,没有出现暴释现象;而直接吸附药物的缺钙CPC支架第1周内出现了快速释放(瀑释)。结果表明:脂质体包裹药物有利于药物从缺钙CPC支架上缓慢释放出来。dl-CPC支架具有缓释药物和骨修复双重功能,可用于骨缺损的修复及治疗伴随的慢性骨髓炎。
[1]Ginebra M P,Espanol M,Montufar E B,et al.Acta Biomater.,2010,6(8):2863-2873
[2]Bohner M,Gbureck U,Barralet J E.Biomaterials,2005,26(33):6423-6429
[3]LI Dong-Xu(李东旭),GENG Yan-Li(耿艳丽),LI Yan-Bao(李延报),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(1):83-87
[4]Driessens F C M,Boltong M G,de Maeyer E A P,et al.Biomaterials,2002,23(19):4011-4017
[5]XIAO Gui-Yong(肖桂勇),LÜ Yu-Peng(吕宇鹏),ZHU Rui-Fu(朱瑞富),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(7):1255-1260
[6]LI Yan-Bao(李延报),LI Dong-Xu(李东旭),ZHANG Xi-Zhi(张熙之),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(6):986-989
[7]Laird D F,Mucalo M R,Yokogawa Y.J Colloid Interf Sci,2006,295(2):348-363
[8]WEI Jie(魏杰),LIU Chang-Sheng(刘昌胜),HONG Hua(洪华),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(4):765-770
[9]XIAO Gui-Yong(肖桂勇),LÜ Yu-Peng(吕宇鹏),ZHU Rui-Fu(朱瑞富),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(7):1255-1260
[10]Efstathopoulos N,Giamarellos-Bourboulis E,Kanellakopoulou K,et al.Injury Prev.,2008,39(12):1384-1390
[11]Zhang X,Jia W T,Gua Y F,et al.Biomaterials,2010,31(22):5865-5874
[12]HE Wen-Hui(贺文慧),TANG Rui-Kang(唐睿康),XU Xu-Rong(徐旭荣),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(7):1233-1238
[13]Ginebra M P,Traykova T,Planell J A et al.Biomaterials,2006,27(10):2171-2177
[14]Liu X M,Sun Q S,Wang H J,et al.Biomaterials,2005,26(1):109-115
[15]Herrero-Vanrell R,Refojo M F.Adv.Drug Deliver Rev.,2001,52(1):5-16
[16]Schmid M H,Korting H C.Adv.Drug Deliver Rev.,1996,18(3):335-342
[17]Mourtas S,Fotopoulou S,Duraj S,et al.Colloids Surface B,2007,55(2):212-221
[18]Eshtiagh-Hosseini H,Houssaindokht M R,Chahkandhi M,et al.J.Non-Cryst.Solids,2008,354(32):3854-3857
[19]Hsu H C,Tuan W H,Lee H Y,et al.Mat.Sci.Eng.C:Mat.,2009,29(3):950-954
[20]Filippov L,Thomas F,Filippoval,et al.J.Hazard.Mater.,2009,171(3):731-738
[21]Sanzana E S,Navarro M,Macule F et al.Acta Biomater.,2008,4(6):1924-1933
[22]Zhang W N,Hu Z X,Liu Y,et al.Talanta,2005,67(5):1023-1028
Composite Scaffold of Liposome Loaded Drug and Calcium Deficient Apatite Cement
LIANG Wei1XU Jian1GE Shu-Hua1DU Jun-Jie1YANG Min1YAN Ming1LUO Zuo-Jing*,1SU Jia-Can2LIU Chang-Sheng3
(1Department of Orthopaedics,Xijing Hospital,Four Militarry Medical University,Xi′an 710199,China)
(2Department of Orthopaedics,Changhai Hospital,Second Military Medical University,Shanghai 200433,China)
(3Engineering Research Center for Biomedical Materials of Ministry of Education,East China University of Science and Technology,Shanghai 200237,China)
Calcium deficient apatite cement(CPC)scaffold was prepared by using salt particle leach method,liposome loaded drug (Vancomycin hydrochloride)was also fabricated.Composite scaffold of liposome loaded drug and calcium deficient apatite cement(dl-CPC)was developed by combination of both them.The results showed that the calcium deficient CPC could adsorb liposome loaded drug on both the wall of the macropores and micropores of the scaffold.The dl-CPC scaffold loaded drug had no negative effects on MC3T3-E1 cells growth,showing good cytocompatiblity.In addition,the dl-CPC scaffold had good antibacterial properties,which could inhibit the growth of E.coli,and the antibacterial ratio could reach 99%after incubated for 12 hours.The drug was slowly released from the dl-CPC scaffold l(in the first 4 weeks),when the dl-CPC soaked into in phosphate buffer solution(PBS).However,waterfall release of drug was found that the great mass of drug was released from the CPC scaffold directly loaded drug in the first week.The results suggested that the dl-CPC scaffold had two functions of bone regeneration and drug slow release,which can be used for bone defects repair and therapy of chronic osteomyelitis.
apatite cement scaffold;drug carrier;liposome;antibacterial properties;drug release
R318
A
1001-4861(2012)07-1397-06
2011-11-17。收修改稿日期:2012-01-11。
上海市卫生系统新优青计划(No.2010032);上海市博士后基金;中国博士后科研基金面上项目及国家自然科学基金(No.81000813)资助项目。
*通讯联系人。E-mail:trauma8888@yahoo.com.cn

