草莓叶盘再生和遗传转化体系的优化
柏 锡,狄少康,张秀芹,朱延明
(东北农业大学生命科学学院,哈尔滨 150030)
草莓(Fragaria ananassa Duch.)属蔷薇科草莓属多年生草本植物,是世界上广泛栽培的重要经济果树[1]。由于草莓基因的高度杂合性和染色体的多倍性,受到有益性状定向改良难、育种范围窄、耗时长等限制。James等获得第一棵草莓转基因植株,标志着草莓基因工程开始[2]。此后,草莓遗传转化研究进入实用性阶段,它可以有目的、有计划地向草莓引入优良性状而不需要改变它原有其他特性,使草莓品种改良具有定向性和预见性,获得常规育种难以或无法得到的新类型,从而创造出新种质。目前已获得抗病[3]、抗虫[4]、抗逆、抗除草剂和品质改良等方面转基因植株。
目前,在草莓上采用的遗传转化方法主要有农杆菌介导法、基因枪法和电击法等。目前应用于草莓上的基因导入法主要是农杆菌介导叶盘法[5-6],以叶盘法获得转基因草莓新品种的前提条件就是要建立一个高效稳定叶盘再生受体系统。基因型、外植体[7]、pH、生长调节剂的种类、配比与浓度以及AgNO3[8]等对草莓叶片不定芽再生都具有显著影响。于冬梅等研究发现20~30 d叶龄的草莓叶片为诱导分化不定芽最适叶龄[9]。陈琴芳等研究发现,章姬在TDZ 8.0 mg·L-1时再生率最高为60.5%,丰香则在TDZ 2.0 mg·L-1时再生率最高为58%,并确定TDZ 1.0 mg·L-1+NAA 0.05 mg·L-1的培养基为草莓基本再生培养基[10]。张利义等研究发现,全明星在MS+TDZ 1.5 mg·L-1+NAA 0.05 mg·L-1再生效果好,再生率高达86.6%[11]。应用基因工程手段在基因水平上改良草莓品种已取得一定进展,但仍然存在转化效率低、外源基因表达强度不够、遗传转化系统不完善等问题。利用该法,由于共培养中农杆菌侵染,选择再生培养基选择压,抗生素作用以及继代培养等因素,会导致转化外植体比非转化外植体再生频率有不同程度降低,即植物基因转化频率较低。所以,对叶盘遗传转化的优化,也是提高转化效率的关键因素。袁维风等报道OD值为0.3~0.5的工程菌侵染液对草莓遗传转化最适宜[12]。侵染浓度和侵染时间也是影响转化效率的关键因素。菌液浓度过高或侵染时间太长,农杆菌繁殖增多,极不利于后期除菌。浓度太低或时间过短,又不利于菌体附着在外植体上,T-DNA不能有效整合,大大降低转化效率。一般认为,草莓在菌液浓度OD600为0.5中浸泡5 min为宜。最佳侵染时间可能与不同的转化材料和农杆菌株以及工程菌液浓度有关。预培养时间为2~4 d时,其转化效果较好。未经预培养的叶片转化效率低下。
本研究为建立草莓高频植株再生体系,系统地探讨了不同基因型、PGR配比、叶盘放置方式及叶片幼嫩程度等对草莓不定芽分化的影响。通过对草莓遗传转化影响因素的探讨,建立农杆菌介导的草莓叶盘高效遗传转化体系,并以t-PA为目的基因,进行大规模遗传转化,获得大量转基因植株。
1 材料与方法
1.1 材料及菌株
草莓主栽品种弗吉尼亚、哈尼、森嘎拉和戈雷拉由东北农业大学果树研究室提供。
含有载体pBET、pBEMT、pBFMT的大肠杆菌DH5α、农杆菌LBA4404(pAL4404)由东北农业大学植物生物工程研究室保存,该载体分别携带有不同启动子诱导的t-PA基因和NPTⅡ筛选标记。
1.2 培养基
培养基以MS为基本培养基,在培养不同阶段,分别加入不同生长激素和调节剂,具体见表1。
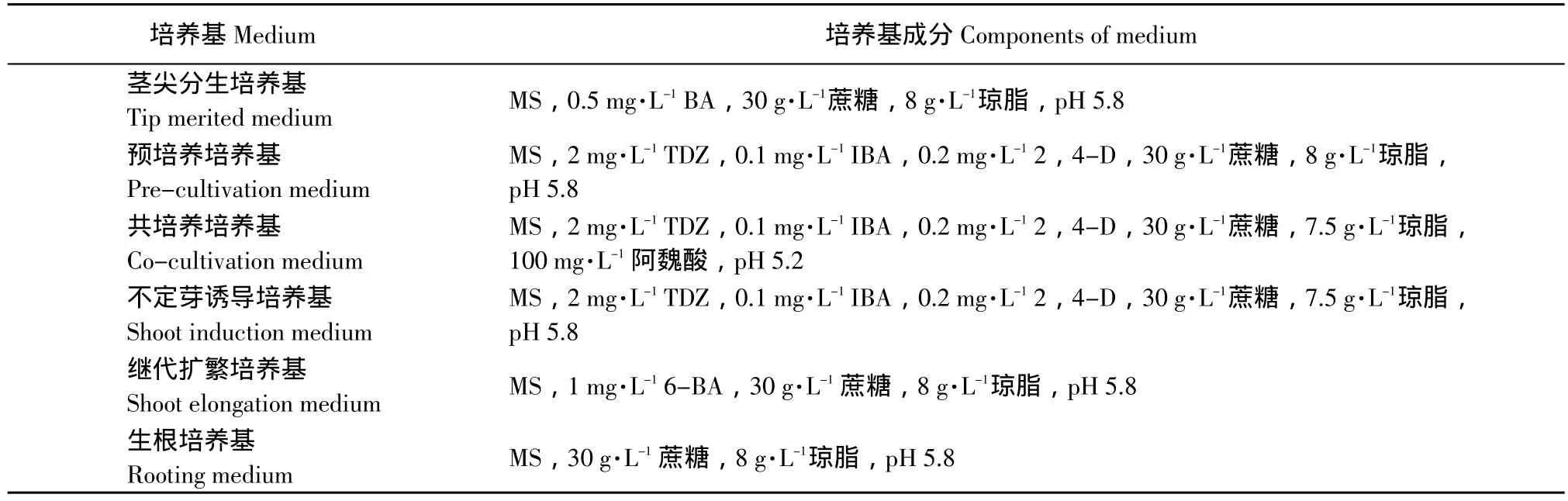
表1 组织培养中主要培养基及其成分Table1 Components of medium at different plant growth stages
1.3 草莓再生体系的探讨
1.3.1 探讨不同基因型及PGR配比对不定芽分化的影响
分别取4种基因型继代20~30 d左右的草莓无菌试管苗幼嫩叶片为试材,用打孔器打成直径为4 mm叶盘,近轴面向下接种在不同PGR(Plant growth regulator)配比的不定芽诱导培养基上(见表2),基本培养基为MS培养基,30 g·L-1蔗糖,8 g·L-1琼脂,pH 5.8,8周后统计分化结果。
1.3.2 探讨暗培养时间对不定芽分化的影响
将草莓品种弗吉尼亚叶盘接种在最佳不定芽诱导培养基上,分别在黑暗条件下培养0、1、2、3周,然后取出放在正常光照条件下,8周后统计不定芽分化情况。
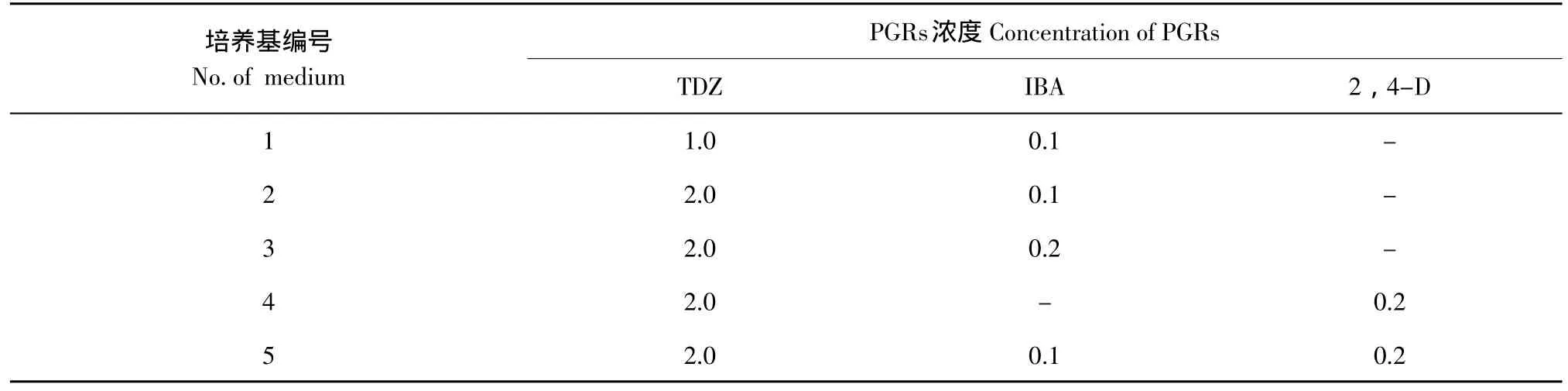
表2 不定芽诱导培养基中PGR组成Table2 Different concentration of PGRs in strawberry adventious shoots inducing (mg·L-1)
1.3.3 叶盘放置方式对不定芽分化的影响
将草莓品种弗吉尼亚叶盘分别按近轴面向下、向上两种方式接种在不定芽分化培养基上,其他培养条件一致,8周后统计不定芽分化情况。
1.3.4 叶片幼嫩程度对不定芽分化的影响
在继代30 d左右的草莓弗吉尼亚无菌试管苗上分别选取未完全展开的幼嫩叶片、刚刚展开的较幼嫩叶片、幼嫩程度中等的叶片及成熟叶片为试材,接种在不定芽诱导培养基上,其他培养条件一致,8周后统计不定芽分化情况。
1.3.5 数据统计分析方法
每组试验分设3次重复。数据结果中标有不同字母表示数值α=0.05水平差异显著。
再生频率(%)=分化外植体数/接种外植体数×100%;
叶盘平均再生芽数=不定芽总数/分化外植体数;
再生率(%)=分化叶盘数/接种叶盘数×100%。
1.4 草莓叶盘法转化程序
将-70℃冰箱保存菌种在YEB固体培养基(加入40 mg·L-1利福平霉素、50 mg·L-1链霉素和100 mg·L-1卡那霉素)划线培养后挑取单菌落或直接在4℃保存的平板上挑取单菌落,接于含有上述抗生素的液体YEB培养基中,28℃,200 r·min-1,振荡培养24 h。取出菌液以1:10的接种量进行二次活化,当菌液浓度达OD600=0.5~0.6时,以5 000 r·min-1离心15 min,弃上清,用YEB重悬菌体,作为转化用菌液;
取继代30 d草莓无菌苗幼嫩叶片,用打孔器打成直径4 mm的叶盘。
1.4.1 探讨除菌剂对不定芽分化的影响
将草莓叶盘分别接种于含阿莫西林克拉维酸钾(Amo)100 mg·L-1、头孢唑啉钠(Cef) 500 mg·L-1及不加抗生素的不定芽诱导培养基上培养,10 d继代1次,8周后统计分化结果。每组试验设3次重复,每次50个叶盘,分化数、再生率取3次结果平均值。
1.4.2 探讨预培养时间对抗性芽分化的影响
将草莓叶盘接种在预培养培养基上,分别预培养0、1、2、3、4 d后进行侵染,然后进行除菌、继代,10周后统计抗性芽分化情况。每组试验设3次重复,每次500个叶盘,分化数,再生率取3次结果平均值。
1.4.3 探讨侵染时间对抗性芽分化的影响
取预培养2 d叶盘,分别设5、7、10、15 min 4个侵染时间梯度,然后进行正常除菌、继代,10周后统计抗性芽分化情况。每组试验设3次重复,每次500个叶盘,分化数、再生率取3次结果平均值。
叶盘在除菌培养基上培养2周后,转入含有20 mg·L-1卡那霉素的不定芽诱导培养基进行筛选培养,2周继代1次。
待不定芽长至2 cm时,将其分单株从基部切下,接种到继代扩繁培养基上扩繁后,每株系取一株转入生根培养基上进行生根培养。待再生小植株根系发达后,在培养室中将封口膜打开,在培养瓶中驯化7 d,洗净根部培养基,然后移入松针、草炭、黑土比例为1∶2∶1的花盆中,遮光、保湿,逐渐降低湿度,增加光强直至正常栽培。
1.5 抗性植株PCR检测
从抗性植株上取幼嫩叶片提取植物总DNA,应用Primer Premier 5.0软件,设计t-PA基因特异性检测引物,引物序列上游为P-1:5'CAGCGAG CCAAGGTGTTT 3',下游为P-2:5'CGGTATGT TCTGCCCAAG 3',PCR扩增产物为873 bp。PCR反应条件如下:94℃预变性7 min、94℃变性30 s、57℃退火30 s、72℃延伸1 min、72℃延伸10 min、4℃终止。
2 结果与分析
2.1 基因型对不定芽分化的影响
基因型对草莓不定芽分化起决定性作用。本研究所选用的弗吉尼亚、哈尼、森嘎拉和戈雷拉都是我国的主栽品种,各品种再生情况都有报道,但说法不一。研究表明,四种基因型草莓品种都有一定的再生能力,但差异显著。由图1、2可以看出,弗吉尼亚和森嘎拉两个品种在不同PGR配比培养基上的再生频率、叶盘平均再生芽数都远远高于哈尼和戈雷拉,再生频率最高可达到75.8%和74.5%。本试验中弗吉尼亚再生频率较高,可以选其为草莓遗传转化的理想基因型。
研究结果表明,基因型不同,不定芽再生方式也不同。从不定芽再生形态观察结果看,再生频率高的两个品种,其不定芽来源大部分是先产生愈伤,再由愈伤再生不定芽,小部分是由叶盘不经愈伤直接再生不定芽;而再生频率低的品种,其分化的不定芽大多数不经愈伤,而直接来源于叶盘细胞脱分化,其影响机制还需进一步探讨。
2.2 PGR配比对不定芽分化的影响
根据预实验结果,设计5种PGR配比来确定草莓不定芽诱导的最佳PGR组合(见表1)。研究结果表明,弗吉尼亚品种在5号培养基上获得最高再生频率,而在TDZ为1.0 mg·L-1的培养基上再生能力显著降低,生长素2,4-D 0.2 mg·L-1要好于IBA 0.2 mg·L-1,而2,4-D与IBA协同作用再生频率达到最高(见图1、2)。从芽分化的形态观察结果来看,生长素选用2,4-D的组合,其不定芽分化大多数是先在叶盘周围产生淡绿的愈伤,再由愈伤再生不定芽;生长素选用IBA的组合,其不定芽由叶盘不经愈伤直接再生的比较多。5号培养基不但再生频率高,且不定芽分化状态较好,畸形芽较少(见图3)。
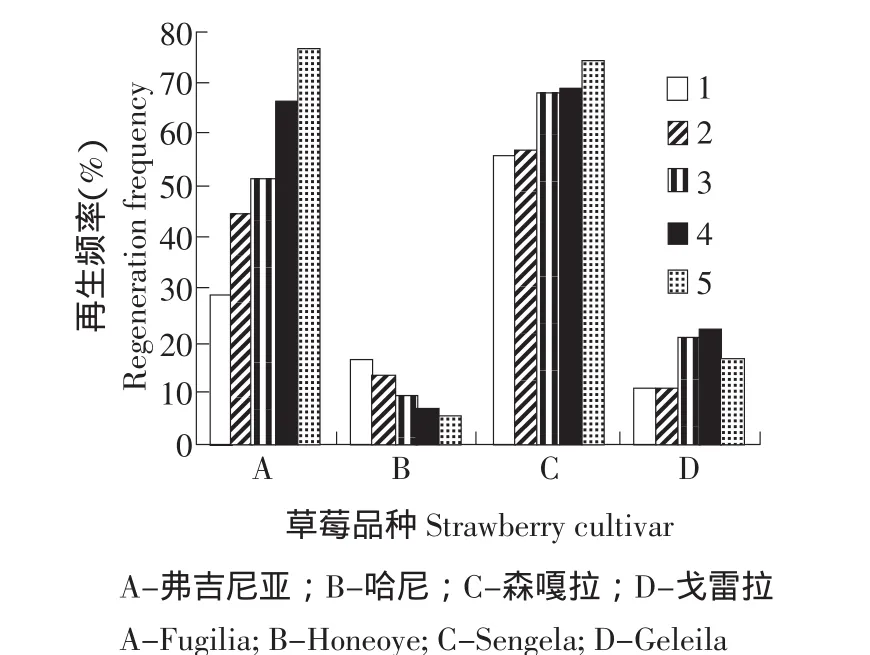
图1 不同基因型、不同PGR配比对草莓再生频率的影响Fig.1 Effect of different genotypes and PGRs concentrations in medium on strawberry shoot regeneration frequency
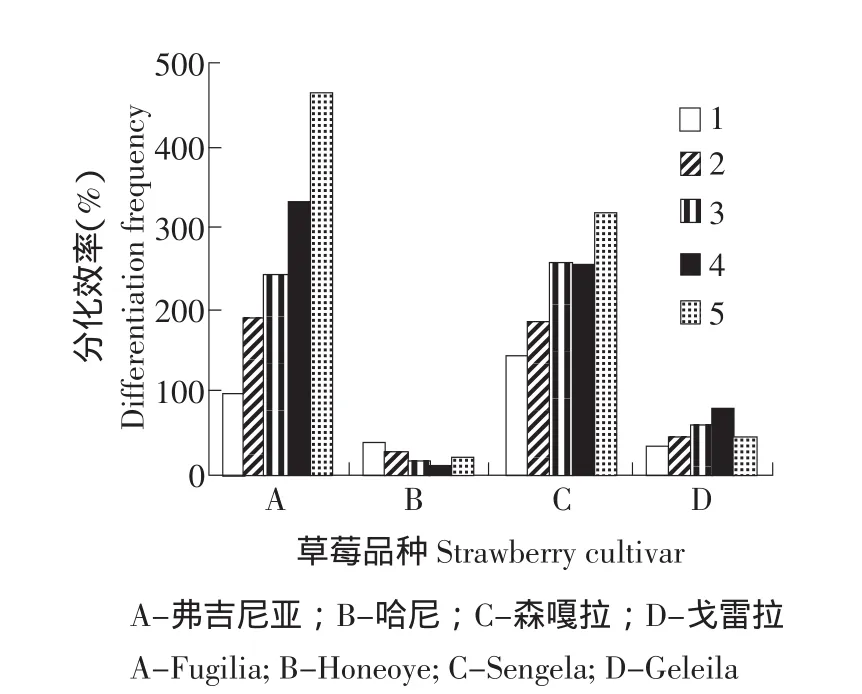
图2 不同基因型、不同PGR配比对草莓分化效率的影响Fig.2 Effect of different genotypes and PGRs concentrations in medium on strawberry differentiation frequency
2.3 暗培养时间对草莓不定芽分化的影响
研究认为暗处理可减少外植体酚类物质的溢出,利于不定芽分化,此种说法已在许多植物上得以验证[10]。但关于暗培养对草莓再生的影响,说法不一。从本研究结果可看出,暗培养对草莓品种弗吉尼亚的再生没有明显的促进作用,且暗培养时间超过2周,对不定芽分化有明显抑制作用,暗培养1周能使再生频率和分化效率都有所提高,但差异不显著(见表3)。因此,从本研究结果看,暗培养对草莓品种弗吉尼亚再生不是必须的。

图3 不同PGR配比对草莓品种弗吉尼亚植株再生的影响Fig.3 Effect of different PGRs concentrations in medium on strawberry cv.Fugilia regeneration
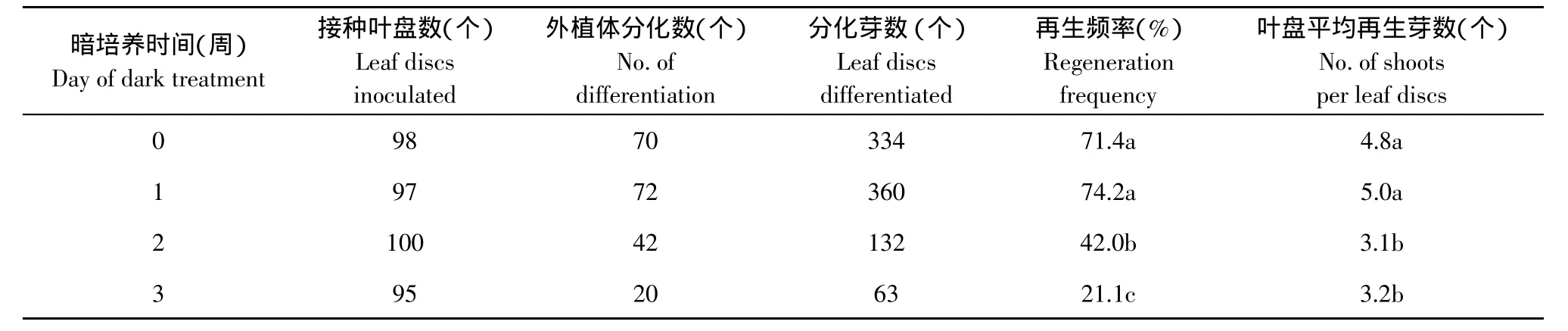
表3 暗培养时间对草莓叶盘不定芽分化的影响Table3 Effect of dark treatment on shoot regeneration from leaf discs of strawberry
2.4 叶盘放置方式对不定芽分化的影响
叶盘近轴面向下接种在培养基上时,膨大后其边缘向上卷曲;当近轴面向上接种在培养基上时,则向下卷曲。Nehra等在研究草莓品种红衣(Readcoat)再生时,发现叶盘近轴面接触培养基时,其再生频率还高于远轴面接触培养基[6]。本研究发现,叶盘放置方式对草莓品种弗吉尼亚不定芽再生有显著影响(见表4)。当叶盘近轴面向下放置时,其再生频率达75%,叶盘平均再生芽数为4.7个;相反方向放置时,再生频率低至13.3%,叶盘平均再生芽数降至1.4个。本研究还发现,放置方式不同,不定芽发生途径也有显著差异。近轴面向下时,叶盘边缘再生大量愈伤组织,大部分不定芽来源于愈伤组织;近轴面向上放置时,叶盘边缘愈伤组织产生少,不定芽大多数是不经愈伤直接由叶盘边缘细胞脱分化而来的。
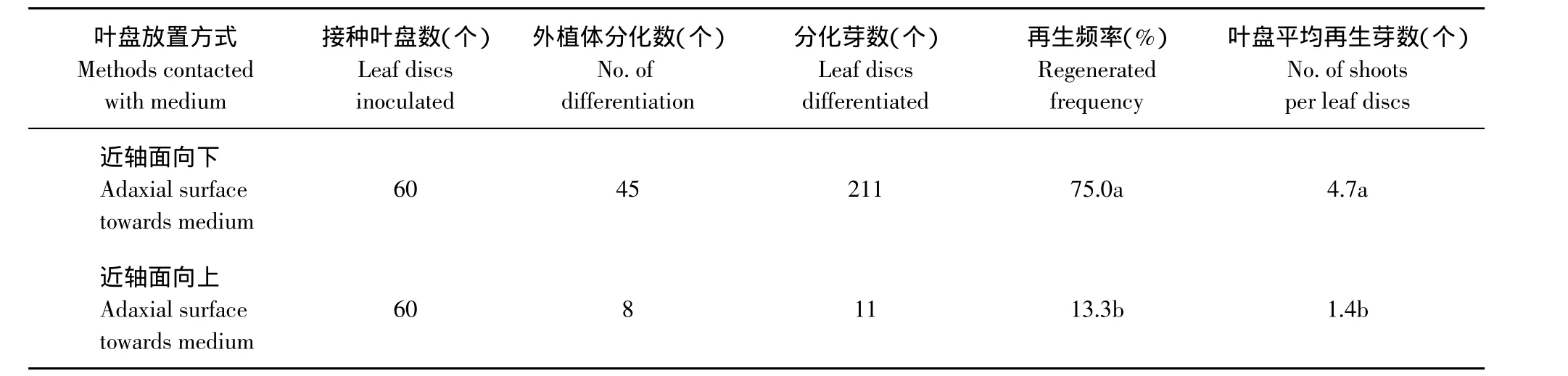
表4 叶盘放置方式对草莓叶盘不定芽分化的影响Table4 Effect of methods contacted with medium of leaf discsson shoot regeneration of strawberry
2.5 叶片幼嫩程度对草莓不定芽分化的影响
外植体幼嫩程度和生理状态对大多数植物体再生效果都有直接影响。本研究结果表明随着草莓叶片幼嫩程度的降低,其不定芽的分化能力也呈现明显降低趋势。由表5可知,较幼嫩叶片(叶片刚刚展开)再生频率较高,为83.3%,而中等幼嫩程度的叶片(叶片刚刚完全展开2~3 d)和成熟叶片(叶片完全展开,且叶色深绿,外观厚实)再生频率则很低。对于还未展开的叶片(最为幼嫩的叶片)由于试验时操作难度较大,且容易受到损伤而引起褐化,因此,我们在具体操作时,还是选取刚展开不久的幼嫩叶片为不定芽再生的外植体最为合适。
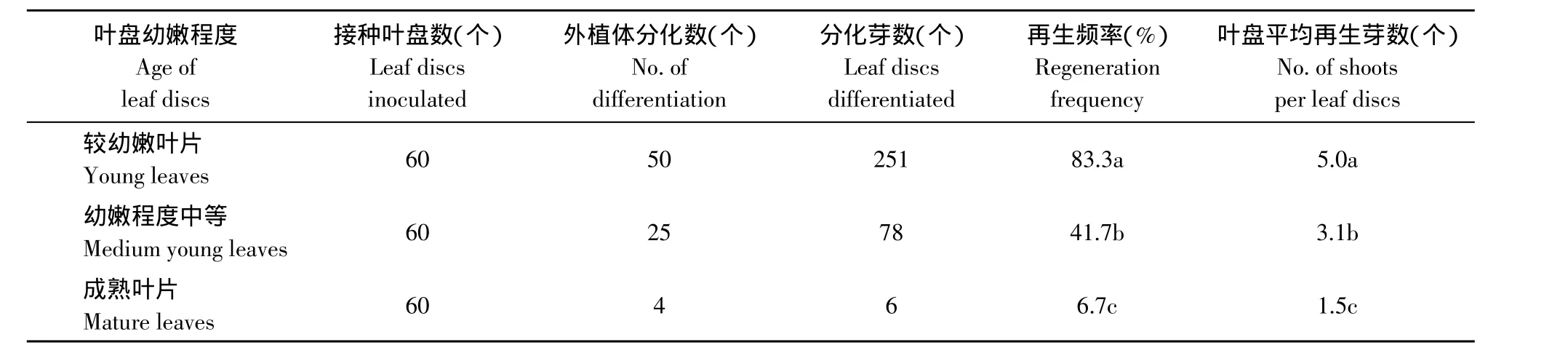
表5 叶片幼嫩程度对草莓叶盘不定芽分化的影响Table5 Effect of leaf discs age on shoot regeneration from leaf discs of strawberry
2.6 除菌剂对草莓叶盘不定芽分化的影响
在植物遗传转化过程中,除菌剂种类和浓度确定不但直接影响农杆菌能否有效去除,而且有些除菌剂对植株再生有一定抑制作用。
本研究选用两种经本实验室长期验证除菌效果较好的除菌剂,来探讨其对草莓叶盘不定芽分化的影响。研究结果表明(见表6),阿莫西林克拉维酸钾在使用浓度范围内对不定芽再生无显著影响,而且再生频率较对照高出4%,外植体分化状态正常;而头孢唑啉钠在其使用浓度内对不定芽再生有明显抑制作用,不定芽再生频率较对照低24%,且有小量叶盘有褐化现象。因此,确定阿莫西林克拉维酸钾为草莓遗传转化中使用的最佳除菌剂。
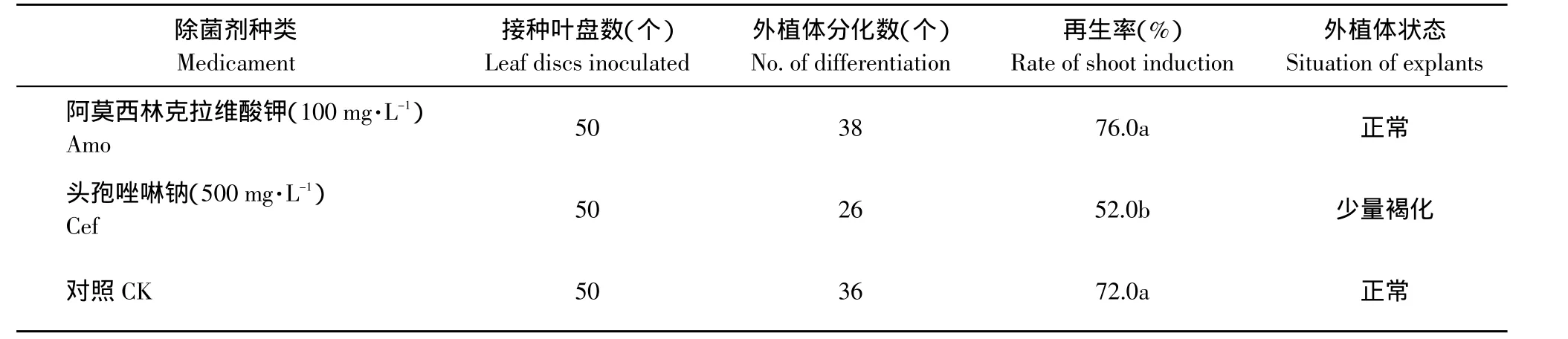
表6 不同除菌剂对草莓叶盘不定芽分化的影响Table6 Effect of different medicament concentration in medium on bud regeneration from leaf discs
2.7 预培养时间对抗性芽分化的影响
外植体在遗传转化前进行适当预培养(1~4 d),能改善细胞生理状态,从而在一定程度上提高转化效率,但预培养时间不宜过长。
本研究结果表明(见表7),对草莓品种弗吉尼亚来说,预培养2 d后侵染叶盘的不定芽再生率最高,可达3.6%,预培养1 d和未经预培养的不定芽分化率无显著差异,分别为2.4%和2.6%,而预培养3 d时再生率则开始降低为2%,预培养4 d时分化率达到最低为1.2%。因此,本试验中草莓品种弗吉尼亚叶盘转化前最佳预培养时间确定为2 d。
2.8 侵染时间对抗性芽分化的影响
草莓遗传转化所选用的受体材料必须是幼嫩叶片,叶片较薄,操作不当,容易褐化而影响抗性芽分化。农杆菌侵染对叶盘伤害较大,因此在转化时,需控制好农杆菌侵染时间。
本研究分别探讨了侵染时间为5、7、10、15 min情况下抗性芽分化率。由表8可知,叶盘在菌液中浸泡5和7 min抗性芽分化率无显著差异,分别为3%和3.6%;而浸泡10和15 min抗性芽分化率则明显降低为1.4%和0.4%。因此,草莓品种弗吉尼亚叶盘侵染时间不宜过长,以5~7 min为最佳,超过7 min则明显降低抗性芽分化率。
2.9 抗性植株PCR检测
采用优化的方法进行农杆菌LBA4404(pBET)、LBA4404(pBEMT)、LBA4404(pBFMT)对草莓品种弗吉尼亚叶盘大规模遗传转化(见图4),获得大量抗性植株。以质粒pUT为阳性对照,未转化植株总DNA为阴性对照I,无菌水代替模板DNA为阴性对照II,分别以转质粒pBET、pBEMT、pBFMT所获得抗性植株总DNA为模板,t-PA基因特异性引物为检测引物进行PCR检测。由图5~7可以看出,阳性对照质粒和阳性植株均扩增出873 bp片段,而两个阴性对照均无扩增带。
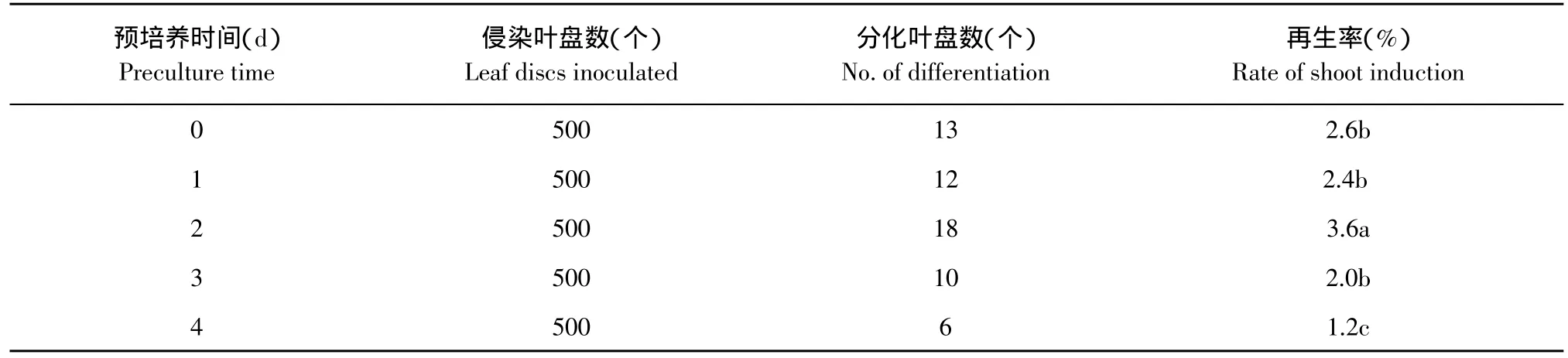
表7 预培养时间对草莓抗性芽分化的影响Table7 Effect of preculture time on resistance bud regenerationfrom leaf discs of strawberry
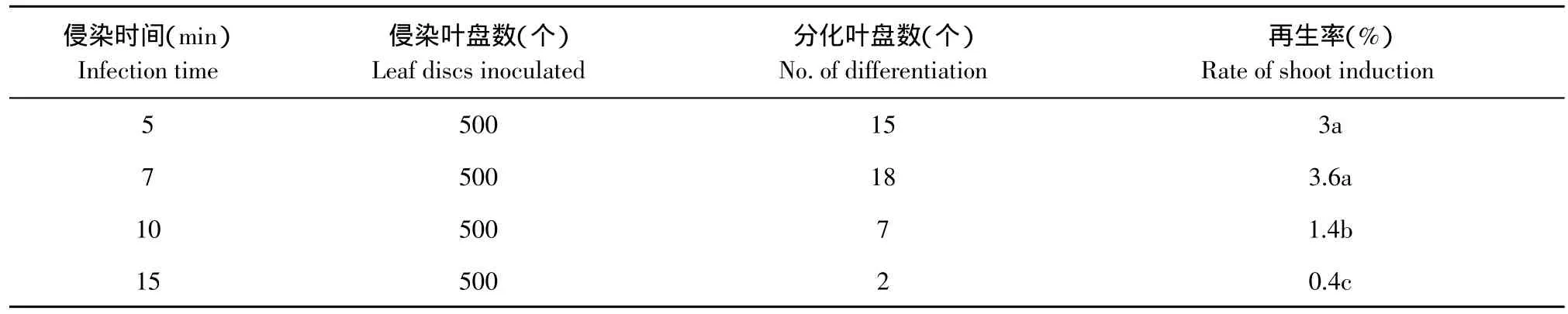
表8 侵染时间对草莓抗性芽分化的影响Table 8 Effect of infection time on resistance bud regeneration from strawberry

图4 t-PA基因转化草莓品种“弗吉尼亚”Fig.4 Transformation of strawberry cv.Fugilia with t-PA gene
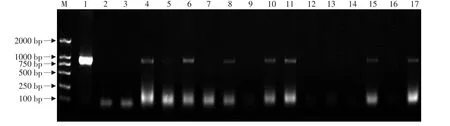
图5 转质粒pBET抗性植株的PCR检测Fig.5 PCR certificating result of resistance plants transferred with pBET

图6 转质粒pBEMT抗性植株的PCR检测Fig.6 PCR certificating result of resistance plants transferred with pBEMT
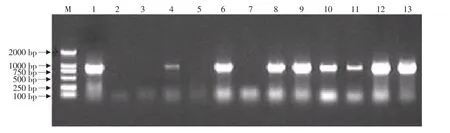
图7 转质粒pBFMT抗性植株的PCR检测Fig.7 PCR certificating result of resistance plants transferred with pBFMT
从pBET、pBEMT、pBFMT转化植株中均扩增出t-PA基因片断,可初步证明含pre、pro和marture的AFP基因已整合到草莓基因组DNA中。转化效率为1.32%~3.78%(见表9)。
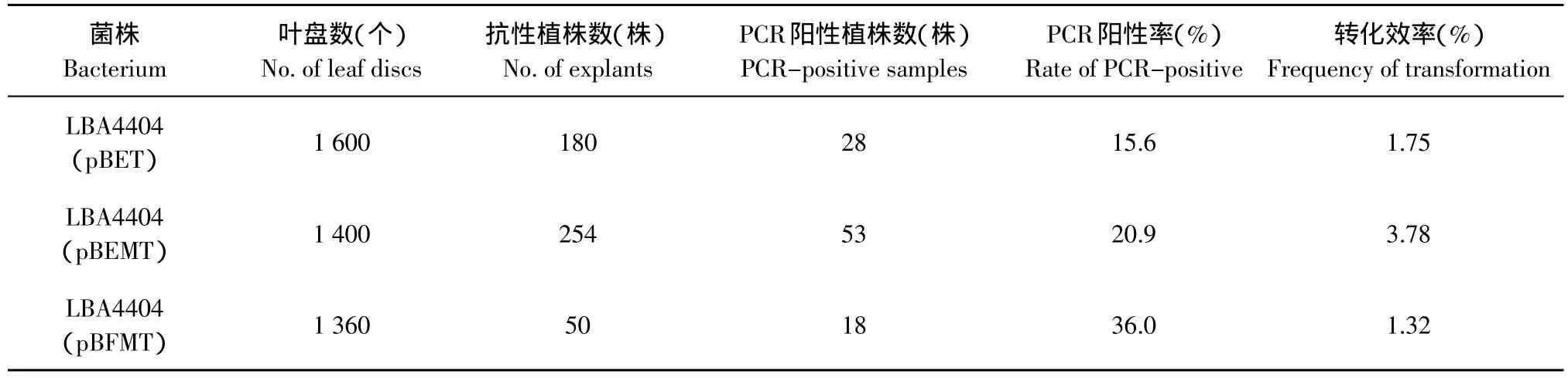
表9 质粒pBET、pBEMT、pBFMT转化草莓弗吉尼亚PCR检测结果和转化效率Table9 PCR certificating result of resistance plants transferred with pBET、pBEMT、pBFMT
3 讨 论
自Nehra等首次报道农杆菌介导法转化草莓成功后,这一转化体系便得到广泛应用与发展。本研究选择草莓主栽品种弗吉尼亚为转化受体材料,首先结合文献报道,建立草莓品种弗吉尼亚高效遗传转化体系,成功将t-PA基因转化草莓。利用这一转化系统,本实验室已成功将核糖体失活蛋白基因及天花粉蛋白基因转化草莓主栽品种森嘎拉和戈雷拉。
成功的遗传转化系统依赖于高频再生受体系统,是直接影响基因转化关键因素。在植物基因遗传转化中,首先是转化效率较低,其次是遗传转化中农杆菌、抗生素的使用等会降低转化外植体的再生频率,因此受体系统的再生频率对外源基因转化率有直接影响。在组织培养中经常会发生体细胞无性系变异情况,这与组织培养方法、再生途径及外植体基因型有关[12]。这些因素都会影响转化材料的分化特性,在原来适合非转化材料再生的条件下,有可能得不到较高的再生频率。本研究通过对影响草莓叶片再生因素的探讨,总结出影响草莓再生从而直接影响遗传转化效率的关键因素。
基因型是影响草莓离体再生的主要因子。本研究选用4种基因型,其中弗吉尼亚和森嘎拉再生能力较强,再生频率都在70%以上,可作为遗传转化受体材料,而哈尼和戈雷拉再生频率较低,不适宜遗传转化,或需对其再生条件进一步优化。
TDZ的应用能显著提高草莓叶盘再生能力。TDZ是一种棉花脱叶剂,自20世纪80年代初期被发现具有细胞分裂素活性后,广泛用于植物组织培养,是木本植物组织培养中的一次革新。TDZ的这种促进效应与其高细胞分裂素活性、提高IAA活性和促进乙烯合成有关,但具体作用机理尚不清楚[13-14]。本研究在进行预试验时,选用6-BA为细胞分裂素与生长素配合来诱导不定芽再生,但都因再生频率太低而不能用于遗传转化。国内外学者都有用6-BA诱导不定芽成功的报道,原因是基因型、培养条件等不同或不适造成。目前诱导草莓再生大多数都使用TDZ,其再生效果要显著高于6-BA,但是TDZ使用浓度超过2.0 mg·L-1时会产生较严重的玻璃化现象,且TDZ价格昂贵。6-BA与TDZ联合使用,既可降低成本又可抑制玻璃化现象。
叶盘放置方式对再生频率有显著影响。大多数基因型草莓叶盘对放置方式较敏感,叶盘近轴面向下不定芽分化率远远高于相反方向放置。因此,在选择草莓不同基因型进行再生试验时,必须对其叶盘放置方式进行探讨。
孙瑞芬等使用叶盘转化法将美洲拟鲽抗冻蛋白基因遗传转化草莓品种星都2号和全明星,通过PCR检测得到6个转化株系,星都2号转化效率为1.49%~1.67%,全明星为4.05%。与之相比,本试验转化效率基本在同一水平,达到1%~3%。
4 结论
试验探讨了影响草莓离体叶片不定芽诱导的主要因素,发现不同基因型草莓品种其再生频率存在显著差异。叶盘近轴面向下放置能显著提高草莓品种弗吉尼亚再生频率。建立了一个稳定的草莓植株再生体系,确定草莓品种弗吉尼亚不定芽诱导的最佳培养基组分为:MS+TDZ 2 mg·L-1+IBA 0.1 mg·L-1+2,4-D 0.2 mg·L-1,pH 5.8。 并以此体系为基础,以t-PA为目的基因,进行大规模遗传转化,获得大量转基因植株。
[1]雷家军,代汉萍,谭昌华,等.中国草莓属(Fragaria)植物的分类研究[J].园艺学报,2006,33(1):1-5.
[2]James D J,Passey A J,Barbera D J.Agrobacterium-mediated transformation of cultivated strawberry(Fragariaananassa Duch)using disarmed binary vectors[J].Plant Science,1990,69:79-94.
[3]Martinelli L,Rugini E,Saccardo F.Genetic transformation for biotic stress resistance in horticuhral plants[J].Vitro,2006,32(3):69-70.
[4]金万梅,尹淑萍,鲁韧强,等.GO基因对草莓遗传转化及抗病性鉴定[J].分子植物育种,2005,3(6):797-800.
[5]James D J,Passey A J,Esterbrook M A,et al.Progress in the introduction of transgenes for pest resistance in apples and strawberry[J].Phytoparasitica,1992,20(l):83-87.
[6]Nehra N S,Chibbar R N,Kartha K K,et al.Genetic transformation of strawberry by Agrobacterium tumefaciens using a leaf disk regeneration system[J].Plant Cell Rep,1990,9(6):293-298.
[7]张红梅,王俊丽.“全明星”草莓叶片遗传转化体系的建立[J].生物技术,2005,15(3):68-70.
[8]朱海生,温庆放,潘东明,等.反义乙烯受体FaEtr1和FaErs1基因对草莓的转化[J].农业生物技术学报,2009(5):825-829.
[9]于冬梅,胡文玉,王关林.基因型和培养因子对诱导草莓叶片再生芽的影响[J].沈阳农业大学学报,1998,29(2):138-143.
[10]陈琴芳,戴良英,邹学校.草莓高效离体再生体系的研究[J].湖南农业科学,2004(2):19-21.
[11]张利义,高遐虹,于同泉,等.草莓离体再生体系的研究[J].北京农学院学报,2004(2):5-7.
[12]袁维风,钱玉梅,徐德聪,等.影响草莓遗传转化率的因子及转CBF1基因植株的获得[J].江苏农业学报,2009(5):1124-1128.
[13]Asao H,Shinmyo A,Nishizawa Y.Environmental risk evaluation of transgenic strawberry expressing a rice chitinase gene[J].Seibutsu-kogaku,2003,81:57-63.
[14]Nehra N S,Chibbar R N,Kartha K K,et al.Agrobacterium-mediated transformation of strawberry calli and recovery of transgenic plants[J].Plant Cell Rep,1990,9(1):10-17.

