采后钙处理对香菇多糖和细胞稳定性的影响
侯 雪,李喜宏*,薛 婷
(天津科技大学食品工程与生物技术学院,天津 300457)
采后钙处理对香菇多糖和细胞稳定性的影响
侯 雪,李喜宏*,薛 婷
(天津科技大学食品工程与生物技术学院,天津 300457)
以采后香菇子实体为原料,采取CaCl2溶液真空渗透法,研究Ca2+处理对采后香菇多糖、β-1,3-葡聚糖酶活性、膜透性和MDA的影响。结果表明:0.12mol/L CaCl2处理的效果最好,β-1,3-葡聚糖酶活性为20.54U/mg,香菇多糖含量为0.38%,膜电导率为85.11%,MDA含量为2.48μmol/L,均优于对照。不同浓度Ca2+处理均能抑制香菇采后β-1,3-葡聚糖酶活性,降低香菇多糖贮藏期间的损耗,并有效维持细胞膜结构的完整性。
香菇;钙;香菇多糖;β-1,3-葡聚糖酶
Ca2+可以维持细胞壁和细胞膜的结构与功能,同时作为细胞内外信息传递的第2信使直接地或通过钙调蛋白及其受体间接地调节细胞中许多重要的酶和蛋白质,以实现外部刺激对细胞代谢、生长和分裂等活动的调控[1]。据研究,细胞成熟衰老速率常决定于组织中的Ca2+含量。外源Ca2+处理可以增加细胞内的钙水平,降低呼吸速率,延缓组织衰老速度,从而延长商品贮藏期,提高商品价值[2]。
香菇多糖是香菇中最重要的一种生物活性物质,有关香菇多糖的成分和结构报道甚多,但已明确结构与免疫活性关系的只有β-葡聚糖物质[3-4]。该多糖的一级结构具有β-(1,3)-D-葡聚糖残基主链,侧链由β-(1,6)键和β-(1,3)键相连的葡萄糖聚合体组成,是香菇细胞壁中的结构多糖[5]。香菇采后随着β-1,3-葡聚糖酶降解香菇多糖,香菇细胞壁结构的稳定性遭到破坏,营养价值会下降[6-7]。
目前,关于Ca2+处理对香菇采后生理生化变化的研究报道较少。本实验通过CaCl2溶液真空浸渗香菇子实体,探讨不同浓度的Ca2+处理对香菇采后香菇多糖、β-1,3-葡聚糖酶活性、还原糖、丙二醛(MDA)和膜透性等变化的影响,为进一步研究香菇采后贮藏保鲜技术提供理论依据。
1 材料与方法
1.1 材料及处理
香菇取自天津市林业果蔬研究所食用菌研究室。香菇采后当天挑选无机械伤、无病虫害、未开伞、大小均匀的子实体作为试验材料。
将选好的试验材料置于真空干燥器中,分别以0.06、0.12、0.18mol/L CaCl2溶液真空浸渗(33.33×103Pa)3min,以蒸馏水真空浸渗作为对照。每一处理的子实体约500g,设3个重复,处理后捞出沥干,置通风处晾干,室温贮藏,每2d随机取样测定各项指标。
1.2 试剂与仪器
β-巯基乙醇、 EDTA、PMSF、昆布多糖 天津市江天化工技术有限公司;考马斯亮蓝G-250、三氯乙酸、硫代巴比妥酸 天津市北方天医化学试剂厂。
LD5-2A离心机 北京医用离心机厂;JJ-1000精密型电子天平 常熟双杰测试仪器厂;WFJ721E分光光度计 上海光谱仪器有限公司;DK-98-1电热恒温水浴锅天津泰斯特仪器有限公司;DDS-307型电导仪 无锡市兴洲仪器仪表有限公司。
1.3 指标测定
1.3.1β-1,3-葡聚糖酶比活力测定
粗酶液的提取:4℃在研钵中加入2 g香菇和pH4.2 10mL 10mmol/L醋酸钠缓冲液(20mmol/Lβ-巯基乙醇、10mmol/L EDTA和1mmol/L PMSF)研磨匀浆,10000×g离心30min(4℃),所得上清液为粗酶液[7]。
β-1,3-葡聚糖酶测定:以从昆布多糖中释放出的还原糖量来测此酶比活力。用DNS法测定所形成的还原糖量。一个酶活力单位定义为1h内从昆布多糖中释放出1μmol葡萄糖所需要的酶量[7]。
粗酶液蛋白含量:用考马斯亮蓝G-250染色法测定以每毫克蛋白含有的酶单位数表示酶比活力/(U/mg)。每样品重复3次,以平均值绘制相对酶比活力净变化曲线。
1.3.2 香菇多糖的测定
取2g香菇加水定容至100mL,沸水浴3h,冷却后定容至100mL[8]。采用苯酚-硫酸法测定多糖含量[9]。
1.3.3 丙二醛的测定
参照林植芳等[10]的方法,以10%三氯乙酸(TCA)提取,利用MDA与硫代巴比妥酸反应后比色测定。
1.3.4 细胞膜透性的测定
将样品用去离子水冲洗3次,用滤纸吸干表面浮水,以10mmol/L直径的打孔器制取10个小圆片,放入试管,加入20mL去离子水,抽真空10min,静置30min,用电导仪测定浸提液的电导率为初电导率;然后沸水浴10min,静置30min,重新定容至20mL,再测电导率为终电导率。初电导率与终电导率之比为相对电导率,表示细胞膜透性[11]。
2 结果与分析
2.1 CaCl2处理对β-1,3-葡聚糖酶比活力的影响
如图1所示,不同浓度Ca2+处理均能抑制β-1,3-葡聚糖酶比活力的增加。其中,以0.12mol/L和0.18mol/L CaCl2处理的抑制效果较好。贮藏8d,0.12mol/L CaCl2处理的β-1,3-葡聚糖酶比活力最低为20.54U/mg,其次为0.18mol/L和0.06mol/L CaCl2处理,分别为28.86U/mg和37.97U/mg,对照为41.12U/mg。

图1 Ca2+处理对香菇采后β-1,3-葡聚糖酶比活力的影响Fig. 1 Effect of calcium treatment on β-1,3-glucanase activity in postharvested Lentinula edodes
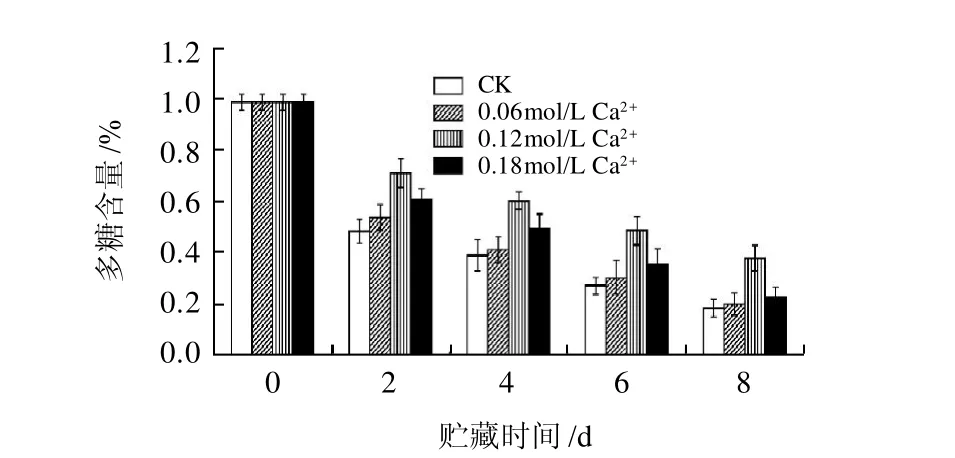
图2 Ca2+处理对香菇多糖含量的影响Fig.2 Effect of calcium treatment on lentinan content in postharvested Lentinula edodes
2.2 CaCl2处理对香菇多糖含量的影响如图2所示,随着贮藏时间的增长,香菇多糖含量会减少。Ca2+处理可以抑制香菇多糖的减少,特别是
0.12mol/L CaCl2处理对抑制香菇多糖含量下降的效果最显著,贮藏8d,0.12mol/L CaCl2处理后香菇多糖含量为
0.38%,比对照高107.1%。
2.3 CaCl2处理对相对电导率的影响

表1 Ca2+处理对香菇采后相对电导率的影响Table 1 Effect of calcium treatment on electrolyte leakage in postharvested Lentinula edodes
相对电导率的高低表示细胞膜透性的大小。果实采后细胞膜透性增大,加剧了底物与酶的接触,进一步使细胞结构的完整性受到影响,导致果实软化。表1表明,蒸馏水处理的香菇在采后相对电导率一直呈上升趋势,而Ca2+处理则能有效抑制相对电导率的上升,其中0.12mol/L CaCl2处理的抑制效果最好,可见Ca2+处理对维持细胞膜结构的完整性有良好作用。
2.4 CaCl2处理对丙二醛含量的影响

图3 Ca2+处理对MDA含量的影响Fig.3 Effect of calcium treatment on MDA content in postharvested Lentinula edodes
如图3所示,香菇采后贮藏期间,MDA含量呈上升趋势,与对照相比,Ca2+处理对丙二醛含量有抑制作用。其中,0.12mol/L CaCl2处理的抑制效果最好,这一结果也与Ca2+处理对相对电导率影响结果相吻合。丙二醛为膜脂过氧化的最终产物,膜脂过氧化的加剧会直接导致细胞膜结构破坏,透性增大[12]。
3 讨 论
Ca2+在延缓果蔬采后衰老方面的作用已有很多报道。外源Ca2+处理能够抑制与果实细胞壁稳定性有关的酶如β-1,3-葡聚糖酶的活性,保持果实细胞壁的完整性和延缓衰老[13];并且外源Ca2+还参与细胞壁的形成,增加果实细胞壁Ca2+含量和盐桥数量,减少细胞壁的分解[14]。
本实验表明,Ca2+处理可以减少贮藏期间香菇多糖的损耗,并抑制β-1,3-葡聚糖酶活性的增加,不同浓度Ca2+处理对β-1,3-葡聚糖酶活性有不同的抑制效果,其中以0.12mol/L CaCl2处理效果最好。适当浓度Ca2+处理(0.12~0.18mol/L)能显著减缓采后香菇多糖含量损耗和抑制β-1,3-葡聚糖酶活性的增加,这可能是由于适当浓度Ca2+处理能关闭膜上的Ca2+通道[15],钙离子累积于细胞膜外表面,这些Ca2+起着稳定细胞壁和细胞膜功能的作用[16-17],因而能抑制降解香菇多糖的β-1,3-葡聚糖酶的活性。这说明Ca2+处理是减少采后香菇多糖损耗并有效维持细胞稳定性的一种有效手段,具有易于操作、安全、有效等优点,值得应用推广。
[1] 马翎健. 细胞生物学[M]. 杨凌: 西北农林科技大学出版杜, 2006.
[2] 李金雨, 黄维南, 蔡龙祥, 等. 钙处理对香菇采后生理生化变化的影响[J]. 福建农业学报, 2000, 15(1): 43-47.
[3] 郑虹, 叶秋焰. 香菇多糖的药理及临床应用研究进展[J]. 海峡药学,2006, 18(4): 150-154.
[4] KUPFAHL C, GEGINAT G, HOF H. Lentinan has a stimulatory effect on innate and adaptive immunity against murineListeria monocytogenesinfection[J]. Int Immunopharmacol, 2006, 6(4): 686-696.
[5] SASAKI T, TAKASUKA N. Further study of the structure of lentinan,an anti-tumor polysaccharide fromLentinus edodes[J]. Carbohydrate Research, 1976, 47(1): 99-104.
[6] MINATO K, MIZUNO M, TERAI H, et al. Autolysis of lentinan, an antitumor polysaccharide, during storage ofLentinus edodes, shiitake mushroom[J]. Journal of Agricultural and Food Chemistry, 1999, 47(4):1530-1532.
[7] MINATO K, KAKAWAMI S, NOMURA K, et al. An exoβ-1,3 glucanase synthesized de novo degrades lentinan during storage ofLentinula edodesand diminishes immunomodulating activity of the mushroom[J]. Carbohydr Poly, 2004, 56: 279-286.
[8] 张志军, 刘建华, 李淑芳, 等. 灵芝多糖含量的苯酚硫酸法检测研究[J]. 食品工业科技, 2006, 27(2): 193-195.
[9] 张青, 张天民. 苯酚-硫酸比色法测定多糖含量[J]. 山东食品科技,2004(7): 17-18.
[10] 林植芳, 李双顺, 张东林. 采后荔枝果实中氧化和过氧化作用的变化[J]. 植物学报, 1988, 30(4): 382-387.
[11] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006.
[12] 陈少裕. 膜脂过氧化对植物细胞的伤害[J]. 植物生理学通讯, 1991,27(2): 84-90.
[13] 陈见晖, 周卫. 钙对苹果果实过氧化物酶、β-1,3-葡聚糖合成酶和β-1,3-葡聚糖分解酶活性的影响[J]. 中国农业科学, 2004, 37(3): 400-405.
[14] 关军锋. 果树钙素营养与生理[M]. 北京: 科学出版社, 2005.
[15] HANSON J B. The functions of calcium in plant nutrition[J]. Adv Plant Nutr, 1984(1): 149-208.
[16] 莫开菊, 汪兴华. 钙与果实采后生理[J]. 植物生理学通讯, 1994, 30(1): 44-47.
[17] 陈晓明, 黄维南. 钙在防止与缓和采后果蔬生理病害和衰老中的作用[J]. 植物生理学通讯, 1990, 26(2): 60-61.
Effect of Postharvest Calcium Treatment on Lentinan Content and Cell Stability ofLentinula edodes
HOU Xue,LI Xi-hong*,XUE Ting
(College of Food Engineering and Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China)
Fruit bodies ofLentinula edodessubjected to vacuum-infiltrated calcium chloride treatment were used as the materials to explore the effect of calcium treatment on lentinan content,β-1,3-glucanase activity, electrolyte leakage and MDA content.The results showed that the effect of 0.12 mol/L CaCl2 was the best solution. Under the treatment of 0.12 mol/L CaCl2,β-1,3-glucanase activity was 20.54 U/mg, lentinan content was 0.38%, electrolyte leakage was 85.11% and MDA content was 2.48 μmol/L. Calcium treatments could restrainβ-1,3-glucanase activity, reduce the loss of lentinan during storage and maintain the integrity of cell membrane structure.
Lentinula edodes;calcium;lentinan;β-1,3-glucanase
TS255.3
A
1002-6630(2012)10-0298-03
2011-04-12
“十一五”国家科技支撑计划项目(2008BADAIB07)
侯雪(1987—),女,硕士,研究方向为功能性碳水化合物应用。E-mail:houxue1987@126.com
*通信作者:李喜宏(1960—),男,教授,博士,研究方向为农产品加工与贮藏。E-mail:lixihong606@163.com

