沙城产区酿酒酵母多样性研究
赵静静,李 艳,2,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄 050018)
沙城产区酿酒酵母多样性研究
赵静静1,李 艳1,2,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄 050018)
对沙城产区龙眼葡萄相关环境中分离筛选的酿酒酵母进行多样性研究。在连续3年(2008、2009、2010年)的实验中,共从葡萄园土壤、葡萄酒厂设备表面、接触过葡萄酒厂设备的葡萄汁和自然发酵过程中采集菌源样品227份,共分离得到1358株酵母菌。用5.8S-ITS区域RFLP方法进行分子水平的分类鉴定及赖氨酸培养基复筛,得到了270株酿酒酵母。再利用Interdelta PCR指纹图谱法将酿酒酵母区分为16类,其中土壤5类,自然发酵过程中第2、3、4期分别得到4类、10类和11类;酒厂设备表面3类;接触酒厂设备的葡萄汁3类。酿酒酵母的种类因样品采集时间、采集地点等不同有明显区别。自然发酵过程中得到的酿酒酵母被认为是本土酵母的可能性最大。
酿酒酵母;5.8S-ITS区域RFLP分析;Interdelta PCR指纹图谱法;生物多样性;本土酵母
葡萄酒发酵过程是复杂的微生物代谢过程,涉及细菌、霉菌、酵母菌等多种微生物,其中酵母菌起着关键作用。在发酵初期,非酵母属酵母占主导优势[1],随着发酵进行,发酵液中乙醇含量逐渐增加,对乙醇耐受力不高的非酵母属酵母逐渐被淘汰,取而代之的是酵母属酵母,最终完成整个发酵过程[2-3]。前人[4-5]的研究发现,酿酒酵母对于葡萄酒中最终挥发性化合物的形成及感官品质有着非常重要的影响。目前国内大多数葡萄酒生产企业都是采用商品活性干酵母进行生产,其优点是性能稳定的酵母菌能够确保质量统一的产品,却很难得到独特风味的葡萄酒。因此,在产区环境范围内,分离和筛选适合特定葡萄产区和葡萄品种的酿酒酵母菌株具有十分重要的意义。
目前,用于酵母菌属和种水平区分鉴定的分子方法有许多种,限制性片段长度多态性(RFLP)分析由于其鉴定结果的准确性和操作简便被广泛的予以应用[6-7]。对于酿酒酵母种以下水平区分的方法包括Interdelta 序列指纹图谱分析和线粒体DNA限制性分析等[8-10]。本研究采用5.8S-ITS区域RFLP分析法和Interdelta 序列指纹图谱分析对对龙眼葡萄酒环境中连续3年分离得到的酵母菌进行属、种和种以下水平的区分,研究沙城产区酿酒酵母的多样性,为进一步筛选获得特色的土著酵母提供参考。
1 材料与方法
1.1 样品的采集及处理
1.1.1 样品采集
本研究于2008—2010年3个酿酒季节(10月)和2009年非酿酒季节(4月),从河北沙城酿酒葡萄产区的怀来县沙城镇选择了沙营、夹河和东水泉3个自然村的龙眼葡萄园,以及中国长城葡萄酒有限公司的两个酿酒车间,采集葡萄园土壤、葡萄果实、葡萄鲜汁、自然发酵过程的发酵液和擦拭酿酒设备内壁等样品共计227份,用于分离纯化酵母菌株。
1.1.2 样品处理
所有样品均无菌采集、24h内运输回实验室。
土壤:称取1g土壤,加无菌水进行梯度稀释,用于纯种分离。
葡萄浆果:取新鲜完整的龙眼葡萄浆果(约20g),置于无菌生理盐水溶液中,轻柔振荡10min,再进行梯度稀释。
葡萄鲜汁:实验室自制:在无菌状态下,将葡萄压榨出汁后,进行梯度稀释;接触酒厂设备的葡萄汁:从中国长城葡萄酒有限公司酿酒车间取汁,在实验室无菌状态下进行梯度稀释。
自然发酵:取龙眼葡萄,在实验室无菌条件下破碎压榨进行自然发酵,按发酵液中残糖量的不同将发酵分为4个时期:第1个时期为加SO2及果胶酶浸渍24h后取样,第2个时期为发酵液中残糖80%(质量分数,下同),第3个时期为发酵液中残糖30%,第4个时期为发酵液中残糖4g/L以下。每个发酵时期采集发酵液样品1mL,进行梯度稀释。
设备表面:用无菌棉球擦拭设备内壁表面约40cm2,将其中的菌液挤出,定容到20mL后取1mL进行梯度稀释。
经梯度稀释后的样品0.2mL涂布于WL培养基上,25℃条件下培养7d,挑菌经划线培养得到单菌落。
1.2 酿酒酵母菌株的筛选
1.2.1 WL培养基进行菌落聚类及巨大菌落观察
将菌株划线接种于WL培养基上,25℃条件下培养7 d,观察菌落形态,挑选酿酒酵母菌株。
巨大菌落形态观察:将供试细胞悬液用0.8%的无菌生理盐水稀释至以0.1mL 细胞悬液含10个细胞为佳,涂布在10%的麦汁明胶培养基平板上,在20℃左右培养3~4周。待巨大菌落形成后,观察菌落的大小、颜色、形态、光泽和周缘形状等。
1.2.2 酵母菌5.8S rRNA-ITS区域及核糖体26S D1/D2区域RFLP分析
1)DNA提取:SDS裂解法[11]。
2)5.8S rRNA-ITS区域PCR反应体系[6](50μL):引物 ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)、ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)各 0.5μmol/L;dNTP 0.2mmol/L;Colorless GoTaq Reaction Buffer 10μL;TaqDNA 聚合酶2.5μL;模板DNA 1μL。
PCR反应条件:95℃预变性7min;95℃变性1min,52℃退火2min,72℃延伸2min,循环35次;再72℃延伸10min。PCR产物用2%琼脂糖凝胶70V电泳检测。
3)核糖体26S D1/D2区域PCR反应体系(50μL):引物NL1(5′-GCA TAT CAA TAA GCG GAG GAAAAG-3′),NL2(5′-GGT CCG TGT TTC AAG ACG G-3′)各0.2 μ mol/L;dNTP 0.2mmol/L,Colorless GoTaq Reaction Buffer 10μL,TaqDNA聚合酶2.5U,模版DNA 1μL。
PCR反应条件:95℃预变性7min;94℃变性1min,52℃退火1min,72℃延伸80s,循环36次;再72℃延伸8min。PCR产物用2%琼脂糖凝胶70V电泳检测。
4)利用3种限制性内切酶HaeIII、Hinf I和cofI对扩增产物进行酶切[12]。酶切反应体系20μL,10×Buffer 2 μL、BSA 0.2μL、PCR产物8μL、限制性内切酶1μL。37℃温育2h;3%琼脂糖凝胶电泳检测,控制电压70V。
1.2.3 赖氨酸培养基复筛酿酒酵母
赖氨酸培养基(g/L):D-葡萄糖 10、L-组氨酸0.001、DL-蛋氨酸0.002、DL-色氨酸0.002、对-氨基苯甲酸2×104、生物素2×105、叶酸2×106、肌醇0.01、烟酸4×104、泛酸0.002、盐酸吡哆醇4×104、核黄素2×104、盐酸硫胺素4×104、硼酸5×104、结晶氯化铜4×105、碘化钾1×104、结晶氯化铁2×104、结晶硫酸锰4×104、结晶钼酸钠2×104、结晶硫酸锌4×104、磷酸二氢钾0.85、磷酸氢二钾0.15、结品硫酸镁0.5、氯化钠0.1、结晶氯化钙0.1、赖氨酸盐酸盐2.5、琼脂20,pH值自然,121℃灭菌20min[13]。
酿酒酵母菌株的复筛:将经过初筛的菌株,接种到YEPD液体培养基中活化24h后,按照1%接种量接种到5mL无菌水中进行菌株饥饿处理,7d后接种到赖氨酸培养基中,27℃条件下培养15d后观察酵母生长情况。
1.3 Interdelta PCR指纹图谱法区分鉴定酿酒酵母菌株
DNA提取:SDS裂解法[11]。
反应体系(50μL):引物δ12、δ2各1μmol/L;dNTP 0.2mmol/L;Colorless GoTaq Reaction Buffer 10μL;TaqDNA聚合酶0.5μL;模板DNA 1μL。
反应条件:97℃预变性4min;94℃变性30s,45℃退火1min,72℃延伸2min,循环30次;再72℃延伸10min。PCR 产物用2%琼脂糖凝胶70V电泳检测。
2 结果与分析
2.1 酵母菌的分离
从沙城产区龙眼葡萄相关环境(包括葡萄园土壤、葡萄酒厂设备表面、接触过葡萄酒厂设备的葡萄汁和自然发酵过程)采集227份样品,共筛选得到1358株酵母菌。通过WL培养基进行酵母菌的形态聚类和区分得到42种不同的形态类型[14]。
2.2 酿酒酵母的筛选
2.2.1 菌落形态聚类结果
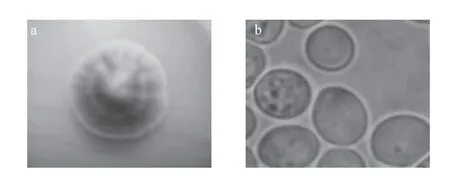
图1 酿酒酵母的菌落形态(a)和显微形态(b)Fig.1 Colonial and microscopic morphology of Saccharomyces cerevisiae
由图1可知,经过WL培养基的培养及巨大菌落的观察,单菌落形态为边缘微绿色,中间颜色略深,火山状凸起,表面光滑有褶皱,边缘较整齐;显微镜观察其细胞的显微形态为卵圆形,有的菌株正在进行出芽生殖,此类酵母菌被初步认定为酿酒酵母(Saccharomyces cerevisiae)[15]。
2.2.2 酵母菌的5.8S rRNA-ITS区域及核糖体26S D1/D2区域RFLP分析
在酵母菌形态初步鉴定的基础上,利用5.8S rRNAITS区域及核糖体26S D1/D2区域RFLP分析的方法对此类酵母进行分子鉴定,分析结果见表1。结果证明这种形态类型的酵母菌的确是酿酒酵母(Saccharomyces cerevisiae)[16],初筛得到300株,其中,2008年酿酒季节54株,2009年170株,2010年76株。而2009年非酿酒季节未筛得该酵母菌株,原因是非酿酒季节只是对土壤进行了采样分离,而土壤中本来所含酵母菌数量就不多,再经过实验过程中的定量梯度稀释,使得筛得酵母菌株的几率缩小,因而从非酿酒季节的土壤中不易获得酿酒酵母菌株[17]。另外,沙城产区春季风沙较大,天气干燥也是未分离到酿酒酵母的原因之一。

表1 5.8S rRNA-ITS区域及核糖体26S D1/D2区域RFLP分析结果Table 1 RFLP analysis result 5.8S rRNA-ITS and 26S D1/D2 of isolated yeasts
随机挑取两株进行5.8S rRNA-ITS区域PCR产物进行核苷酸序列测定,通过与NCBI数据库进行比对来最终确定酵母菌的种属。通过与Genebank数据库菌株比对,菌株鉴定为酿酒酵母,结果见表2。

表2 酵母菌5.8S-ITS区域的基因序列分析结果Table 2 Sequence analysis of the 5.8S-ITS of yeast strains
2.2.3 赖氨酸培养基复筛酿酒酵母
酿酒酵母不能采用赖氨酸作为酵母氮源,因而在赖氨酸培养基上不能生长,故可以通过赖氨酸培养基对初步鉴定为酿酒酵母的菌株进行复筛[13]。结果显示,其中30株菌在培养了3~4周后能够在赖氨酸培养基上生长,证明其并不是酿酒酵母,因此酿酒酵母菌株共筛选得到了270株。
2.3 Interdelta PCR指纹图谱法区分鉴定酿酒酵母

图2 酿酒酵母PCR产物电泳图Fig.2 Interdelta fingerprinting patterns of Saccharomyce cerevisiae

表3 Interdelta PCR指纹图谱分析结果Table 3 Results of Interdelta fingerprinting analysis of Saccharomyces cerevisiae
对所得270株酿酒酵母进行Interdelta PCR指纹图谱法的区分鉴定,分为16类,分析结果如表3所示,电泳图谱如图2所示。
2008年筛选得到的36株酿酒酵母经过PCR指纹图谱分析区分为5类,2009年158株区分为9类,2010年76株区分为4类。其中仅有2类在两年出现:类型1在2008年和2010年都分离得到;类型5同时出现在2008年和2009年。从菌源分析,土壤中分离得到5类酿酒酵母共25株,占总菌数的9.3%;自然发酵第2期得到4类共26株,占总菌数的9.6%;自然发酵第3期得到10类共97株,占总菌数的35.9%;自然发酵第4期得到11类共80株,占总菌数的29.6%;酒厂设备分离得到3类共26株,占总菌数的9.6%;接触酒厂设备鲜汁得到3类16株,占总菌数的5.9%。自然发酵过程的第3、4期酿酒酵母的多样性是最显著的。由于风、雨等气候因素的影响,使葡萄浆果表面酵母菌的数量很少,按照本实验操作在葡萄浆果表面未筛得酿酒酵母。但是葡萄自然发酵过程所出现的酵母菌株应该是来自葡萄果表面,因为在发酵过程中少量菌株自身生长使菌群壮大,再加上这些酵母的发酵能力和酒精耐受力强,在自然发酵中后期成为主导菌群,故筛选到大量菌株,在这些酵母中最有可能筛得本土酿酒酵母。由于企业生产采用商品酵母,发酵完成后设备清洗和灭菌的不彻底,导致从酒厂设备表面及鲜汁中筛选得到的酵母菌多为商用酵母的可能性较大,不易获得本土菌株。
对区分得到的16类酿酒酵母进行统计分析,可见各类酿酒酵母所占比例和彼此的关系,分别见图3、4。

图3 各类型酿酒酵母所占比例Fig.3 Composition of various populations of Saccharomyce cerevisiae
由图3可知,类型5和9数量最多,占酿酒酵母总数的20%左右,其他类型数量均低于12%。这两个类型的菌株在2008年和2009年的3个葡萄园土壤和自然发酵过程中筛得。

图4 酿酒酵母聚类分析树形图Fig.4 Phylogenetic tree of Saccharomyce cerevisiae
由图4可知,各类型菌株的亲缘关系。其中,类型3和16亲缘关系最近,而类型10与其他类型菌的关系最远。葡萄酒相关环境受年份、气候等条件的影响,会导致微生物组成的变化[18],因此酿酒酵母经过区分鉴定后的类型也相对较多。
2.4 本土酿酒酵母的分布
在葡萄酒生产中应用本土酿酒酵母,容易获得具有地区特色的葡萄酒产品。目前国内葡萄酒生产企业都是应用商用活性干酵母进行生产,难以获得具有独特风味的葡萄酒,因此筛选本土优良酵母菌具有十分重要的应用价值。与我国常用的5种商用活性干酵母的PCR指纹图谱鉴定结果进行比对,其中包括LAFFORT F5、Zymaflore F15、安琪葡萄酒酵母、Lalvin CY-3079、Vitilevure KD[19]。
电泳条带大小比对的结果显示,在沙城产区分离到的酿酒酵母菌中存在着商用酵母。其中,筛选得到的酿酒酵母类型1与Lalvin CY-3079一致,这类酵母来自2008年夹河土壤、接触过设备的葡萄汁还有2010年夹河自然发酵4期。其他15类与商用酵母不同,有可能是本土酵母。特别是在自然发酵第3、4期筛到的14类均为本土酵母。
总的来说,获得本土酿酒酵母的途径主要是土壤、葡萄果表面、自然发酵过程。本研究土壤中分离到4种类型的本土酵母。自然发酵过程中共分离到14种类型的酿酒酵母,其中13种类型为本土酵母。
3 结 论
本实验研究了沙城产区龙眼葡萄酒相关环境中分离得到的酿酒酵母种类及多样性。利用Interdelta PCR指纹图谱法将分离得到的270株酿酒酵母区分为16类。其中土壤中分离得到5类;自然发酵2、3、4期分别为4类、10类和11类;酒厂设备3类;接触酒厂设备鲜汁3类。其中有一类酿酒酵母属于商用酵母CY-3079,其余15类均为沙城产区的本土酿酒酵母菌株。自然发酵过程中酿酒酵母的多样性复杂,是分离本土优良酵母的重要来源。本研究为针对特定葡萄产区和葡萄品种进行优良本土酵母的筛选奠定了基础。后续对筛得菌株的生理生化特性及酿酒性能的研究还在进行中。
[1] ZOTT K, MIOT S C, CLAISSE O, et al. Dynamics and diversity of non-Saccharomycesyeasts during the early stages in winemaking[J].International Journal of Food Microbiology, 2008, 125(2): 197-203.
[2] PINA C, SANTOS C, COUTO J A, et al. Ethanol tolerance of five non-Saccharomyceswine yeasts in comparison with a strain ofSaccharomycescerevisiae: influence of different culture conditions[J]. Food Microbiology, 2004, 21(4): 439-447.
[3] 杨莹, 徐艳文, 薛军侠, 等. WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J]. 微生物学杂志, 2007, 29(5): 75-78.
[4] REGODON M J A, PEREZ N F, FERNANDEZ M R, et al. Influence ofSaccharomyces cerevisiaeyeast strain on the major volatile compounds of wine[J]. Enzyme and Microbial Technology, 2006, 40(1): 151-157.
[5] DOMIZIO P, LENCIONI L, CIANI M, et al. Spontaneous and inoculated yeast populations dynamics and their effect on organoleptic characters of Vinsanto wine under different process conditions[J]. International Journal of Food Microbiology, 2007, 115(3): 281-289.
[6] ESTEVE Z B, BELLOCH C, URUBURUL F, et al. Identification of yeasts by RFLP analysis of the 5.8S rRNA gene and the two ribosomal internal transcribed spacers[J]. International Journal of Systematic Bacteriology, 1999, 49(1): 329-337.
[7] SABATE J, CANO J, ESTEVE Z B, et al. Isolation and identification of yeasts associated with vineyard and winery by RFLP analysis of ribosomal genes and mitochondrial DNA[J]. Microbiological research,2002, 157(4): 267-274.
[8] MERCADOA L, DALCERO A, MASUEKKI R, et al. Diversity ofSaccharomycesstrains on grapes and winery surfaces: analysis of their contribution to fermentative flora of Malbec wine from Mendoza (Argentina)during two consecutive years[J]. Food Microbiology, 2007, 24(4): 403-412.
[9] CIANI M, MANNAZZU I, MARINANGELI P, et al. Contribution of winery-residentSaccharomyces cerevisiaestrains to spontaneous grape must fermentation[J]. Food Microbiology, 2004, 85(2): 159-164.
[10] JEUNE L C, ERNY C, DEMUYTER C, et al. Evolution of the population ofSaccharomyces cerevisiaefrom grape to wine in a spontaneous fermentation[J]. Food Microbiology, 2006, 23(8): 709-716.
[11] 萨姆布鲁克 J, 弗里奇 E F, 曼尼阿蒂斯 T. 分子克隆实验指南[M].金冬雁, 译. 北京: 科学出版社, 1996: 465-467.
[12] 王泽举. 新疆、甘肃地区葡萄酒相关酵母菌的鉴定及多样性研究[D]. 杨凌: 西北农林科技大学, 2008.
[13] 庞红勋, 崔艳, 刘金福, 等. 本土葡萄酒酵母的选育及发酵性能[J].食品研究与开发, 2010(6): 169-174.
[14] 薛军侠, 徐艳文, 杨莹, 等. WL培养基在酿酒酵母筛选中的应用[J].中国酿造, 2007(9): 36-39.
[15] 焦红茹, 刘树文, 祖显生, 等. 赤霞珠相关酵母菌的分离及其分子生物学鉴定[J]. 酿酒科技, 2007(12): 17-20.
[16] GUILLAMON J M, SABATE J, BARRIO E, et al. Rapid identification of wine yeast species based on RFLP analysis of the ribosomal ITS regions[J]. Archives of microbiology, 1998, 169(5): 387-392.
[17] PRETORIUS I S, WESTHUIZEN T J, AUGUSTYN O. Yeast biodiversity in vineyards and wineries and its importance to the South African wine industry[J]. South African Journal for Enology & Viticulture,1999, 20(2): 61-74.
[18] 李艳, 卢君, 张利中, 等. 沙城龙眼葡萄自然发酵过程相关酵母生物多样性研究[J]. 食品科学, 2009, 30(21): 237-240.
[19] 李艳, 卢君, 崔建东, 等. 分子生物学方法区分鉴定五种常用葡萄酒活性干酵母[J]. 食品科学, 2009, 30(19): 200-202.
Diversity ofSaccharomyces cerevisiaein Different Habitats in Shacheng Region
ZHAO Jing-jing1,LI Yan1,2,*
(1. College of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang 050018, China;
2. Research Center for Fermentation Engineering of Hebei Province, Shijiazhuang 050018, China)
In this study, the biodiversity ofSaccharomyces cerevisiaeisolated from different environments associated with Longan grape in Shacheng wine-producing region was investigated. In the continuous three years 2008, 2009 and 2010, 227 samples were collected from vineyard soil, the surface of winery equipments, grape juice contacted with winery equipments and naturally fermented grape and 1358 yeast strains were isolated from them. Molecular-level identification based on a PCR-RFLP analysis of 5.8S ITS rRNA and secondary screening using lysine medium were carried out to obtain 270Saccharomyces cerevisiaestrains. Further, the strains were divided using Interdelta PCR into 16 classes, including 5 from vineyard soil, 4, 10 and 11 from at the 2nd, 3rdand 4thstages of natural fermentation respectively, 3 from the surface of winery equipments and 3 from grape juice contacted with winery equipments.Saccharomyces cerevisiaespecies notably varied with sampling time and habitat.Saccharomyces cerevisiaestrains isolated from naturally fermented grape had the greatest possibility of being indigenous strains.
Saccharomyces cerevisiae;restriction pattern of amplified 5.8S-ITS rRNA gene (RFLP);Interdelta PCR;biodiversity;indigenous yeast
Q78
A
1002-6630(2012)05-0224-05
2011-10-24
河北省科技支撑计划项目(092210003D);河北省自然科学基金项目(C2011208028)
赵静静(1985—),女,硕士研究生,研究方向为传统发酵工程创新技术。E-mail:576556889@qq.com
*通信作者:李艳(1958—),女,教授,本科,研究方向为葡萄酒科学技术。E-mail:lymdh5885@163.com

