响应面法优化根霉菌产麦角固醇的液体发酵工艺
汪财生,汪乐意,高有领*,谭志文,杨震峰
(浙江万里学院生物与环境学院,浙江 宁波 315100)
响应面法优化根霉菌产麦角固醇的液体发酵工艺
汪财生,汪乐意,高有领*,谭志文,杨震峰
(浙江万里学院生物与环境学院,浙江 宁波 315100)
以米根霉(Rhizopus oryzaeZW017)发酵产麦角固醇的产量为响应值,对其液体发酵工艺进行优化。采用HPLC法检测菌株产麦角固醇含量,在单因素筛选试验基础上,以PDB液体发酵培养为基础条件,应用响应面分析法(RSM)对碳源、氮源及发酵时间进行优化。结果表明:以葡萄糖、酵母膏分别为最佳碳、氮源;最佳工艺条件为:PDB基础培养基中添加葡萄糖3g/L、酵母膏5g/L、发酵培养9.64d,麦角固醇平均产量达5761.83μg/100mL,较优化前提高了247.86%,与构建模型理论预测值(5818.39μg/100mL)相吻合,且100mL液体培养基中麦角固醇产量占菌体细胞干质量(0.36g)的1.60%。
根霉菌;麦角固醇;响应面分析法
麦角固醇(C28H43OH)又名麦角甾醇,化学名称为24β-甲基胆固醇-5,7-烯-3β-羟基,在常温下麦角固醇呈白色片状晶体或针状晶体,相对分子质量396.63,不溶于水,易溶于石油醚、乙醚、庚烷等有机溶剂。麦角固醇是一种重要的医药化工原料,可用于“可的松”、“激素黄体酮”及“芸苔素内酯”等药物的生产,也是脂溶性VD2的前体,当受到紫外线照射时可转化为VD2,具有很高的经济价值[1]。由于我国生产麦角固醇的能力低,生物合成途径尚处于不成熟阶段,而且麦角固醇转化成VD2的工艺比较落后,但我国对VD2的需求量又很大,其生产远远不能满足市场的需求,每年需要从国外进口一定量的麦角固醇,因此,麦角固醇的研究开发有很大的市场。
麦角固醇主要存在于植物和一些真菌的质膜上[2]。目前,国外主要采用微生物发酵法生产麦角固醇,所用的菌种有酵母菌、曲霉和青霉,其产量分别可达细胞干质量的2.7%、2.0%和1.8%左右[3-4];由于他们重视高产菌株的选育,以及对影响麦角固醇产生的代谢调控、发酵条件优化等研究,其生产一直处于稳中有升的趋势[4-5]。国内于20世纪50年代起开始对酵母产麦角固醇进行研究,主要用酵母菌、黑曲霉及红曲霉固体发酵生产麦角固醇,产量相对较低,仅为细胞干质量的0.8%~1.2%[4];如朱效刚等[6]利用红曲霉SJS-20固态发酵,麦角固醇产量达到细胞干质量的0.82%,陈松生等[7]以Monascus purpureus625进行液体发酵,得到麦角固醇产量为菌体干质量的1.68%左右,宁玮霁等[8]以红曲霉Monascussp. ZZ为菌种进行液体发酵培养,得到菌体干质量1.13%的麦角固醇,李国友等[9]从根霉3078菌丝体的甲醇提取物中分离得到9种化合物并对其进行波谱分析,结果检测到麦角甾醇的产生,该麦角甾醇被鉴定为5a,8a-表二氧-(20S,22E,24R)-麦角甾-6,22-二烯-3-醇。笔者在以PDB培养基筛选高产植酸酶实验中发现一株高产麦角固醇根霉菌。因此,本试验采用响应面法对影响该菌株产麦角固醇的主要碳源、氮源、培养时间进行优化,以期为工业化高效生产麦角固醇及综合开发根霉菌提供依据。
1 材料与方法
1.1 菌种、培养基与试剂
米根霉(Rhizopus oryzaeZW017)由王国良教授提供,浙江万里学院省重点微生物学科实验室保存。
斜面及平板培养基为PDA培养基、基础发酵培养基为PDB培养基 天津市永大化学试剂开发中心。
麦角固醇(纯度≥99.8% 美国Sigma公司;甲醇、乙腈(色谱纯) 天津市四友精细化学品有限公司。
1.2 仪器与设备
QYC-211型恒温振荡培养箱 上海福玛实验设备有限公司;Agilent 1100高效液相色谱仪 美国Agilent公司。
1.3 方法
1.3.1 菌种活化
将斜面保存的菌种转接到平板培养基,置于28℃恒温培养箱内培养5~7d,待平板培养基长出大量根霉菌孢子后,用吐温-80轻轻洗下,无菌水调整孢子浓度至107个/mL左右备用。
1.3.2 基础发酵
在250mL三角瓶装基础发酵培养基100mL,将液体种子按10%接种量接入培养基中,于28℃、150r/min振荡培养3d,每次处理设3个平行实验,收集菌体测定麦角固醇含量,取平均值,并以此为对照实验。
1.3.3 碳源的筛选
1.3.3.1 不同碳源对麦角固醇产量的影响
将葡萄糖、乳糖、蔗糖分别以3g/L加入基础发酵培养基中进行单因素筛选试验,每种碳源设3个平行实验,测定菌体麦角固醇产量,取其平均值。
1.3.3.2 不同质量浓度碳源对麦角固醇产量的影响
将1.0、2.0、3.0、4.0、5.0、6.0g/L不同质量浓度的最佳碳源分别加入到基础培养基中进行单因素试验,每个质量浓度平行实验3次,测定菌体麦角固醇产量,取其平均值。
1.3.4 氮源的筛选
1.3.4.1 不同氮源对麦角固醇产量的影响
将蛋白胨、牛肉膏、酵母膏、(NH4)2SO4分别以3g/L添加到基础发酵培养基中进行单因素试验,每种氮源设3个平行实验,测定菌体麦角固醇产量,取其平均值。
1.3.4.2 不同质量浓度氮源对麦角固醇产量的影响
将1.0、2.0、3.0、4.0、5.0、6.0g/L最佳氮源分别加入基础培养基中进行单因素试验,每个质量浓度设3个平行实验,测定菌体麦角固醇产量,取其平均值。
1.3.5 发酵时间对麦角固醇产量的影响
将PDB基础发酵培养基接种,按1.3.2节方法分别于发酵3、4、7、9、11、13d后收集菌体,密封冰冻保存,同批处理每个时间设3个平行实验,测定菌体麦角固醇产量,取其平均值。
1.3.6 响应面分析法优化发酵条件
根据上述单因素试验结果,以菌体麦角固醇产量为响应值,采用响应面分析方法(RSM)研究几个发酵因素间交互作用对米根霉产麦角固醇的影响,以确定最佳发酵工艺参数。根据Box-Benhnken的中心组合试验设计原理,设计响应面分析法优化发酵条件,再借助软件Design Expert(Version7.1.3)对结果进行分析,以筛选最佳发酵工艺参数,并对结果进行验证。RSM试验设计如表1所示。
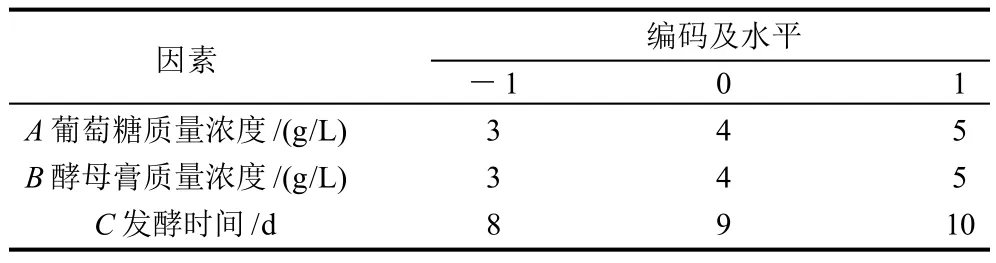
表1 米根霉液体发酵产麦角固醇Box-Benhnken试验设计因素水平编码水平表Table 1 Coded values and corresponding actual values of the optimization parameters used in response surface analysis
1.3.7 米根霉菌体生物量与麦角固醇产量测定
1.3.7.1 菌体收集与生物量计算
将三角瓶中菌体发酵液转移至500mL离心管中,10000r/min离心10min,弃上清液,蒸馏水洗涤沉淀2次,重复离心,所得菌体于真空干燥箱50~60℃烘干至质量恒定,准确称取其质量。生物量用100mL液体培养基中菌体质量表示。
1.3.7.2 麦角固醇提取
参照文献[10],对上述计算生物量后的菌体采用皂化-乙醚萃取-乙醇溶解定容法进行麦角固醇样品的提取与制备。
1.3.7.3 麦角固醇含量检测
采用HPLC检测方法[10],并进行改进。选用Agilent ODS C18色谱柱(150mm×4.6mm,5μm),流速1.2mL/min,柱温35℃,检测波长282nm,检测每100mL液体培养基的菌体中麦角固醇含量。
2 结果与分析
2.1 麦角固醇含量测定标准曲线
配制不同质量浓度的6个麦角固醇标准样品,采用液相色谱仪在波长282nm处测得色谱图,其中3.3μg/mL标样图谱见图1。此色谱工作条件下仪器精密度为1.40%(n=5),平均加标回收率达104.20%(n=5),表明仪器性能良好,误差较低,麦角固醇色谱峰与杂质有较好的分离效果;麦角固醇标准曲线回归方程为:y=18.325x-11.689,相关系数R2=0.9996,麦角固醇在3.3~165μg/mL范围内与峰面积呈良好的线性关系,可以用来检测样品中的麦角固醇含量。
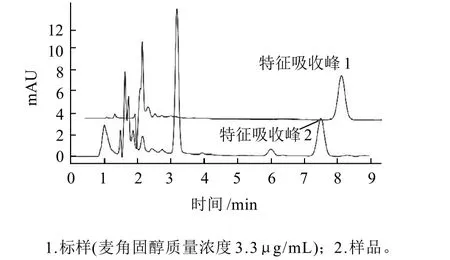
图1 麦角固醇标样及样品分离色谱图Fig.1 Chromatographs of ergosterol standard and samples
2.2 基础发酵实验结果
以PDB培养基为基础发酵培养基,发酵3d收集1 00mL液体培养中菌体,测得麦角固醇的产量为1656.35μg/100mL。
2.3 添加不同碳源对麦角固醇产量的影响
在基础发酵培养基础上选择添加葡萄糖、乳糖、蔗糖为补充碳源,结果见图2。上述3种碳源都有利于米根霉菌体产麦角固醇量提高,当添加葡萄糖作为补充碳源时,麦角固醇产量最高,菌体产3150.29μg/100mL麦角固醇,因此,后续选择葡萄糖为最佳添加碳源。
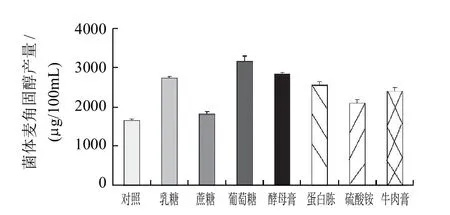
图2 不同碳源及氮源对米根霉菌体麦角固醇产量的影响Fig.2 Effects of carbon and nitrogen source types on ergosterol production
2.4 添加不同葡萄糖质量浓度对麦角固醇产量的影响

图3 不同质量浓度葡萄糖对米根霉菌体麦角固醇产量的影响Fig.3 Effect of glucose concentration on ergosterol production
如图3所示,随葡萄糖质量浓度升高,菌体干细胞中麦角固醇的产量逐渐升高。当葡萄糖质量浓度为4g/L时,菌体中所产的麦角固醇接近最大值4331.62μg/100mL,之后有降低趋势,表明麦角固醇在菌体中富集到一定程度,原因可能是在麦角固醇产生合成过程中,羟甲基戊二酰辅酶A(HMG-CoA)还原酶的作用受到抑制[11],此外,也与菌体中葡萄糖分解代谢相关的酶趋于饱和不再结合底物有关。
2.5 添加不同氮源对麦角固醇产量的影响
如图2所示,添加不同氮源对菌体中产生麦角固醇的产量影响也较为明显。在基础液体培养中添加4种氮源中,酵母膏最有利于菌体产生麦角固醇,其产量可达2828.1μg/100mL。因此,基础培养中添加酵母膏为最佳氮源。
2.6 添加不同质量浓度酵母膏对麦角固醇产量的影响
液体发酵培养中添加不同质量浓度酵母膏后,结果如图4所示,随着酵母膏质量浓度的增加,菌体中麦角固醇的产量随之增高。当添加酵母膏质量浓度至4g/L时,达到峰值(4124.36μg/100mL),之后,麦角固醇的产量随之降低。此现象可能与麦角固醇的产生受抑制有关,表明添加适当质量浓度的酵母膏有利于米根霉菌体发酵产麦角固醇。
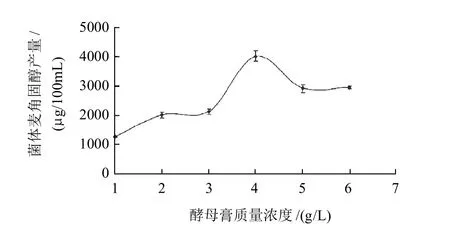
图4 不同质量浓度酵母膏对米根霉菌体麦角固醇产量的影响Fig.4 Effect of yeast extract concentration on ergosterol production
2.7 发酵时间对米根霉产麦角固醇的影响

图5 不同发酵时间对米根霉菌体麦角固醇产量的影响Fig.5 Effect of fermentation time on ergosterol production
从图5可以看出,随着发酵时间的延长,麦角固醇的产量逐渐增加,当发酵时间达到9d后,菌体麦角固醇产量出现峰值(4337.62μg/100mL),之后,随着培养时间延长,麦角固醇的产量降低明显。这与发酵过程中随着培养基中菌体生物量的不断增加,营养物质消耗得不到补充或某种营养物质缺乏造成营养不均衡时,菌体发生自溶有关。因此,米根霉产麦角固醇较佳发酵时间为9d左右。
2.8 响应面优化发酵条件结果
根据表2,利用Design Expert软件对试验结果进行二次多元回归拟合,得到麦角固醇产量对自变量A、B和C的二次多项回归方程为:Y=4717.4-428.8A+544.6B-45.4C-84.8AB-515.5AC-314.4BC+68.6A2+72.3B2-110.9C2。
为了使方程具有更好的拟合性,根据Sampaio等[12]采用的方法,除去方程中的AB、A2和B2项,得到优化的二次回归方程为:Y=4794.9-428.8A+544.6B-45.4C-515.5AC-314.4BC-121.0C2。
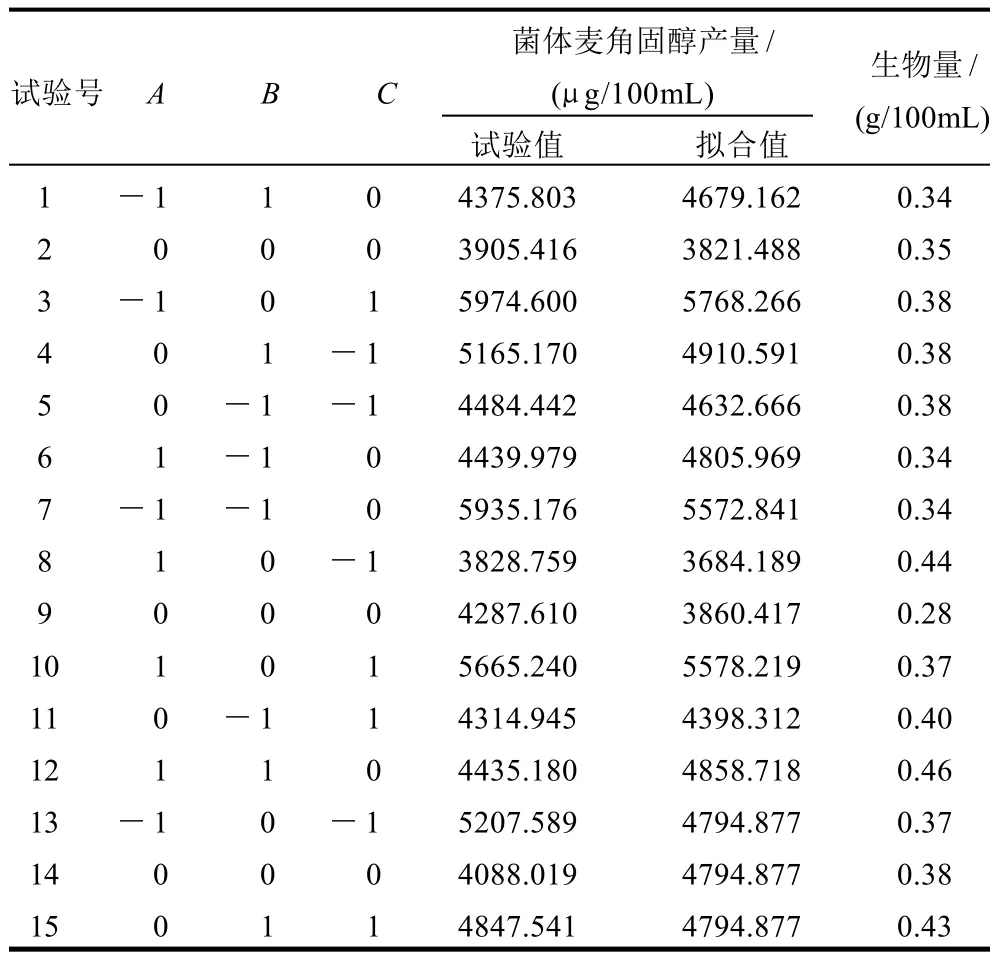
表2 Box-Behnken试验设计及结果Table 2 Box-Behnken experimental design and results

表3 响应面二次模型的方差分析Table 3 Variance analysis for the results of Box-Behnken experimental design
由表3可知,模型的F值为4.58,表明该模型显著(P<0.05),失拟项P=0.8027,表明由误差引起的失拟不显著。模型的决定系数为0.8746,说明方程的因变量与全体自变量间线性关系明显;模型的变异系数值为6.9,说明模型的精密度较好,具有足够的信号来用于响应该设计。综合以上各参数表明该试验方法可靠,各因素水平间设计合理,因此可用该回归模型代替实验真实点对实验结果进行分析预测。回归模型各项的方差分析结果还表明,A、AC项为显著项,B项为极显著项(P<0.01),其余项均不显著。
2.9 优化发酵条件的确定及验证
以表2结果对培养基中菌体生物量与菌体产麦角固醇量之间进行相关性分析,发现其并不存在直接的相关性,菌体生长中麦角固醇生物合成的特定抑制剂浓度以及其他与麦角固醇反应的成分,温度、pH值都可能影响真菌的液态新陈代谢,并且可能影响真菌细胞膜中麦角固醇浓度[13]。因此,米根霉液体发酵产麦角固醇最佳工艺条件优化在本试验设计中不考虑菌体生物量。
由优化后的二次回归模型可得到等高线图和三维响应面图(图6),在图中横坐标分别为发酵时间与碳源质量浓度(葡萄糖)两个变量,另一变量酵母膏质量浓度(图中未表示)已处于当麦角固醇产量最高时的最佳值(5g/L)。二次回归模型计算结果表明在本试验设定的变量范围内,100mL液体培养基中的菌体最高可产麦角固醇量为5818.39μg。此时最优化的各项自变量分别为:3g/L葡萄糖、5g/L酵母膏、发酵培养时间9.64d。依此条件进行根霉菌液体发酵重复培养得到菌体麦角固醇平均产量5761.83μg/100mL,菌体平均生物量0.36g,麦角固醇平均达菌体干细胞质量的1.60%左右,与模型预测值(5818.39μg/100mL)接近,反映了本响应曲面模型的可靠性。

图6 葡萄糖质量浓度与发酵时间交互作用对米根霉液体发酵产麦角固醇影响的响应面和等高线图Fig.6 Response surface and contour plots showing the effects of fermentation time and glucose concentration on ergosterol production
3 结 论
3.1 采用响应面分析法对米根霉产麦角固醇条件进行了初步优化,在PDB为液态发酵基础培养基,28℃、孢子液接种量2%、振荡培养3d条件下,100mL发酵培养液平均产麦角固醇1656.35μg;液态发酵的优化条件为:基础培养基中添加3g/L葡萄糖、酵母膏5g/L、发酵培养9.64d,麦角固醇产量较优化前提高了247.86%,平均可达5761.83μg/100mL,约为菌体干细胞质量的1.60%,与构建模型的预测值(5818.39μg/100mL)接近,说明响应面模型可很好地应用于米根霉产麦角固醇的发酵条件优化。
3.2 本实验结果提示根霉菌是一株优良的麦角固醇产生菌,但由于菌体生长的条件与麦角固醇合成的条件不一致,未能考虑菌体生长对产麦角固醇的影响。因此,通过对菌体生长及麦角固醇合成的其他条件,如温度、pH值、微量元素等进行优化培养,并进行工程菌诱导方面的研究,将更有利于提高米根霉菌产麦角固醇的能力,为工业开发应用微生物生产麦角固醇具有重要意义。
[1] TAN Tianwei, ZHANG Mu, HUA Gao. Ergosterol production by fedbatch fermentation ofSaccharomyces cerevisiae[J]. Enzyme and Microbial Technology, 2003, 33(4): 366-370.
[2] 蒋海波, 王纪, 姚建铭, 等. 离子注入麦角甾醇酵母选育研究[J]. 工业微生物, 2000, 30(2): l-3.
[3] 杨婉身, 梁如玉. 麦角固醇高产酵母菌的快速筛选方法[J]. 四川农业大学学报, 1997, 15(3): 304-306.
[4] 许旭萍, 李惠珍, 余晨兴, 等. 麦角固醇产生菌Torullopsis famata优化发酵条件的研究[J]. 生物学杂志, 2002, 18(2): 15-17.
[5] 何秀萍, 张博润. 微生物麦角固醇的研究进展[J]. 微生物学通报,1998, 25(3): 166-169.
[6] 朱效刚, 许赣荣, 李颖茵. 红曲菌固态发酵产麦角甾醇工艺条件的优化[J]. 食品研究与开发, 2005, 26(2): 72-74.
[7] 陈松生, 毛宁, 陈哲超, 等. 红曲霉的麦角固醇研究[J]. 食品与发酵工业, 1995(6): 18-21.
[8] 宁玮霁, 谭艾娟, 刘爱英, 等. 红曲霉产麦角固醇液体培养基筛选[J].山地农业生物学报, 2008, 27(3): 241-246.
[9] 李国友, 李伯刚, 刘光晔, 等. 根霉3078的代谢产物的研究[J]. 天然产物研究与开发, 2004, 16(4): 277-280.
[10] 宁玮霁. 红曲霉液态发酵法高产麦角固醇的研究[D]. 贵阳: 贵州大学, 2008.
[11] 李文全, 五子花, 申瑞玲. HMG-CoA还原酶的结构和调节[J]. 动物医学进展, 2006, 27(2): 38-40.
[12] SAMPAIO F C, FAVERI D D, MANTOVANI H C, et al. Use of response surface methodology for optimization of xylitol production by the new yeast strainDebaryomyces hanseniiUFV-70[J]. Journal of Food Engineering, 2006, 76: 376-386.
[13] MARK O, GESSNERERIC C. Ergosterol-to-biomass conversion factors for aquatic hyphomycetes[J]. Applied and Environmental Microbiology, 1993, 59(2): 502-507.
Application of Response Surface Methodology for Optimization of Liquid-State Fermentation Process for Ergosterol Production byRhizopus oryzae
WANG Cai-sheng,WANG Le-yi,GAO You-ling*,TAN Zhi-wen,YANG Zhen-feng
(College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315100, China)
In order to maximize intracellular ergosterol production inRhizopus oryzaein liquid-state fermentation, nitrogen and carbon sources and fermentation time were optimized using response surface methodology. Ergosterol was determined by HPLC and the fermentation medium used was based on PDB liquid medium. The effects of carbon and nitrogen source types on ergosterol production were examined. One-factor-at-a-time experiments were conducted to analyze the effects of yeast extract,glucose and fermentation on ergosterol production. The optimum carbon and nitrogen sources were found to be glucose and yeast extract, respectively. The optimum fermentation process was achieved after 9.64 d of culture in a modified PDB liquid medium containing 3 g/L glucose and 5 g/L yeast extract. Under these conditions, the average ergosterol production was 5761.83μg /100 mL of fermentation broth, which was in agreement with the predicted value (5.818.39μg /100 mL of fermentation broth) from the model established and 247.86% higher than before the optimization. Moreover, the ratio of ergosterol to dry cell was 1.60%(100 mL liquid culture medium).
Rhizopus oryzaeZW017;ergosterol;response surface methodology
Q815;Q939.9
A
1002-6630(2012)05-0229-05
2011-02-24
浙江省科技厅重大科技专项(2009C12239);宁波市科技局农业科技攻关项目(2006C100093)
汪财生(1969—),男,高级实验师,研究方向为活性物质提取与开发。E-mail:wangcaisheng@zwu.edu.cn
*通信作者:高有领(1978—),男,讲师,博士,研究方向为发酵工程和活性物质开发。E-mail:gaoyol@gmail.com

