海带岩藻聚糖硫酸酯对小鼠的免疫调节作用
李 芳,李八方,王景峰,张 晶,李 尧,赵 雪*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
海带岩藻聚糖硫酸酯对小鼠的免疫调节作用
李 芳,李八方,王景峰,张 晶,李 尧,赵 雪*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
目的:采用免疫学评价方法,研究海带岩藻聚糖硫酸酯对小鼠免疫功能的调节作用。方法:以海带粗多糖为原料,采用酸提取、离子交换和自由基氧化降解法制备得到不同的岩藻聚糖硫酸酯组分。KM小鼠随机分为正常对照组、模型对照组、阳性对照组和海带岩藻聚糖硫酸酯组分F-2、Fa和Fb的低、中、高剂量组。除正常组外,其余皮下注射氢化可的松造成免疫低下模型后灌胃。海带岩藻聚糖硫酸酯F-2、Fa和Fb组小鼠分别灌胃F-2、Fa和Fb不同剂量多糖溶液(分别为25、50、100mg/(kg·d)),阳性对照组灌胃盐酸左旋咪唑(20mg/(kg·d)),进行免疫指标的测定。结果:F-2、Fa和Fb组均能显著提高免疫低下小鼠的脾脏质量/体质量比值,提高血清溶血素含量和提高腹腔巨噬细胞吞噬鸡红细胞能力,且F-2和Fa组能增强迟发型变态反应能力,但Fb组对迟发型变态反应能力无显著性影响。结论:海带岩藻聚糖硫酸酯对免疫低下小鼠具有较好的免疫调节作用,且中、低分子质量的岩藻聚糖硫酸酯对免疫低下小鼠的免疫调节作用没有显著性差异。
海带岩藻聚糖硫酸酯;免疫低下小鼠;免疫调节
岩藻聚糖硫酸酯是一种来源于海洋藻类、海洋无脊椎动物和被囊动物中富含岩藻糖的硫酸多糖,具有抗病毒、抗凝血、抗血栓、抗肿瘤等生物活性[1-3]。研究发现,海带硫酸多糖可增强正常小鼠和免疫低下小鼠的免疫功能,具有体外促进淋巴细胞增殖和亚群分化的作用,其免疫调节作用对艾滋病患者的免疫重建具有重要的作用[4-7],而且海带硫酸多糖对小鼠肉瘤S180的抑制活性可能与其对巨噬细胞的激活有关[8]。但是目前的研究大多是高分子质量的岩藻聚糖硫酸酯的免疫调节活性。
本实验采用酸提取和自由基氧化降解制备中分子质量和低分子质量的海带岩藻聚糖硫酸酯,比较不同分子质量的岩藻聚糖硫酸酯对小鼠免疫功能的影响,为相对低分子质量岩藻聚糖硫酸酯在免疫调节方面的开发应用提供参考。
1 材料与方法
1.1 材料与试剂
岩藻聚糖硫酸酯(fucoidan)粗多糖 日照洁晶海洋生物技术有限公司。
1-苯基-3-甲基-5-吡唑啉酮(PMP)(分析纯)、D-甘露糖、D-葡萄糖 上海化学试剂公司;右旋糖酐分子质量标准品(180、2.5、4.6、7.1、10kD) 中国药品生物制品检定所;D-(+)-氨基葡萄糖(GlcN)、D-葡萄糖醛酸(GlcUA) 美国Fluka公司;L-鼠李糖、D-半乳糖、乳糖、D-木糖和L-岩藻糖 美国Sigma公司;氢化可的松 西安利君制药有限责任公司;盐酸左旋咪唑 山东省仁和堂药业有限公司。
1.2 实验动物与细胞
健康KM小鼠,雌性,体质量18~22g,SPF级,购自青岛市药品检验所,动物合格证号:SCXK(鲁)20090007;健康豚鼠,雌性,体质量350~400g,购自青岛市药品检验所,动物合格证号:S C X K(鲁)20090009,抽取心脏血,分离血清,经压积绵羊红细胞吸收后,作为本实验的补体来源;绵羊红细胞(sheep red blood cell,SRBC),由济南百博生物技术有限责任公司提供无菌脱纤维羊血,按常规方法制备SRBC悬液[9];鸡红细胞(chicken red blood cell,CRBC),市售公鸡,抽取鸡翼静脉血,按常规方法制备CRBC悬液。
1.3 仪器与设备
中空纤维超滤膜(截留分子质量10kD和6kD) 天津膜天膜工程技术有限公司;超滤膜(2.5kD和300D) 美国GE公司;Agilent 1100 高效液相色谱仪 美国Agilent公司;HPG-32OH人工气候培养箱 哈尔滨市东联电子技术开发有限公司;XSE-4G生物显微镜 美国Sigma公司;游标卡尺(精度为0.01mm) 海信威量量具有限公司;Q-Sepharose FF 阴离子交换色谱柱分离 Amersham Pharmacia Biotech公司;ICS-2000离子色谱系统 美国Dionex公司;TSK-gel G3000 PWxl 色谱柱、TSK-gel G2500 PWxl 日本Tosoh Bioscience公司。
1.4 方法
1.4.1 中分子质量海带岩藻聚糖硫酸酯的制备
岩藻聚糖硫酸酯粗多糖采用 Q-Sepharose FF阴离子交换色谱柱分离,分别用0、0.5、1、2.5mol/L NaCl溶液分步洗脱,收集2.5mol/L NaCl溶液洗脱得到的高硫组分F-2,用截留分子质量为10kD的中空纤维超滤膜超滤脱盐,浓缩冻干。
1.4.2 低分子质量海带岩藻聚糖硫酸酯的制备
取4.5g的岩藻聚糖硫酸酯粗多糖溶于水,配制成100mg/mL溶液,然后加入Cu(AC)2·H2O至Cu2+浓度为0.0267mol/L,调pH值至7.5左右。水浴加热至溶液温度为60℃,然后以12mL/h的速度加入4.5% H2O2溶液。降解5h后,停止加入H2O2,选用截留分子质量为10、6kD和2.5kD的超滤膜分离降解产物,得到两个低分子质量组分Fa(6~10kD)、Fb(2.5~6kD),然后分别浓缩冻干[10]。
1.4.3 分子质量的测定
采用高效液相色谱法[11],中分子质量岩藻聚糖硫酸酯采用TSK-gel G3000 PWxl 色谱柱分析;低分子质量组分采用TSK-gel G2500 PWxl 色谱柱分析。采用Agillent GPC软件计算各洗脱峰的重均分子质量(Mw)、数均分子质量(Mn)以及多分散系数D=Mw/Mn。
1.4.4 硫酸根含量测定
采用离子色谱法[12],选用ICS-2000 离子色谱系统,用Ionpac AS11-HC(4mm×250mm)色谱柱测定。
1.4.5 单糖组成测定
采用柱前衍生高效液相色谱法[13-14],并按照参考文献[15]制备各组分的单糖衍生物,选用ZORBAX Eclipse XDB-C18分离柱(4.6mm×250mm,5μm)进行分析。
1.4.6 动物分组及实验
KM小鼠,随机分为正常对照组、模型对照组、阳性对照组和海带岩藻聚糖硫酸酯组分F-2、Fa和Fb的低、中、高剂量组,每组10只,组间平均体质量相近。小鼠分别灌胃不同剂量的海带岩藻聚糖硫酸酯溶液(分别为25、50、100mg/(kg·d)),阳性对照组灌胃盐酸左旋咪唑(20mg/(kg·d)),正常对照组和模型对照组灌胃生理盐水,灌胃剂量为0.01mL/(g·d),所有组均连续灌胃28d。除正常对照组外,其余各组均于首次给药后第21天皮下注射氢化可的松15mg/(kg·d),连续注射6d,正常小鼠皮下注射等量生理盐水。于末次给药后,禁食不禁水12h后,进行各免疫指标的测定[16]。
1.4.7 胸腺质量/体质量、脾质量/体质量比值测定
KM小鼠于末次给药后,禁食不禁水12h,分别称其质量,脱颈椎处死,剥离脾脏称其质量并计算脾脏质量/体质量和胸腺质量/体质量比值测定。
1.4.8 血清溶血素抗体生成测定
KM小鼠于首次给药后第23天,每只腹腔注射0.2mL体积分数10%的SRBC致敏。于末次给药后12h,摘眼球收集血液。分离血清,按体积比1:200生理盐水稀释。按文献[17]方法测定小鼠血清溶血素含量,计算半数溶血值(HC50)。
1.4.9 迟发型变态反应测定
KM小鼠致敏方法同1.4.8节。于末次给药后在测量部位足垫用20μL体积分数20%的SRBC再次攻击左后足趾,24h后脱颈椎处死,分别剪下左后足与右后足,同时测量左后足与右后足质量,并计算攻击前后左后足与右后足质量的差值[18]。
1.4.10 腹腔巨噬细胞吞噬能力测定
KM小鼠于末次给药后12h,每鼠腹腔注射1mL 2%鸡红细胞悬液,30min后脱颈椎处死。小鼠腹腔巨噬细胞的收集、染色和计数参见文献[19]方法。
1.4.11 统计学处理
采用SPSS11.0软件进行单因素方差分析,进行Least-Significant Difference(LSD)比较,P<0.05为差异显著。
2 结果与分析
2.1 岩藻聚糖硫酸酯化学性质的比较

图1 低分子质量组分Fa和Fb的分子质量测定曲线Fig.1 HPLC chromatograms of fucoidan fractions (Fa and Fb) with low weights

表1 岩藻聚糖硫酸酯各组分的分子质量和硫酸根含量的比较Table 1 Comparison of molecular weights and sulfated ester contents of different fucoidan fractions
如图1、表1所示采用酸提取法可以将高分子质量的岩藻聚糖硫酸酯(200kD)降解,得到的高硫中分子质量岩藻聚糖硫酸酯组分F-2分子质量为35kD,多分散系数较大,说明其为多个组分的混合物。F-2主要含有岩藻糖(46.20%)、甘露糖(19.75%)和半乳糖(12.36%),还含有一定量的鼠李糖、木糖和D-葡萄糖醛酸。而岩藻聚糖硫酸酯粗多糖经自由基氧化降解后,得到的重均分子质量为7.68kD组分(Fa组分)在高效液相色谱分析中呈单一对称峰,且分布范围较窄,组分较纯(图1),主要由岩藻糖组成,达到64.25%,其次是半乳糖含量上升到30.74%(表2),岩藻糖和半乳糖占总单糖组成的94.99%,而甘露糖、鼠李糖和葡萄糖含量很低。而3.89kD的组分主要由重均分子质量为6.52kD和4.73kD的两个组分组成,采用TSK2500色谱柱也无法分离,其硫酸根含量最高,达到32.48%,主要由岩藻糖(46.94%)和半乳糖(37.35%)组成,岩藻糖含量明显低于7.68kD的组分。
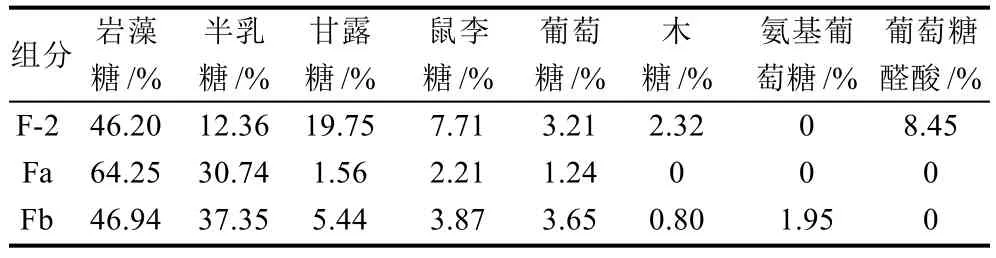
表2 岩藻聚糖硫酸酯各组分组成单糖的物质的量比例Table 2 Comparison of molar proportion of monosacchrides in different fucoidan fractions
2.2 岩藻聚糖硫酸酯对小鼠脾质量/体质量和胸腺质量/体质量比值的影响
由表3可见,注射氢化可的松后,小鼠脾质量/体质量和胸腺质量/体质量比值均明显降低。与模型对照组比较,灌胃50mg/kg和100mg/kg的 Fb组分可以显著提高小鼠脾脏质量/体质量比值(P<0.05),而灌胃100mg/kg 的F-2和Fa组分均能显著提高小鼠脾脏质量/体质量比值(P<0.01,P<0.05)。但是F-2、Fa和Fb各剂量组对胸腺质量/体质量比值均无显著性影响(P>0.05)。
2.3 对小鼠血清溶血素水平的影响
由表3可见,与模型对照组相比,F-2组分可显著提高免疫低下小鼠血清溶血素含量,灌胃50mg/kg和100mg/kg F-2组分,其半数溶血值分别提高了17.37%和23.02%。Fa(100mg/kg)和Fb(50mg/kg)组分也能显著提高小鼠半数溶血值,与模型组比较半数溶血值分别提高了23.27%和14.53%。但是不同分子质量的岩藻聚糖硫酸酯组分之间没有显著性差异。
2.4 对小鼠迟发型变态反应的影响
由表3可见,与模型对照组相比,F-2和Fa组分均分别灌胃50mg/kg和100mg/kg岩藻聚糖硫酸酯均能显著增强小鼠的迟发型变态反应能力(P<0.05,P<0.01),分别提高了35.25%、28.81%、32.72%和48.48%。而分子质量为3.89kD组分Fb各剂量组对小鼠迟发型变态反应均无显著性影响。
表3 不同海带岩藻聚糖硫酸酯组分对免疫低下模型小鼠免疫功能的影响(±s,n=10)Table 3 Effects of fucoidan fractions on immune function of immunodepression mice (±s,n = 10)
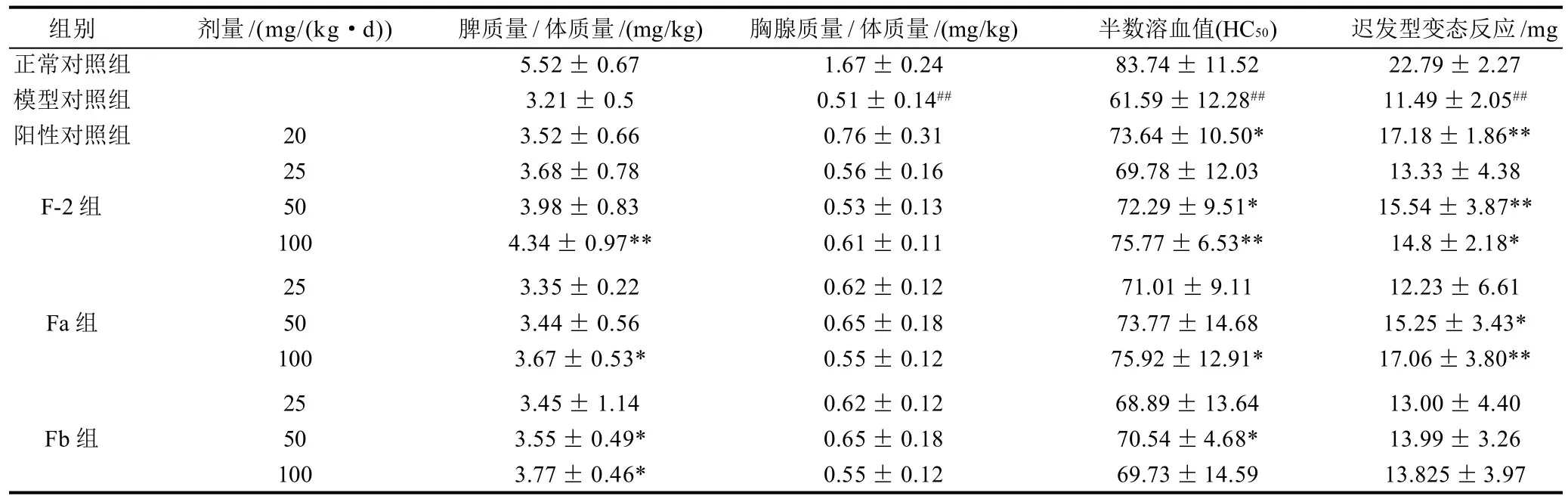
表3 不同海带岩藻聚糖硫酸酯组分对免疫低下模型小鼠免疫功能的影响(±s,n=10)Table 3 Effects of fucoidan fractions on immune function of immunodepression mice (±s,n = 10)
注: ##.与正常对照组相比较,有极显著差异(P<0.01);*.与模型对照组相比较,有显著性差异(P<0.05);**.与模型对照组相比较,有极显著性差异(P<0.01)。下同。
组别 剂量/(mg/(kg·d)) 脾质量/体质量/(mg/kg) 胸腺质量/体质量/(mg/kg) 半数溶血值(HC50) 迟发型变态反应/mg正常对照组 5.52± 0.67 1.67± 0.24 83.74± 11.52 22.79± 2.27模型对照组 3.21± 0.5 0.51± 0.14## 61.59±12.28## 11.49±2.05##阳性对照组 20 3.52± 0.66 0.76± 0.31 73.64± 10.50* 17.18±1.86**25 3.68± 0.78 0.56± 0.16 69.78± 12.03 13.33± 4.38 F-2组 50 3.98± 0.83 0.53± 0.13 72.29±9.51* 15.54± 3.87**100 4.34± 0.97** 0.61± 0.11 75.77±6.53** 14.8±2.18*25 3.35± 0.22 0.62± 0.12 71.01± 9.11 12.23± 6.61 Fa组 50 3.44± 0.56 0.65± 0.18 73.77±14.68 15.25± 3.43*100 3.67± 0.53* 0.55± 0.12 75.92±12.91* 17.06±3.80**25 3.45± 1.14 0.62± 0.12 68.89± 13.64 13.00± 4.40 Fb组 50 3.55± 0.49* 0.65± 0.18 70.54±4.68* 13.99± 3.26 100 3.77± 0.46* 0.55± 0.12 69.73±14.59 13.825±3.97
2.5 对小鼠腹腔巨噬细胞吞噬功能的影响
表4 不同海带岩藻聚糖硫酸酯组分对免疫低下小鼠巨噬细胞吞噬能力的影响(±s,n=10)Table 4 Effects of fucoidan fractions on phagocytic functions of immunodepressed mice (±s,n = 10)
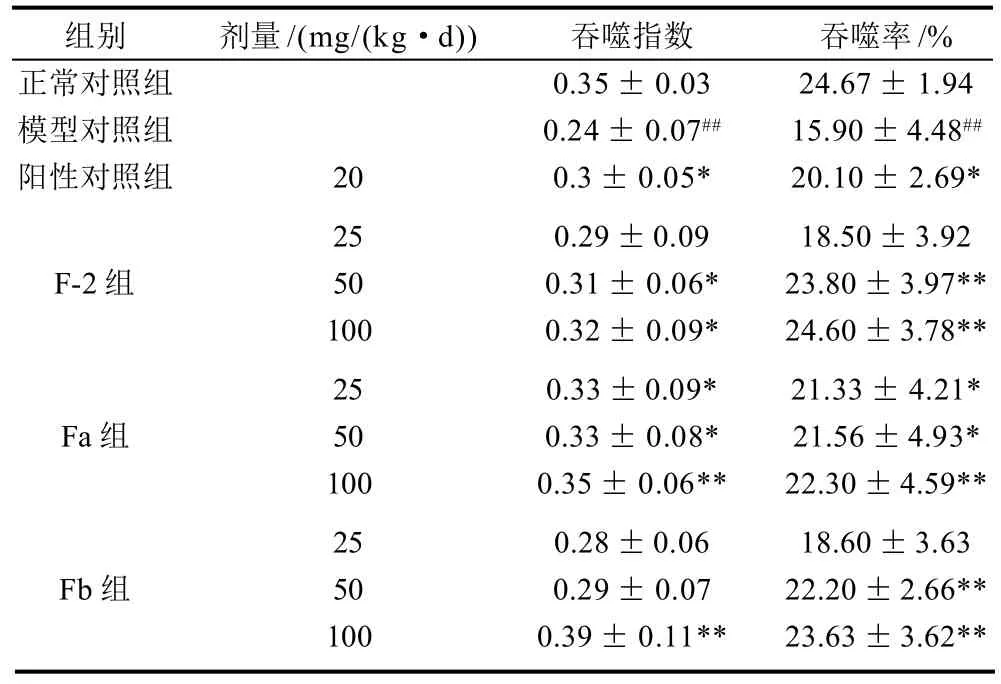
表4 不同海带岩藻聚糖硫酸酯组分对免疫低下小鼠巨噬细胞吞噬能力的影响(±s,n=10)Table 4 Effects of fucoidan fractions on phagocytic functions of immunodepressed mice (±s,n = 10)
组别 剂量/(mg/(kg·d)) 吞噬指数 吞噬率/%正常对照组 0.35± 0.03 24.67± 1.94模型对照组 0.24± 0.07## 15.90±4.48##阳性对照组 20 0.3± 0.05* 20.10± 2.69*25 0.29±0.09 18.50±3.92 F-2组 50 0.31± 0.06* 23.80±3.97**100 0.32± 0.09* 24.60±3.78**25 0.33±0.09* 21.33± 4.21*Fa组 50 0.33± 0.08* 21.56±4.93*100 0.35± 0.06** 22.30±4.59**25 0.28±0.06 18.60±3.63 Fb组 50 0.29± 0.07 22.20±2.66**100 0.39± 0.11** 23.63±3.62**
从表4可以看出,F-2及自由基氧化得到的低分子质量组分Fa和Fb均能够显著提高免疫低下小鼠的腹腔巨噬细胞吞噬鸡红细胞的能力(P<0.05,P<0.01)。其中F-2(50mg/kg和100mg/kg)、Fa(50mg/kg和100mg/kg)和Fb(100mg/kg)均可以显著提高腹腔巨噬细胞吞噬鸡红细胞的吞噬率和吞噬指数。
3 讨论与结论
大量研究表明,多糖及其衍生物具有很好的免疫调节作用,而对正常细胞没有毒性,属于具有较强的丝裂原样活性的生物反应调节剂[20]。海带多糖是一种主要由岩藻糖、半乳糖和甘露糖组成的杂多糖,还含有较高的硫酸根。高分子质量的岩藻聚糖硫酸酯由于分子质量大,结构复杂,难于研究其活性原理和构效关系。而且高分子质量岩藻糖水溶性差,大量服用会明显延长凝血时间[21]。
本研究采用实验室制备的中分子质量和低分子质量的岩藻聚糖硫酸酯组分,观察了岩藻聚糖硫酸酯在体内对氢化可的松所致免疫低下小鼠的作用,发现岩藻聚糖硫酸酯可以显著增强脾脏的发育,提高小鼠的体液免疫机能如血清溶血素和迟发型变态反应,促进细胞免疫机能如腹腔巨噬细胞吞噬能力。对溶血素的产生和腹腔巨噬细胞吞噬能力的恢复,证明它是一种对T细胞和巨噬细胞有直接作用的免疫调节剂。目前一般认为,免疫活性的增强与肿瘤和病毒免疫监控有密切的关系,岩藻聚糖硫酸酯促进的免疫活性有益于人们进一步研究药物对肿瘤免疫和病毒免疫的作用。
本实验比较发现,灌胃不同的分子质量、硫酸根含量和单糖组成的岩藻聚糖硫酸酯在提高免疫低下小鼠的免疫功能方面没有显著性差异。经自由基氧化降解得到的低分子质量的岩藻聚糖硫酸酯仍然具有较好的免疫活性,而且易于吸收,食用安全,结构简单,为以后研究岩藻聚糖硫酸酯活性的构效关系提供参考。
[1] 林洪, 江洁, 薛长湖, 等. 褐藻岩藻聚糖结构和活性研究进展[J]. 中国海洋药物, 2002(6): 42-47.
[2] POMIN V H, PAULO A S M. Structure, biology, evolution and medical importance of sulfated fucans and galactans[J]. Glycobiology, 2008, 18(12): 1016-1027.
[3] BERTEAU O, MULLOY B. Sulfated fucans, fresh perspectives: structures,functions and biological properties of sulfated fucans and an overview of enzymes active toward this class of polysaccharide[J]. Glycobiology,2003, 13(6): 29-40.
[4] 刘治东, 王静凤, 王玉明, 等. 鱿鱼墨黏多糖对小鼠免疫调节作用的研究[J]. 中国海洋大学学报: 自然科学版, 2009(9): 147-150.
[5] 王文涛, 周金黄, 邢善田, 等. 海藻硫酸多糖对正常及免疫低下小鼠的免疫调节作用[J]. 中国药理学及毒理学杂志, 1994, 8(3): 199-202.
[6] CLOYD M W, CHEN J J Y, WANG Liqiang. How does HIV cause AIDS ? The homing theory[J]. Mol Med Today, 2000, 6(3): 108-111.
[7] 钱宗玲. 艾滋病药物最新研究进展[J] . 中国新药杂志,1997, 6(6): 407-409.
[8] 宋剑秋, 徐誉泰, 张华坤, 等. 海带硫酸多糖对小鼠腹腔巨噬细胞的免疫调节作用[J]. 中国免疫学杂志, 2000, 16(2): 70.
[9] 边棣. 去氢骆驼蓬碱对小鼠免疫功能的影响[J]. 中国药理学报, 1987,8(5): 477-478.
[10] NARDELLA A, CHAUBET F, VIDAL C B, et al. Anticoagulant low molecular weight fucans produced by radical process and ion exchange chromatography of high molecular weight fucans extracted from the brown seaweedAscophyllum nodosum[J]. Carbohydr Res, 1996, 289:201-208.
[11] 魏远安, 方积年. 高效凝胶渗透色谱法测定多糖纯度及分子量[J]. 药学学报, 1989, 24(7): 532-536.
[12] 尹利昂, 陈士国, 薛长湖, 等. 四种海参中含岩藻糖支链的硫酸软骨素化学组成差异的分析[J]. 中国海洋大学学报: 自然科学版, 2009,39(9): 63-68.
[13] FU D, ONEILL R A. Monosaccharide composition analysis of oligosaccharides and glycoproteins by high-performance liquid chromatography[J]. Anal Biochem, 1995, 227(2): 377-384.
[14] STRYDOM D J. Chromatographic separation of 1-phenyl-3-methyl-5-pyrazolone -derivatized neutral, acidic and basic aldoses[J]. J Chromatogr A, 1994, 678(11): 17-23.
[15] YUTAKA K, SHUGO W, MAMORU K, et al. Structure of fucose branches in the glycosaminogly can from the body wall of the sea cucumberStichopus japonicus[J]. Carbohydrate Res, 1997, 297(39):273-279.
[16] 卫生部卫生法制与监督司. 保健食品检测与评价技术规范(2003年版) [S]. 北京: 人民卫生出版社, 2003: 27-29.
[17] MIYAKE M, TAKI T, HITOMI S, et al. Correlation of expression of H/Ley/Leb antigens with survival in patients with carcinoma of the lung[J].New Engl J Med, 1996, 327(1): 14-18.
[18] 王静凤, 王奕, 赵林, 等. 日本刺参的抗肿瘤及免疫调节作用研究[J].中国海洋大学学报: 自然科学版, 2007, 37(1): 93-96.
[19] 王静凤, 胡京滨, 李立德. 海脉冲营养素(HMC)研究: HMC对小鼠免疫功能的影响[J]. 青岛海洋大学学报, 1997, 27(4): 521-526.
[20] 田庚元, 冯宇澄. 多糖类免疫调节剂的研究和应用[J]. 化学进展,1994, 6(2): 114-124.
[21] LI Ning, ZHANG Quanbin, SONG Jinming. Toxicological evaluation of fucoidan extracted fromLaminaria japonicain Wistar rats[J]. Food and Chemical Toxicology, 2005, 43(3): 421-426.
Immunomodulatory Effect of Fucoidan fromLaminaria japonicain Mice
LI Fang,LI Ba-fang,WANG Jing-feng,ZHANG Jing,LI Yao,ZHAO Xue*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Objective: To investigate the effect of fucoidan fromLaminaria japonicaon immune regulation in immunodepressed mice by oral administration. Methods: In this study, different fucoidan fractions were obtained by acid hydrolysis, anion exchange chromatography on Q-Sepharose FF and free radical oxygen degradation and ultrafiltration technology from high molecular weight fucoidan extracted fromLaminaria japonica. The fractions with higher sulfate ester and fucose content on immune regulation were selected by chemical analysis. KM mice were randomly divided into twelve groups: normal control group, model control group, positive group, low dosage (25 mg/(kg·d)), medium dosage (50 mg/(kg·d)) and high dosage (100 mg/(kg·d)) groups of F-2, Fa and Fb fractions, respectively. The immune regulation was investigated by using the model mice in normal and in immunodepression induced by hydrocortisone. Results: The effect on immune function of mice administered with different fucoidan fractions fromLaminaria japonicadid not reveal significant difference. All F-2, Fa and Fb could antagonize the decline of spleen/body weight induced by hydrocortisone, increase hemolysin content (HC50), and promote the ability of macrophages for celiac macrophage. Meanwhile, both F-2 and Fa could improve delayed hypersensitivity level, while Fb had no significant effect on delayed hypersensitivity level. Conclusion: Fucoidan fraction had an excellent effect on immune regulation in immunodepressed mice. However, these fractions did not reveal significant difference in the effect on immune function of mice.
fucoidan;immunodepressed mice;immune regulation
Q946.3;TS218
A
1002-6630(2012)05-0238-05
2011-04-19
国家自然科学基金项目(30800858);山东省自然科学基金项目(ZR2010CQ020)
李芳(1986—),女,硕士研究生,研究方向为海洋生物活性物质。E-mail:lifang8626616@126.com
*通信作者:赵雪(1976—),女,讲师,博士,研究方向为海洋活性物质。E-mail:zhaoxue@ouc.edu.cn

