氧化应激在糖尿病大鼠胃动力变化中的意义*
金启辉, 管文花, 王 辉, 朱延涛, 陈怀红, 娄域峰, 陈 瑛
(浙江大学医学院附属第二医院 1老年病科, 5干部保健科, 浙江 杭州 310009;浙江大学医学院附属第一医院2血液科, 4检验科,浙江 杭州 310003; 3浙江中医药大学科研处, 浙江 杭州 310035)
1000-4718(2012)12-2238-06
2012-04-28
2012-10-16
浙江省卫生厅项目(No.N20100767);浙江省中医药科技计划项目(No.2010ZB076)
△通讯作者 Tel:0571-87783703;E-mail:z2chengying@126.com
氧化应激在糖尿病大鼠胃动力变化中的意义*
金启辉1, 管文花2, 王 辉3, 朱延涛3, 陈怀红1, 娄域峰4, 陈 瑛5△
(浙江大学医学院附属第二医院1老年病科,5干部保健科, 浙江 杭州 310009;浙江大学医学院附属第一医院2血液科,4检验科,浙江 杭州 310003;3浙江中医药大学科研处, 浙江 杭州 310035)
目的观察糖尿病大鼠胃组织中氧化应激水平,探讨氧化应激对糖尿病胃动力和胃Cajal间质细胞(ICC)的影响。方法38只8周龄雄性SD大鼠腹腔注射链脲佐菌素(STZ),选取造模成功的36只大鼠分为糖尿病组和糖尿病治疗组,每组18只,另取同批正常SD大鼠18只作为正常对照组。检测各组大鼠体重、血糖和糖化血红蛋白。实验第1周末和第10周末分别处死各组9只大鼠测定胃排空率,以及胃平滑肌中丙二醛(MDA)、超氧化物歧化酶(SOD)、肿瘤坏死因子-α(TNF-α)、酪氨酸激酶受体c-Kit和干细胞因子(SCF)水平。通过免疫细胞化学和原位末端标记(TUNEL)法检测胃组织ICC凋亡。结果与正常组比较,糖尿病大鼠胃动力明显减弱。糖尿病大鼠胃平滑肌内MDA含量升高,SOD活性减弱,TNF-α含量升高,c-Kit和SCF水平下降,ICC凋亡明显增加。糖尿病大鼠治疗后氧化应激水平降低,抗氧化能力提高,c-Kit和SCF水平显著升高,ICC凋亡减少。抗氧化治疗后胃动力明显改善,与糖尿病组比较有明显差异。结论高血糖影响大鼠胃组织中抗氧化酶的表达。氧化应激水平在糖尿病胃组织中明显增强,在糖尿病大鼠胃动力变化中发挥重要作用。氧化应激促使c-Kit/SCF系统受损,导致胃平滑肌ICC凋亡增多。
糖尿病; 氧化性应激; 胃动力
糖尿病患者发生胃动力障碍的发病机制较多,主要有胃肠神经病变、高血糖、胃肠激素分泌异常以及微血管病变等。然而,糖尿病患者机体的氧化和抗氧化体系失衡,导致氧自由基增多,氧化应激增强,是糖尿病各种并发症如神经病变、肾脏病变、视网膜等病变的重要原因[1],但关于氧化应激对糖尿病胃动力的影响鲜有报道。本实验以糖尿病大鼠模型为研究对象,观察胃平滑肌组织中超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、干细胞因子(stem cell factor,SCF)、酪氨酸激酶受体c-Kit和Cajal间质细胞(interstitial cell of Cajal,ICC)的水平,分析探讨氧化应激对胃动力的影响及发病机制。
材 料 和 方 法
1动物
SPF级SD大鼠,雄性,8周龄,160~180 g,由上海西普尔必凯实验动物有限公司提供,生产许可证为SCXK(沪)2008-0016,饲养环境许可证号为SYXK(浙)2003-0003。
2主要试剂
链脲佐菌素(streptozotocin,STZ)购自Sigma;SOD、MDA和糖化血红蛋白检测试剂盒购自南京建成生物工程研究所;大鼠TNF-α、SCF和c-Kit ELISA试剂盒购自上海阜康生物技术有限公司。c-Kit单克隆抗体、Cy3标记兔抗大鼠IgG抗体和TUNEL试剂盒购自北京嘉美纽诺生物科技有限公司。
3主要方法
3.1糖尿病大鼠模型的建立和分组 雄性SD大鼠56只,分为正常对照(control,C)组大鼠18只和糖尿病建模大鼠38只。正常组大鼠给予基础饲料,建模大鼠给予高脂饲料(猪油18%,蔗糖20%,蛋黄3%,基础饲料59%)。适应性喂养1周后,禁食12 h后,正常对照组大鼠一次性尾静脉注射40 mL/kg 0.1%柠檬酸缓冲液(柠檬酸-柠檬酸钠按1∶1.32配制成柠檬酸缓冲液,pH 4.5),建模组大鼠一次性尾静脉注射40 mL/kg 1%STZ柠檬酸缓冲液。注射STZ 72 h后,不同时间2次随机空腹血糖≥16.7 mmol/L确认为糖尿病模型成功。
模型稳定1周后开始实验。成模的糖尿病大鼠36只,随机分为2组,即抗氧化剂硫辛酸治疗(diabetes millitus plus thioctic acid treatment,DT)组和糖尿病模型(diabetes millitus,DM)组,每组各18只。于实验第1周末随机处死C组大鼠9只,DM组大鼠9只,DT组大鼠9只,取血和胃组织。实验第10周结束时处死C组大鼠9只,DM组大鼠9只,DT组大鼠9只,取血和胃组织。
3.2给药方法 给药组每只大鼠给予硫辛酸100 mg/kg灌胃,DM组和C组则给予同体积的生理盐水灌胃,每天给药1 次。
3.3检测指标及方法
3.3.1胃排空率测定[2]大鼠禁食不禁水16 h后,给予1.5 mmol/L的酚红溶液2 mL灌胃,15 min后处死大鼠。剖腹,结扎贲门和幽门,取胃,沿胃大弯切开,以蒸馏水冲洗胃内容物,定容为20 mL,加入0.5 mol/L NaOH 20 mL搅拌混匀,静置1 h,取5 mL上清液加入20%三氯乙酸0.5 mL去蛋白,以3 500 r/min离心10 min,取上清液。用分光光度计在560 nm波长下测定吸光度值;另取酚红溶液2 mL,先后加入蒸馏水18 mL、0.5 mol/L NaOH 20 mL和20%三氯乙酸4 mL搅拌混匀,测定吸光度值。按公式计算大鼠胃排空率(%)=(1-实测酚红吸光度值/标准酚红吸光度值)×100%。
3.3.2体重检测 每周一上午空腹测体重1次。
3.3.3血糖检测 每周一、三、五上午8点用血糖仪(强生公司One-Touch Ultra)鼠尾取血测空腹血糖(fasting blood glucose,FBG)。
3.3.4糖化血红蛋白测定 处死大鼠后腹主动脉取血,取红细胞制备溶血液,高压液相法测定糖化血红蛋白(glycosylated hemoglobin A1c,HbA1c)含量。
3.3.5胃平滑肌组织中SOD活性和MDA含量检测 取胃平滑肌组织匀浆,MDA含量采用改良的硫代巴比妥酸法,SOD活性采用黄嘌呤氧化法。具体操作均严格按照试剂盒说明书进行。
3.3.6胃平滑肌组织中TNF-α、c-Kit和SCF含量检测 取胃平滑肌组织匀浆,采用酶联免疫吸附实验(ELISA)。具体操作均严格按照试剂盒说明书进行。
3.3.7免疫细胞化学染色法 取部分胃组织,0.01 mol/L PBS冲洗,100%丙酮固定胃20 min,解剖显微镜下,用镊子撕去胃的黏膜层和黏膜下层,获得胃平滑肌肌层铺片。PBS漂洗3次,每次5 min。1%BSA孵育30 min后加入第Ⅰ抗体,c-Kit单克隆抗体4 ℃,48 h;Cy3标记的兔抗大鼠IgG抗体25 ℃,60 min。水溶性封片剂封片观察。
3.3.8TUNEL 法检测胃ICC凋亡指数 采用TUNEL检测试剂盒,按上述方法铺片,4%多聚甲醛固定(20 min,室温),0.1%Triton X-100和0.01 mol/L PBS处理20 min,TUNEL液由45 μL标记液和5 μL酶溶液组成,37 ℃避光孵育1 h,0.01 mol/L PBS漂洗3次,封片后观察。细胞核中有黄色颗粒者为阳性细胞,即凋亡细胞。每张切片选取阳性细胞数最多的视野,计算5个高倍视野(×400)下的凋亡细胞数,以凋亡细胞/100个细胞表示凋亡指数(apoptotic index,AI),计算每100个ICC细胞中阳性细胞数量。
4统计学处理
结 果
1各组大鼠体重、空腹血糖和糖化血红蛋白的变化
实验开始时3组大鼠体重无显著差异(P>0.05)。实验第1周结束时 DM组和DT组大鼠体重增加较C组略明显,但3组间无统计学意义(P>0.05)。与C组比较,FBG和HbA1c在DM组和DT组显著升高(P<0.01)。实验第10周结束时,C组体重增加较DM组和DT组明显(P<0.01)。DM组和DT组的FBG和HbA1c水平显著高于C组(P<0.01)。DM组和DT组的体重、FBG和HbA1c水平在实验第1周和第10周结束时均无显著差异(P>0.05),说明抗氧化治疗对大鼠的体重和血糖无明显影响,见表1。
表1各组大鼠体重、空腹血糖和糖化血红蛋白的比较

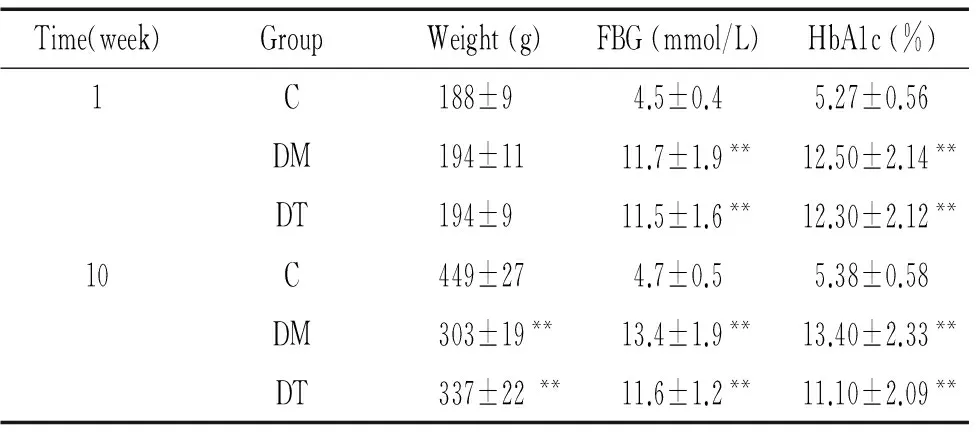
Time(week)GroupWeight(g)FBG(mmol/L)HbA1c(%)1C188±94.5±0.45.27±0.56DM194±1111.7±1.9**12.50±2.14**DT194±911.5±1.6**12.30±2.12**10C449±274.7±0.55.38±0.58DM303±19**13.4±1.9**13.40±2.33**DT337±22**11.6±1.2**11.10±2.09**
C:control;DM:diabetes mellitus;DT: diabetes millitus plus thioctic acid treament.**P<0.01vsC group.
2各组大鼠胃排空率的比较
实验第1周结束时,C组、DM组和DT组3组大
鼠胃排空率分别是(77.25±3.71)%、(80.37±5.36)%和(78.42±4.11)%,组间比较无显著差异(P>0.05)。实验第10周结束时,C组、DM组和DT组3组大鼠胃排空率分别是(75.71±3.48)%、(53.68±4.79)%和(68.44±3.89)%;与C组相比, DM组胃排空率显著降低(P<0.01),DT组无显著差异(P>0.05);与DT组相比,DM组胃排空率显著降低(P<0.01),说明抗氧化治疗后胃动力得到明显改善,见图1。

图1第1周和第10周时各组大鼠胃排空率的比较
3各组大鼠胃平滑肌中MDA和SOD水平比较
实验第1周结束MDA水平在DM组和DT组显著高于C组(P<0.05),SOD水平DM组和DT组显著低于C组(P<0.05),MDA和SOD在DM组和DT组间无显著差异(P>0.05)。第10周结束MDA水平在C组和DT组实验前后无明显变化,显著低于DM组(P<0.01),SOD水平C组最高,DT组次之,DM组最低,组间有显著差异(P<0.05或P<0.01),提示DT组治疗后氧化应激水平较DM组显著下降(P<0.01),抗氧化能力增强(P<0.05),见图2A、B。

图2第1周和第10周各组大鼠胃平滑肌SOD、MDA、TNF-α、c-Kit及SCF水平的比较
4各组大鼠胃平滑肌中TNF-α水平比较
实验第1周结束时TNF-α水平在各组间无明显差异(P>0.05)。第10周结束时TNF-α水平在DM组和DT组高于C组(P<0.05),TNF-α在DM组较DT组升高明显(P<0.05),提示治疗后DT组炎症因子TNF-α水平较DM组有下降,见图2C。
5各组大鼠胃平滑肌中c-Kit和SCF含量比较
实验第1周c-Kit水平在各组间无显著差异(P>0.05),SCF水平与C组比较,DM组和DT组有显著下降(P<0.05)。第10周后与C组比较,c-Kit和SCF水平在DM组和DT组有不同程度下降,其中DM组下降更明显,组间有显著差异(P<0.05或P<0.01),见图2D、E。
6各组大鼠胃平滑肌组织中ICC的AI比较
TUNEL染色凋亡标记细胞核着黄色,c-Kit染色阳性红色为ICC细胞,c-Kit/TUNEL双重染色绿色标记为ICC凋亡细胞。图3为第10周结束时各组ICC凋亡图比较,可见DM组出现大量绿色标记ICC凋亡细胞,DT组较DM组少,C组最少。
AI的观察发现,第1周结束时,C组、DM组、DT组AI分别是(7.9±1.7)%、(9.7±2.1)%和(9.2±1.9)%,明显高于对照组(P<0.05)。第10周后C组、DM组、DT组AI分别是(8.5±2.2)%、(21.2±5.7)%和(12.4±4.1)%,组间有显著差异(P<0.05或P<0.01),提示DM组凋亡更明显,DT组治疗后有改善,见图3。


图3大鼠胃平滑肌ICC凋亡表现
讨 论
氧化应激是糖尿病糖毒性发生的主要致病机制之一,高血糖诱发的氧化应激被认为参与糖尿病的各种慢性并发症[3]。本研究发现伴随着糖尿病大鼠胃动力下降,糖尿病大鼠胃平滑肌组织中氧化应激(MDA)水平升高和抗氧化能力(SOD)下降。给予硫辛酸抗氧化治疗10周后,血糖无明显变化,胃平滑肌内MDA减少,SOD活性提高,胃动力明显恢复,表明通过抗氧化能减轻糖尿病大鼠的胃损伤,改善胃动力,从而说明氧化应激对糖尿病胃动力有重要影响。
ICC是分布在消化道自主神经末梢与平滑肌细胞之间的一类特殊细胞,发出慢波,通过缝隙连接传播到平滑肌细胞,产生动作电位,引起平滑肌收缩,故被认为是胃肠道起搏细胞。因具有产生、传播慢波、传导胃肠神经系统至平滑肌信号的功能,其在胃肠道疾病中的重要作用已被广泛关注[4-5]。近年研究发现糖尿病胃动力障碍大鼠胃平滑肌组织中ICC数量及细胞内细胞器的数量均明显减少[6-7],糖尿病胃动力变化与ICC减少、电节律紊乱有关[8]。本实验研究显示,第1周时3组大鼠ICC凋亡指数无显著差异,胃排空率未受明显影响。早期糖尿病大鼠胃排空的加快研究认为与早期高血糖及下丘脑中ghrelin含量及其受体表达增多使胃排空加速[9]有关。随着病程进展,第10周DM组ICC凋亡指数显著高于C组和DT组,胃排空率显著减慢,说明糖尿病胃动力变化与ICC数量减少有关。进一步观察氧化应激水平与ICC的相关性,DM组氧化应激水平最高,DT组治疗后氧化应激水平显著下降,抗氧化治疗后随着氧化应激水平的下降,ICC凋亡明显减少。而类似相关报道也提示抗氧化治疗能保护ICC并改善胃动力,如血红素加氧酶-1能通过保护ICC而有效逆转糖尿病鼠胃轻瘫[10],锌原卟啉能使糖尿病大鼠结肠ICC数量增加,胃肠动力加快[11]。说明胃动力减退与ICC凋亡有关,而抗氧化治疗能减少ICC细胞凋亡,从而改善胃动力。
分析氧化应激是通过影响胃ICC凋亡的途径,实验进一步检测胃组织中c-Kit和SCF含量。目前糖尿病胃组织ICC凋亡的病理机制主要认为是胰岛素分泌减少,胰岛素信号减弱,c-Kit/SCF减少。SCF是ICC特异性标志物酪氨酸激酶受体c-Kit的配体,是一种重要的多功能生长因子,与c-Kit结合组成c-Kit/SCF信号系统对ICC表型维持、功能分化具有重要作用[7]。很多研究证实外源性给予SCF或胰岛素对糖尿病结肠ICC异常有一定的改善或逆转作用[12-15]。本研究发现DM组大鼠胃平滑肌组织中c-Kit和SCF表达明显下调。早期胃动力、ICC凋亡指数未受影响时,胃平滑肌组织中SCF已开始下降。随着疾病进展,c-Kit和SCF表达进一步下降,ICC凋亡增多。通过抗氧化治疗10周后,氧化应激水平下降,c-Kit/SCF表达有明显提高,ICC凋亡数量减少,胃动力得到显著改善。研究结果提示c-Kit/SCF信号系统受损是导致ICC凋亡,数量减少的重要原因之一,而c-Kit/SCF信号系统受损因氧化应激水平增强。
此外,本实验观察炎症因子TNF-α的变化,发现在第1周时3组水平无差异,第10周时DM组TNF-α明显升高,而DT组升高不明显,但较C组仍有轻度升高,分析是由于高糖促使氧化应激发生,氧化应激诱发TNF-α表达增加。既往也有研究表明 TNF-α可促进氧化应激水平增强,说明慢性的低度炎症状态与高氧化应激水平密切相关[16]。TNF-α在促进细胞凋亡中也有重要的意义[17]。说明氧化应激与炎症因子之间互相促进,形成恶性循环,严重影响ICC增殖,从而促使糖尿病胃动力的改变。
综上述,本实验发现糖尿病大鼠胃平滑肌组织氧化应激程度明显增强,氧化应激通过诱导c-Kit/SCF表达减少,促进ICC凋亡。而抗氧化治疗后随着氧化应激水平的下降,c-Kit/SCF含量升高,ICC凋亡数量下降,胃动力改善。实验研究表明氧化应激在糖尿病大鼠胃动力改变中有着重要的作用。
[1] Yang H, Jin X, Kei Lam CW, et al. Oxidative stress and diabetes mellitus[J].Clin Chem Lab Med, 2011, 49(11):1773-1782.
[2] Miyamoto Y,Yoneda M,Morikawa A,et al.Gastric neuropeptides and gastric motor abnormality in streptozotocin induced diabetic rats:observation for four weeks after streptozotocin[J]. Dig Dis Sci, 2001, 46(8):1596-1603.
[3] King GL,Loeken MR. Hyperglycemia-induced oxidative stress in diabetic complications[J]. Histochem Cell Biol,2004, 122(4):333-338.
[4] 侯晓华, 陈建德. Cajal间质细胞在胃肠运动中的作用[J]. 中华消化杂志, 2001, 21(6):360-362.
[5] 张亚萍, 张宽学, 罗金燕, 等. 糖尿病大鼠胃部Cajal间质细胞超微结构变化的研究[J]. 中华消化杂志, 2003, 23(2):116-117.
[6] 龙庆林, 房殿春, 史洪涛, 等. 糖尿病大鼠胃Cajal间质细胞超微结构的改变[J].中华消化杂志, 2004, 24(7):434-435.
[7] Horvath VJ,Vittal H,Lorincz A,et al. Reduced stem cell factor links smooth myopathy and loss of interstitial cells of Cajal in murine diabetic gastroparesis[J].Gastroenterology, 2006,130(3):759-770.
[8] Long QL, Fang DC, Shi HT, et al. Gastro-electric dysrhythm and lack of gastric interstitial cells of Cajal[J]. World J Gastroenterol, 2004, 10(8):1227-1230.
[9] 王金燕, 王利华, 魏良洲, 等. 下丘脑中Ghrelin、Obestatin水平及其受体表达与糖尿病大鼠胃排空的关系[J].中华医学杂志, 2010, 90(16):1137-1140.
[10]Choi KM, Gibbons SJ, Nguyen TV, et al. Heme oxygenase-1 protects interstitial cell of Cajal from oxidative stress and reverses diabetic gastroparesis[J]. Gastroenterology, 2008, 135(6):2055-2064.e2.
[11]吴高珏, 林 琳, 罗 云, 等. 锌原卟啉对糖尿病大鼠结肠动力及Cajal细胞的影响[J]. 中华消化杂志, 2009, 29(4):245-248.
[12]徐丽明, 林 琳, 汤玉蓉, 等. 干细胞因子对糖尿病结肠Cajal间质细胞的影响[J]. 中华消化杂志, 2008, 28(6):388-391.
[13]Li J,Goodyer CG,Fellows F,et al.Stem cell factor/c-Kit interactions regulate human islet-epithelial cluster proliferation and differentiation[J].Int J Biochem Cell Biol, 2006, 38(5-6):961-972.
[14]Bashamboo A,Taylor AH,Samuel K,et al.The survival of differentiating embryonic stem cells is dependent on the SCF-KIT pathway[J].J Cell Sci ,2006, 119(Pt 15):3039-3046.
[15]Battaglia E, Bassotti G, Bellone G, et al.Loss of interstitial cells of Cajal networkin severe idiopathic gastroparesis[J]. World J Gastroenterol, 2006, 12(38):6172-6177.
[16]Bitar MS,Ayed AK, Abdel-Halim SM, et al. Inflammation and apoptosis in aortic tissues of aged type II diabetes: amelioration with α-lipoic acid through phosphatidylinositol 3-kinase/Akt-dependent mechanism[J]. Life Sci, 2010, 86(23-24):844-853.
[17]Joussen AM,Doehmen S,Le ML,et al. TNF-α mediated apoptosis plays an important role in the development of early diabetic retinopathy and long-term histopathological alterations[J]. Mol Vis, 2009, 15:1418-1428.
Roleofoxidativestressingastricmotilityofdiabeticrats
JIN Qi-hui1, GUAN Wen-hua2, WANG Hui3, ZHU Yan-tao3, CHEN Huai-hong1, LOU Yu-feng4, CHEN Ying5
(1DepartmentofGeriatrics,5DepartmentofOfficerHealth,SecondAffiliatedHospitalofZhejiangUniversitySchoolofMedicine,Hangzhou310009,China;2DepartmentofHematology,4DepartmentofClinicalLaboratory,FirstAffiliatedHospitalofZhejiangUniversitySchoolofMedicine,Hangzhou310003,China;3DepartmentofResearch,ZhejiangChineseMedicalUniversity,Hangzhou310035,China.E-mail:z2chengying@126.com)
AIM: To investigate the changes of oxidative stress in the stomach tissues and their roles in gastric motility and interstitial cells of Cajal (ICC) in diabetic rats.METHODSThirty-eight SD rats (8-week-old, male) were intraperitoneally injected with streptozotocin (STZ). Diabetes was successfully induced in 36 of them. The diabetes rats were randomly divided into untreated diabetes group and treated diabetes group. Eighteen healthy SD rats (8-week-old, male) served as controls. The body weight and the levels of blood glucose and glycosylated hemoglobin were measured. At the end of week 1 and week 10, 9 rats were sacrificed in each group. The gastric emptying rate and the levels of malondialdehyde (MDA),superoxide dismutase (SOD), tumor necrosis factor α (TNF-α), tyrosine kinase receptor c-Kit and stem cell factor (SCF) in gastric smooth muscle were analyzed. The apoptosis of ICC in gastric tissues was detected by the methods of immunocytochemistry and TUNEL.RESULTSCompared with control group, gastric motility and SOD activity in untreated diabetes group were significantly weakened, the levels of MDA and TNF-α increased, the levels of c-Kit and SCF decreased, and apoptosis of ICC enhanced. In treated diabetes group, the oxidative stress level was attenuated, antioxidant capacity was enhanced, the levels of c-Kit and SCF were significantly increased, and the ICC apoptosis was reduced. Gastric motility was significantly improved after antioxidant therapy.CONCLUSIONHyperglycemia affects the expression of antioxidant enzymes in the stomachs of diabetic rats. Oxidative stress is caused by hyperglycemia and is an important factor in the etiology of gastric motility dysfunction in diabetic rats, which may be correlated with the augmentation of ICC apoptosis resulting from oxidative stress-induced c-Kit/SCF damage.
Diabetes mellitus; Oxidative stress; Gastric motility
R363
A
10.3969/j.issn.1000-4718.2012.12.023

