应用亚硫酸钠快速制备低氧性肺血管收缩离体模型所需低氧性Krebs-Henseleit液的方法及评价*
姚海霞, 祝 卿, 吉 伟, 王淑君, 王良荣, 林丽娜△, 王万铁△
(温州医学院1附属第一医院麻醉科,2病理生理学教研室,浙江温州325035)
在研究急性低氧对肺血管张力影响的实验中,如何使肺血管环迅速获得稳定的低氧环境是研究前提。以往,低氧性肺血管收缩(hypoxic pulmonary vasoconstriction,HPV)研究多采用物理性低氧通气法降低血管缓冲液Krebs-Henseleit(KH)液的氧分压(oxygen partial pressure,PO2),虽然此方法可对肺血管造成低氧相关性损伤,但却必须配备装有高精准比例的氮气和二氧化碳的储气瓶[1],才能使血管KH液的PO2下降,而且在通入低氧气体时要给浴槽加盖保持密闭持续通气很长时间,这种密闭环境在挂着血管环的状态下非常不易操作,而且通入气体的时间和KH液的PO2无法精准监测,不能保证每次实验达到的低氧条件都是一致。因此快速制备出HPV离体血管实验所需的稳定的低氧性KH液具有重要意义。亚硫酸钠(sodium sulfite,Na2SO3)作为一种主要的食品防腐剂,可快速去氧引发厌氧条件,从而有效地抑制好氧微生物的生长,且缺氧的程度和Na2SO3溶液的保质期容易控制[2-4]。本研究拟在暴露空气的开放环境中将无水Na2SO3加至0.5 L KH液中,利用Na2SO3结合水溶液中溶解氧的能力,以期获得一种快速制备低氧性KH液的新方法,应用于肺血管急性低氧实验的离体研究。
材料和方法
1 材料
便携式临床分析仪 (型号:2-35451,i-STAT Corporation);pH计(型号:沪制01040055,梅特勒-托利多仪器上海有限公司);电热恒温水浴锅(型号:HH.521-4-5,上海贺德实验设备有限公司);温度计;无水Na2SO3;KH液:0.5 L KH 液含 NaCl 3.2409 g,KCl 0.1752 g,MgSO40.1479 g ,NaHCO31.0501 g,KH2PO40.0816 g ,CaCl20.1387 g ,葡萄糖0.9000 g(上述试剂均为市售分析纯级)。
2 方法
2.1 选用8份双蒸水配置0.5 L KH液(温度:37℃,pH 7.30~7.45)。在暴露空气的开放环境下,分别加入0(A1,对照组)、0.2(A2)、0.5(A3)、0.8(A4)、1.1(A5)、1.4(A6)、1.5(A7)、1.6 g(A8)的无水 Na2SO3搅拌充分溶解后,1 mol/L HCl调定 pH 7.30 ~7.45,二氧化碳分压(carbon dioxide partial pressure,PCO2)35~45 mmHg。分别在加样后1 min取样行成分分析,选择符合低氧条件(PO2降低到40 mmHg以下)的Na2SO3-KH液进入以下研究。
2.2 根据加样后1 min液体指标测定,选择1.5 g Na2SO3加至0.5 L KH液,充分溶解后,分别在加样前和加样后1、10、20、30、60、90 min 取样行成分分析(pH、PCO2、PO2及 Na+浓度)。每次测定前先测定溶液pH,如pH超出范围,先用HCl调节再测定各指标。另外,由于Na2SO3进入水中反应生成等 mol的Na2SO4,含2倍mol的Na+,明显增加KH液Na+浓度,为了防止溶液出现高渗,经过换算把增加的Na+通过减少NaCl的量使Na+渗透压保持在135~155 mmol/L,本实验把0.5 L KH液中加入的NaCl的剂量改为2.0563 g,其余成分的剂量不变。
2.3 根据上述方法,选择1.5 g Na2SO3加至0.5 L KH液,充分溶解后,分别在加样前和加样后 0 h、1 h、2 h、3 h、6 h、9 h、12 h、15 h、18 h、、21 h、24 h 取样进行成分分析(pH、PCO2和PO2),观察低氧溶液24 h的变化。
2.4 方法同 2.2,选择 1.5 g Na2SO3加至 0.5 L KH 液,充分溶解后,分别在加样前和加样后第1 d、第2 d、第3 d、第4 d、第 5 d、第6 d、第7 d、第8 d、第 9 d、第10 d、第11 d 取样进行成分分析(pH、PCO2和PO2),观察低氧溶液的维持状态。
3 统计学处理
采用SPSS 16.0统计软件包进行数据处理,计量资料以均数±标准差(¯x±s)表示,组间比较采用单因素方差分析,两两比较采用Bonferroni法,以P<0.05为差异有统计学意义。
结 果
1 不同剂量的Na2SO3对0.5 L KH液PO2的影响
各组0.5 L KH液中加不同剂量Na2SO31 min后,与对照组(A1)相比,溶液PO2降低(P<0.01),且随着Na2SO3剂量的增加,PO2降低明显(P<0.01),pH和PCO2改变无显著差异(P>0.05)。其中A7组PO2均处于20~40 mmHg范围,最适合HPV离体模型实验所需,见表1。
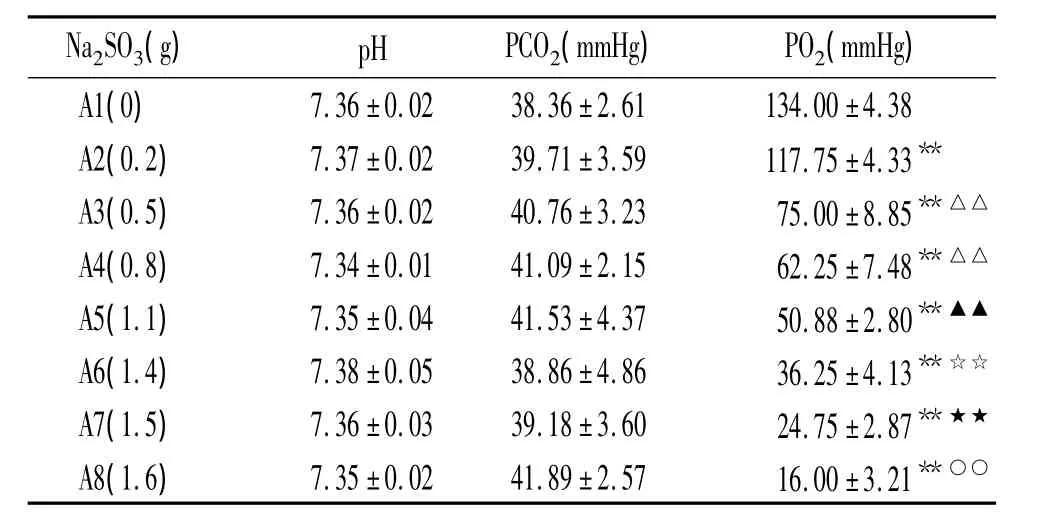
表1 溶入不同剂量Na2SO31 min后0.5 L KH液中pH、PCO2和PO2的变化Table 1.The values of pH,carbon dioxide partial pressure(PCO2),oxygen partial pressure(PO2)after different doses of sodium sulfite(Na2SO3)dissolved in Krebs-Henseleit(KH)solution at 1 min(¯x±s.n=8)
2 应用1.5 g Na2SO3可使0.5 L KH溶液达到HPV所需的低氧性溶液并且可维持低氧状态至少90 min
将1.5 g Na2SO3加入到0.5 L KH 液后PO2由(150.00 ±17.25)mmHg迅速降到(24.75 ±2.87)mmHg,加样后20、30、60 min与1 min相比PO2改变未见显著差异(P>0.05),而10 min与1 min相比PO2降低有统计学意义(P<0.05),且90 min时 PO2为(27.50±1.41)mmHg,与 1 min时相比有所升高,差异有统计学意义(P<0.05),但二者PO2数值仍处于20~40 mmHg范围内。各时点的PCO2多处于正常范围(35~45 mmHg);pH处于正常范围(7.30~7.45);Na+渗透压均处于正常范围(135~155 mmol/L),见表2。此低氧条件已满足急性HPV离体实验所需的低氧状态的维持时间60 min。
3 应用1.5 g Na2SO3达到的低氧状态在24 h内无变化
将1.5 g Na2SO3加入到0.5 L KH液后,加样后各时点与1 min相比PO2和PCO2均无明显变化(P>0.05),见图1。
4 应用1.5 g Na2SO3的低氧溶液PO2在加样后第2 d开始上升,在第11 d上升至正常
将1.5g Na2SO3加入到0.5 L KH液后,第2 d之后的各时点与第1 d相比差异显著(P<0.05),第11 d与未加样前相比无显著差异(P>0.05),见图2。
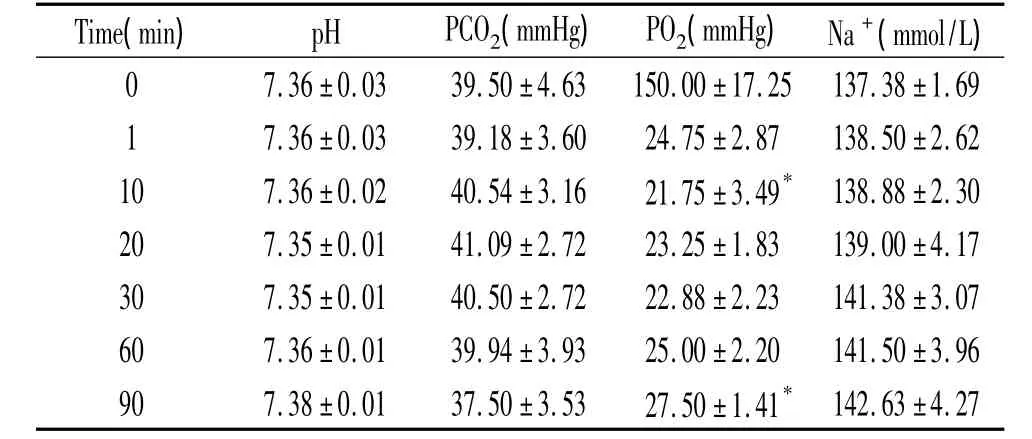
表2 1.5 g Na2SO3溶入0.5 L KH液后各时点的 pH、PCO2、PO2和 Na+浓度的变化Table 2.The values of pH,PCO2,PO2,the concentration of Na+after 1.5 g Na2SO3dissolved in KH at various time points(¯x±s.n=8)

Figure 1.Changes of PO2and PCO2after 1.5g Na2SO3dissolved in KH solution at various time points during the first day.¯x±s.n=8.图1 1.5 g Na2SO3溶入0.5 L KH 液后第 1 d(24 h)内各时点PO2和PCO2的变化
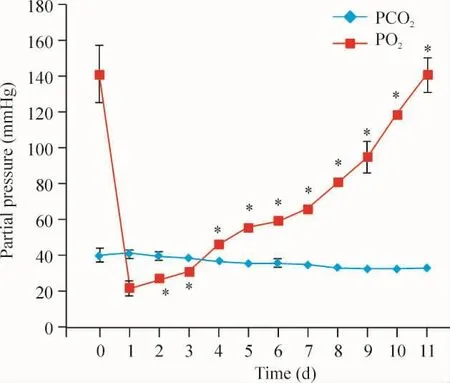
Figure 2.Daily changes of PO2and PCO2after 1.5 g Na2SO3 dissolved in KH solution.¯x±s.n=8.*P<0.05 vs 1 d.图2 1.5 g Na2SO3溶入0.5 L KH液后每天PO2和PCO2的变化
讨 论
HPV是近年研究热点,常见于当肺泡氧分压降到某一临界值,肺血管发生快速、可逆的收缩反应,以纠正肺泡通气/灌流的不匹配,从而在不明显改变肺动脉压的情况下最大程度地提高机体氧分压。短时间内的HPV对机体是一种保护机制,但长期反复发作HPV却是肺动脉高压、肺源性心脏病的“元凶”,研究HPV机制对肺动脉高压和肺心病以及慢性阻塞性肺疾病等防治机制的基础研究有重要意义。在离体肺血管实验中,如何快速有效地制备离体低氧模型所需的低氧性KH液是研究HPV的前提条件。目前多将离体肺血管置于低氧环境中,其基本实验条件为:PO220~40 mmHg,PCO235~45 mmHg,pH 7.30 ~7.45。常用造模方法为物理性低氧法,即肺血管环平衡稳定后向器官浴槽中通入的常氧气体(95%O2和5%CO2)转换为无氧气体(95%N2和5%CO2),并且要浴槽口加盖密封使浴槽中KH液PO2达到(40±10)mmHg。此方法不足之处首先是实验中转换气体条件时常出现时间和气压不同步,并且浴槽中KH液的PO2、PCO2和pH在各个时点无法实时监测,不能控制PO2降低的程度,PO2达到要求的时点和气体的流速不好把握,即使PO2达到要求,并不能完全保证PCO2在正常范围内。其次,当达到所需要的低氧条件后,如果要进行后期的药物干预须经浴槽口直接加药物的话就不可避免地破坏密闭环境,大气压氧的影响使降低的PO2极易变化而不稳定,影响实验质量。
Abudara等[5]和胡清华等[6]使用硫代硫酸钠剥夺水溶液中的氧模拟低氧反应,类似于物理性低氧。然而,硫代硫酸钠容易自燃,它与水反应是放热反应,反应后生成Na2SO3和二氧化硫(SO2)。也有研究用氯化钴与铁(氧传感途径的重要因子)竞争的机制制作化学性缺氧模型,但是氯化钴是一种重金属具有组织和细胞毒性[7]。研究报道[8]Na2SO3可以降低水溶液中的溶解氧浓度,并且能激活缺氧诱导因子-1调控途径,表明Na2SO3是一种潜在的可模拟低氧应激的刺激物[2]。并且 Na2SO3和水的反应不自燃,也不产生 SO2,Na2SO3进入水溶液中与氧反应生成的硫酸钠(Na2SO4)对机体的危害与低氧相比几乎是没有毒性的。因此Na2SO3相比硫代硫酸钠更有优势[2]。
本研究结果表明,在开放环境中,不同剂量Na2SO3可使0.5 L KH液PO2降低,并呈剂量依赖性,即溶液中Na2SO3的量越大,PO2就越低。从表1中可见尤其是加1.5 g Na2SO3可使PO2降低到40 mmHg以下,这个条件符合于离体肺血管低氧实验的研究条件。且1.5 g Na2SO3-KH低氧溶液暴露在空气中90 min,发现PO2基本稳定,而溶液pH值、PCO2和Na+渗透压无明显变化。这与完全去除溶解在1 L水中的溶解氧需要0.08 g Na2SO3[8]的理论相吻合,因为大气氧会逐渐地再溶解于水溶液中,低浓度的Na2SO3不可能完全去除水溶液中的溶解氧,按照前述的理论换算,0.5 L KH中加入的1.5 g Na2SO3中,其中0.04 g是用于去除水中的溶解氧,剩余的1.46 g是用于抑制大气压氧的再溶解从而保证其低氧状态(20~40 mmHg)维持一定时间段。就这一点说,Na2SO3达到的低氧状态在可控性和稳定性上具有优势;而且离体血管处于开放的环境,无需将浴槽加盖,便于用一些特殊的仪器和试剂对血管进行干预并作及时的观察。因此,1.5 g Na2SO3加入0.5L KH液中充分溶解后,可满足急性低氧性肺血管实验所需的低氧条件,并且维持此低氧状态最少90 min,足以达到肺血管实验的急性低氧时间1 h。
此外,本研究结果3和4发现,1.5 g Na2SO3-KH低氧溶液的低氧状态在24 h内无变化,在第2 d PO2开始上升,在第11 d上升至正常值,低氧状态最多可以维持24 h,足以达到HPV离体实验模型的急性低氧时间1 h.
Jiang等[4]最新研究得出结论:Na2SO3能降低M9缓冲液中的溶解氧,是一种模拟低氧应激的潜在因子,其诱发的低氧环境建造的线虫低氧模型和物理性低氧模型一致,证明Na2SO3可以用于建造低氧实验模型的研究,但并未具体验证Na2SO3是否可以用于血管、细胞或其它靶组织低氧实验的研究。因为血管、细胞等离体器官的实验其各自的缓冲液各不相同,如离体血管的缓冲液是 KH,离体细胞的培养液是DMEM液,线虫的缓冲液则为M9缓冲液。各自缓冲液的成分比例差别很大。Jiang等[4]研究的Na2SO3降低M9缓冲液的氧程度和维持能力不一定与KH液和DMEM液相同,也许会因为成分的不同互相影响而发生变化。因此Na2SO3是否可以用于制备血管或细胞的缺氧模型仍需实验验证。因此,本研究是在Jiang等[4]的研究基础上具体探索了Na2SO3是否可以用于制备低氧性肺血管收缩实验所需的低氧性KH液的可行性,并进一步支持了Jiang等[4]的研究结果。本研究结果为开展Na2SO3在其它血管如主动脉血管或肠系膜血管或细胞等靶器官低氧研究中的应用提供了可能的依据,从而为解决低氧研究提供新方法和解决途径。本研究测定的指标除PO2外,还观察了低氧溶液的pH值、PCO2和Na+渗透压,保证了肺血管处于一个稳定的低氧性环境。此外,本方法造价低廉,制作简单,使用方便,为低氧实验的研究提供了一种新手段。
[1] Koch C.A thin-film culturing technique allowing rapid gas-liquid equiplibration(6 sec)with no toxicity to mammalian cells[J].Radiat Res,1984,97(2):434-442.
[2] 史 焱,詹先成,吕太平,等.抗氧化剂亚硫酸钠、亚硫酸氢钠及焦亚硫酸钠氧化反应速率常数的测定[J].化学学报,2006,64(6):496-500.
[3] Schlatter J,Wüergler F,Kränzlin R,et al.The potential genotoxicity of sorbates:effects on cell cycle in vitro in V79 cells and somatic mutations in Drosophila[J].Food Chem Toxicol,1992,30(10):843-851.
[4] Jiang B,Ren C,Li Y,et al.Sodium sulfite is a potential hypoxia inducer that mimics hypoxic stress in Caenorhabditis elegans[J].Biol Inorg Chem,2011,16(2):267-274.
[5] Abudara V,Jiang R,Eyaguirre C.Behavior of junction channels between rat glomus cells during normoxia and hypoxia[J].J Neurophysiol,2002,88(2):639-649.
[6] 胡清华,王迪浔.一种快速制备的极度低氧溶液方法[J].中国病理生理杂志,1993,9(6):744,677.
[7] Vengellur A,LaPres J.The role of hypoxia inducible actor 1α in cobalt chloride induced cell death in mouse embryonic fibroblasts[J].Toxicol Sci,2004,82(2):638-646.
[8] 颜月娥.亚硫酸钠化学除氧的应用[J].工业水处理,2007,27(11):88-90.

