福建绞股蓝皂苷的优化提取及其抗肝癌活性
陈良华, 郑志忠, 张树峰,3, 谌迪, 明艳林, 陈清西, 童庆宣 *
(1.厦门华侨亚热带植物引种园/厦门市引种检疫与植物源产物重点实验室,福建 厦门 361002;2.厦门大学 生命科学学院,福建 厦门361005;3.华侨大学 化工学院,福建 厦门 361021)
绞 股 蓝 (Gynostemma pentaphyllum Thnmb Mak.)为葫芦科绞股蓝属植物,俗称七叶胆、小苦药、遍地生根、甘茶蔓等,其种类繁多,有14个种2个变种,2001年国家林业局保护司关于征集 《国家重点保护野生植物名录》(第二批)文件中,把绞股蓝调整为国家重点保护药食同源性植物[1]。
绞股蓝的化学成分研究始于20世纪70年代,主要药效成分为绞股蓝皂苷(Gypenoside),目前有报道称从绞股蓝中分离出的绞股蓝皂苷已达到169种之多[2]。由于绞股蓝种类多,甚至同种绞股蓝又可因种植产地、采收季节及光照条件等诸多环境因素影响,其中含有的绞股蓝皂苷数量和组成成分比例上有较大差异,对绞股蓝的研究如化学成分分来说品种选择显得尤为重要。绞股蓝皂苷结构上与人参皂苷具有类似主骨架的达玛烷型结构,属于四环三萜皂苷,其中GPYⅢ、Ⅳ、Ⅵ、Ⅶ分别与人参皂苷Rbl、Rbl、Rd、F2 化学结构上完全相同, 因此绞股蓝皂苷许多药理作用与人参皂苷相似,其中主要有抗肿瘤[3]、降血脂血糖[4]、保护心脏和肝脏[5]和防止衰老[6]等药理作用。目前在抗肿瘤研究方面,较多也仅限于对绞股蓝总皂苷对肿瘤细胞抑制作用和机理研究[7-8],单体绞股蓝皂苷抗肿瘤作用研究还相对较少,仅见少许报道[9-10]。
绞股蓝在福建省有丰富资源,福建亚热带植物研究所曾对福建省绞股蓝资源进行实地调查,全省野生绞股蓝不仅分布范围广、地点多,而且生态类型多样。以绞股蓝口感品味划分有三大类型;甘甜型、腥苦型和清淡型。三大类型间还有过渡类型。各类型均有生长,其中腥苦型较多,甘甜型和清淡型较少[11]。绞股蓝资源的多样类型为筛选适于提取精品,直接冲泡等不同用法提供丰富的原始材料和广泛的种源。作者选用福建南靖绞股蓝为材料,通过HPLC分析绞股蓝成分,并探讨绞股蓝皂苷的提取及其抗癌活性研究,为后续绞股蓝抗癌成分分离纯化和药物的研发奠定基础。
1 材料与方法
1.1 实验材料
“201”七叶甜甘型绞股蓝:采自福建南靖种植区;肝癌细胞SMCC7721和Bel7402:购自中科院上海生化与细胞所;人参皂苷Rb1:购自中国药品生物制品检定所。
1.2 实验仪器和试剂
液相色谱仪:Agilent 1200,Agilent公司产品;酶标仪:MK3,美国Thermo公司产品;新生牛血清:购自HyClone公司;RPMI1640和DMEM培养基:购自GIBCO公司;青霉素钠、链霉素钠:购自上海Sangon公司;乙腈:购自 Merck 公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐 (MTT):购自 Sigma公司;其它化学试剂均为国产分析纯试剂。
1.3 方法
1.3.1 绞股蓝皂苷的提取 采集的新鲜绞股蓝晒干并剪成3~5 cm小段,用高速粉碎机磨成粉末状。称取4份50 g绞股蓝粉末于三角瓶中,分别加入20倍量约1 L体积的水,体积分数45%,75%和95%乙醇溶剂分3次提取;每次在60℃水浴锅中加热浸提12 h后,真空抽滤获得绞股蓝提取液,合并提取液经旋转蒸发仪浓缩去除乙醇溶剂,获得绞股蓝乙醇提取物。
1.3.2 不同极性绞股蓝皂苷的提取和正交优化
称取4份10 g绞股蓝粉末,分别加入水,体积分数15%,30%,45%的乙醇溶液为溶剂提取绞股蓝皂苷,通过HPLC分析确定极性绞股蓝皂苷的乙醇浓度;另称取4份10 g绞股蓝粉末经极性绞股蓝皂苷提取后,再选用体积分数70%,80%,90%,100%乙醇溶液提取,通过HPLC分析确定弱极性绞股蓝皂苷的乙醇体积分数;最后选取溶剂用量、提取温度和提取时间作为考察因素,每个因素设3个水平,采用L9(33)正交实验优化极性和弱极性绞股蓝皂苷的提取。
1.3.3 绞股蓝皂苷HPLC分析 色谱条件:色谱柱为 Agilent Eclipse XDB-C18 (150 mm×4.6 mm);柱温:25 ℃;检测波长:203 nm;流量:1.0 mL/min;进样量为 20 μL,流动相为:水(A)/乙腈(B)梯度洗脱,流动相体积比的梯度洗脱条件为0~8 min:A,80%,B,20% ;8 ~20 min:A,65% ,B,35% ;20 ~35 min:A,30% ,B,70% ;35 ~40 min:A,30% ,B,70% ;40 ~50 min:B,100%;50~60 min:B,100% ;60~70 min:A,80%,B,20%。
1.3.4 绞股蓝皂苷质量分数测定 按照文献[12]的方法,并作适当调整。配置质量浓度为2 mg/mL的人参皂苷Rb1为对照品,以吸光值为纵坐标,样品浓度为横坐标,绘制标准曲线。绞股蓝皂苷含量测定为:取200 μL样品液于具塞试管中,加入800 μL质量分数为5%香草醛-高氯酸溶液,60℃水浴加热15 min,取出后冷却至室温,用冰醋酸定容成终体积3 mL,在紫外分光光度计550 nm下测定吸光值,根据标准曲线计算绞股蓝皂苷含量。
1.3.5 MTT法测定绞股蓝皂苷抗癌活性 利用MTT 法 测 定 不 同 质 量 浓 度 (0、6.25、12.5、25、50、100、200 μg/mL)绞股蓝总皂苷(GYP)、极性绞股蓝皂苷(GYP1)和弱极性绞股蓝皂苷(GYP2)作用 72 h后,分别对肝癌细胞SMCC77221和Bel7402的体外抑制作用。具体方法如下:取对数生长期细胞,质量分数为0.25%胰酶消化,用细胞培养液制成细胞数为5×104个/mL的单细胞悬液,接种于96孔板,每孔100 μL。培养24 h后,吸去细胞培养液,分别加入100 μL的对照组培养液和含绞股蓝皂苷的实验组培养液,每组4个重复,共培养72 h后,吸去培养液,每孔加入 MTT (0.5 mg/mL)200 μL,再培养 4 h,吸去上清液,加入 DMSO 200 μL 振荡 10 min,在酶标仪上读取570 nm处吸光度(A570nm值)。细胞抑制率=(A对照组-A给药组)/A对照组×100%。
2 结果与讨论
2.1 绞股蓝皂苷HPLC分析
绞股蓝中含有达玛烷型为主骨架的多种绞股蓝皂苷,侧链衔接的基团不同导致绞股蓝皂苷极性的差异。作者以福建南靖绞股蓝为材料,为分析绞股蓝含有皂苷的种类和数量,通过HPLC分析不同乙醇体积分数对绞股蓝皂苷提取的影响,结果表明:不同体积分数乙醇对提取绞股蓝皂苷有很大的影响,乙醇体积分数越高提取的绞股蓝皂苷数量越多,而比较绞股蓝HPLC图谱洗脱峰可知南靖绞股蓝含有20~30 min和45~60 min保留时间的2个组份极性差异的绞股蓝皂苷(图1a),可以选定不同的乙醇体积分数分别提取该2组份的绞股蓝皂苷以便后续的分离纯化研究。将体积分数75%乙醇提取总成分定为绞股蓝总皂苷(GYP),保留时间为20~30 min组份皂苷定为极性绞股蓝皂苷(GYP1),保留时间为45~60 min组份皂苷定为弱极性绞股蓝皂苷(GYP2)。
为选定乙醇体积分数分别提取GYP1和GYP2,分别选取水,体积分数15%,30%,45%乙醇溶液提取绞股蓝,进而再用体积分数70%,80%,90%,100%乙醇溶液提取,通过HPLC分析表明:体积分数45%乙醇能有效提取GYP1该部分的极性绞股蓝皂苷(图1b),体积分数90%乙醇能有效提取GYP2该部分的弱极性绞股蓝皂苷(图1c)。
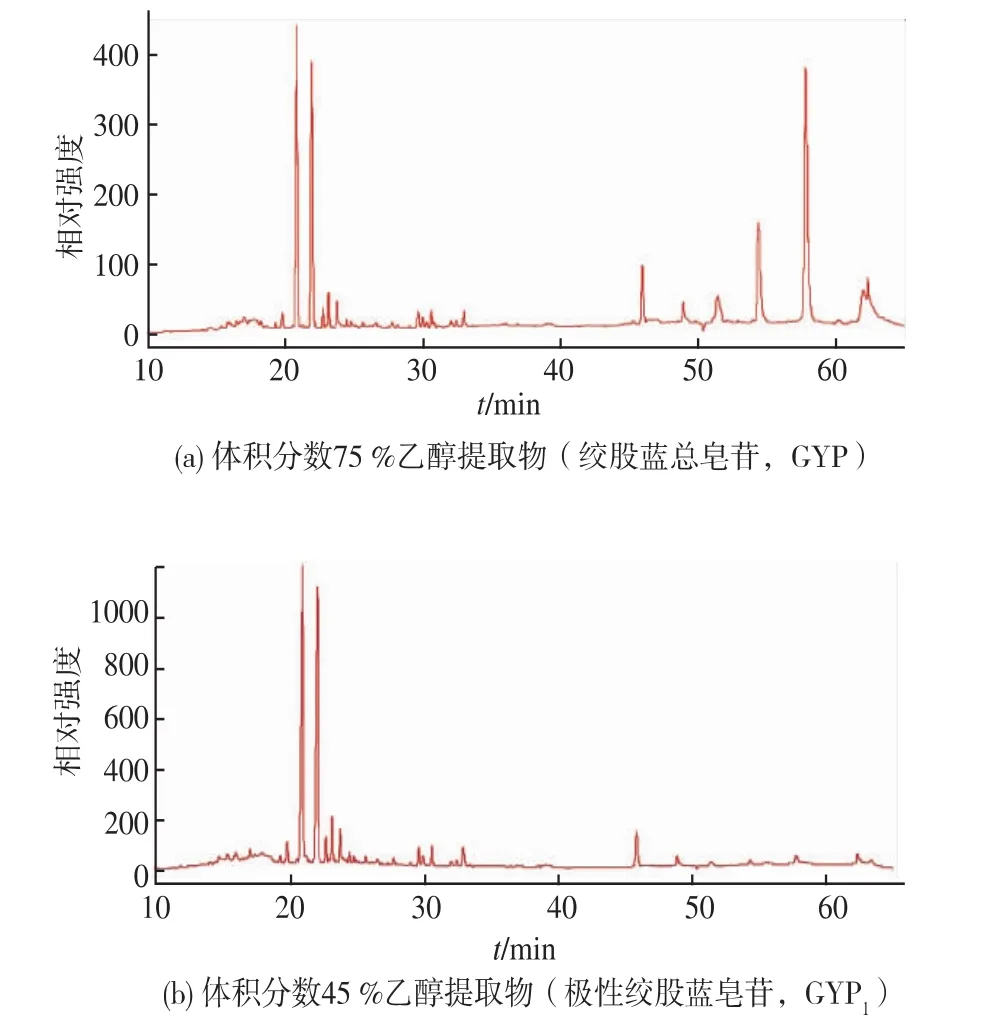

图1 绞股蓝皂苷HPLC分析Fig.1 HPLC analysis of gypenoside
2.2 正交优化提取极性绞股蓝皂苷
根据上述确定体积分数为45%乙醇溶液适宜于提取GYP1,采用加热浸提法,选定溶剂用量、提取温度和提取时间3个因素,以提取液中皂苷含量为考察指标,设定正交实验考察3个因素对GYP1提取的影响,正交实验结果见表1。由极差R可知,各因素对提取GYP1的影响程度的依次顺序为A(溶剂用量)>B(提取温度)>C(提取时间),即溶剂用量对GYP1的提取影响最大,其次是提取温度,而提取时间影响最小,同时确定提取优化的最佳条件为A3B3C3,即在70℃水浴中,以30倍质量的体积分数45%乙醇溶液加热提取12 h,根据优化的条件进行验证实验,3组并行实验测定的皂苷得率为3.12%,3.26%和3.32%,平均值得率为3.23%。

表1 正交实验结果与分析(GYP1)Tab.1 Design and result of orthogonal test
2.3 正交优化提取弱极性绞股蓝皂苷
根据上述确定体积分数为90%乙醇溶液适宜于提取GYP2,采用加热浸提法,选定溶剂用量、提取温度和提取时间3个因素,以提取液中皂苷含量为考察指标,设定正交实验考察3个因素对GYP2提取的影响,正交实验结果见表2。由极差R可知,各因素对提取GYP2的影响程度的依次顺序为A(溶剂用量)>B(提取温度)>C(提取时间),即溶剂用量对GYP2的提取影响最大,其次是提取温度,而提取时间影响最小,同时确定优化提取的最佳条件为A3B3C2,即在60℃水浴中,以30倍量的体积分数90%乙醇溶液加热提取6 h,在正交实验9个组合中,该组合的提取得率为3.21%均高于其他组,证明正交优化结果的可靠性。

表2 正交实验结果与分析(GYP2)Tab.2 Design and result of orthogonal test
2.4 绞股蓝皂苷抗肝癌活性
利用MTT法测定绞股蓝总皂苷(GYP)、极性绞股蓝皂苷(GYP1)和弱极性绞股蓝皂苷(GYP2)分别对肝癌细胞 SMCC77221(图 2a)和 Bel7402(图 2b)的体外抑制作用。从图2抑制曲线可知:皂苷对肝癌细胞作用 72 h后,GYP和 GYP2对肝癌细胞SMCC7721有抑制作用,半抑制率IC50值分别为(165.83±14.12)μg/mL 和 (113.97±9.26)μg/mL,而GYP1在 0~200 μg/mL 浓 度范 围内 对 肝 癌 细 胞SMCC抑制没有达到50%半抑制率,表明基本没有抑制作用,该结果表明GYP的对肝癌细胞的抗癌活性可能主要由GYP2起作用的,绞股蓝抗癌活性物质主要是由弱极性皂苷发挥功效;GYP、GYP1和GYP2在0~200 μg/mL质量浓度范围内对肝癌细胞Bel7402也基本没有抑制作用,都没有达到50%半抑制率。上述结果表明,绞股蓝皂苷对肝癌细胞SMCC的作用较为敏感,而对肝癌细胞Bel7402作用不敏感。

图2 绞股蓝皂苷对肝癌细胞体外抑制作用Fig.2 Inhibition effect of gypenoside on the growth of Hepatocellular carcinoma cells in vitro
3 结语
为优选提取工艺,最大限度地提取有效成分,提高目标成分的纯度,减少非目标成分的溶出,为后期的分离纯化创造更好地条件,分别研究不同体积分数乙醇提取福建南靖绞股蓝中极性皂苷和弱极性皂苷,并通过正交实验优化提取过程。确定体积分数为45%乙醇溶液提取极性绞股蓝皂苷,体积分数为90%乙醇溶液提取弱极性绞股蓝皂苷;正交实验优化提取在70℃水浴中以30倍质量的体积分数45%乙醇溶液加热提取12 h为最佳提取极性绞股蓝皂苷,在60℃水浴中以30倍量的体积分数90%乙醇溶液加热提取6 h为最佳提取弱极性绞股蓝皂苷。
皂苷的药效作用与侧链糖基有直接关系,结构中糖基侧链的不同,而显示出不同性质和药理活性。目前利用生物转化手段将高糖链的皂苷结构修饰成低糖链活性更高的皂苷或苷元,已成为皂苷研究的热点,而应用中药生物转化技术可以为开发新药、提高药物疗效、降低药物毒副作用的研究提供新的手段[13]。比较测定了提取的极性绞股蓝皂苷和弱极性绞股蓝皂苷的抗肝癌活性,结果表明绞股蓝抗癌药效主要是由弱极性皂苷起主要作用,极性皂苷基本没有抗癌作用。优化提取的弱极性皂苷抗癌作用将为后期分离纯化绞股蓝抗癌活性物质奠定基础。
[1]Valentina R N,Tom H H,Van H T,et al.Chemistry and pharmacology of Gynostemma pentaphyllum[J].Phytochemistry Review,2005,4:197-219.
[2]Ji H K,Yong N H.Dammarane-type saponins from Gynostemma pentaphyllum[J].Phytochemistry,2011,72:1453-1459.
[3]Lu Kung-wen,Tsai M L,Chen Jung-chou,et al.Gypenosides inhibited invasion and migration of human tongue cancer SCC4 cells through down-regulation of NF-kappaB and matrix metalloproteinase-9[J].Anticancer Research,2008,28(2):1093-1099.
[4]Yeo J,Kang Y J,Jeon S M,et al.Potential hypoglycemic effect of an ethanol extract of Gynostemma pentaphyllum in C57BL/KsJ-db/db mice[J].Journal of Medicinal Food,2008,11:709-716.
[5]陈几香,张建国,张莉,等.绞股蓝总皂苷保肝作用实验研究[J].中国药业,2007,13:7-8.CHEN Ji-xiang,ZHANG Jian-guo,ZHANG Li,et al.Study on liver protective effect of total saponins of Gynostemma pentaphyllum[J].China Pharmaceuticals,2007,13:7-8.(in Chinese)
[6]刘国辉,姚丹丹,卢佳怡,等.绞股蓝对D-半乳糖所致亚急性衰老大鼠下丘脑的抗衰老作用及其机制研究[J].医学理论与实践,2006,19(5):497-499.LIU Guo-hui,YAO dan-dan,LU Jia-yi,et al.The effect mechanism of Gynostemma Pentaphyllum Makino to hippoocampus in aged rats induced by D-galactose[J].Journal Medicine Theory&Practice,2006,19(5):497-499.(in Chinese)
[7]Chen Jung-chou,Lu Kung-wen,Tsai M L,et al.Gypenosides induced G0/G1 arrest via CHk2 and apoptosis through endoplasmic reticulum stress and mitochondria-dependent pathways in human tongue cancer SCC-4 cells[J].Oral Oncology,2009,45(3):273-283.
[8]Schild L,Chen Bing-huei,Makarov P,et al.Selective induction of apoptosis in glioma tumour cells by a Gynostemma pentaphyllum extract[J].Phytomedicine,2010,17(8):589-597.
[9]Nguyen P H,Gauhar R,Hwang S L,et al.New dammarane-type glucosides as potential activators of AMP-activated protein kinase (AMPK)from Gynostemma pentaphyllum[J].Bioorganic&Medicinal Chemistry,2011,19(21):6254-6260.
[10]Tom H H,Valentina R N,Noeris K S,et al.A novel LXR-α activator identified from the natural product Gynostemma pentaphyllum[J].Biochemical Pharmacology,2005,70(9):1298-1308.
[11]陈忠仁,张永田.福建省绞股蓝资源植物[J].亚热带植物通讯,1992,21(1):51-53.CHEN Zhong-ren,ZHANG Yong-tian.The natural resource of Gynostemma pentaphyllum in Fujian province[J].Subtropical Plant Science,1992,21(1):51-53.(in Chinese)
[12]蒋伟哲,周燕文,李锦燊.广西 6 种绞股蓝中总皂苷的含量比较[J].中国药业,2006,15(3):26-27.JIANG Wei-zhe,ZHOU Yan-wen,LI Jin-shen.Comparision of total saponin contents in gynostemma cultivated of Guangxi[J].China Pharmaceuticals,2006,15(3):26-27.(in Chinese)
[13]刘学湘,陈建伟.中药有效成分生物转化的研究进展[J].食品与生物技术学报,2008,27(2):14-18.LIU Xue-xiang,CHEN Jian-wei.Research progress of chinese medicine effective component biotransformation[J].Journal of Food Science and Biotechnology,2008,27(2):14-18.(in Chinese)

