侵染广东黄秋葵的木尔坦棉花曲叶病毒及伴随卫星DNA的分子特征
董 迪,朱艳华,何自福,柴兆祥,佘小漫,罗方芳
(1 广东省农业科学院植物保护研究所,广东广州 510640;2 甘肃农业大学草业学院,甘肃兰州 730070)
双生病毒科Geminiviridae菜豆金色花叶病毒属Begomovirus病毒是一类由烟粉虱Bemisia tabaci以持久方式传播的单链DNA病毒[1],已在以色列、巴基斯坦、印度、美国、中国、非洲和加勒比海等多个国家和地区的番茄、棉花、木薯和菜豆等多种作物上造成毁灭性危害.近年来,我国广西、云南、广东、江苏和浙江等地的番茄[2-5]、烟草[6]、番木瓜[7]和朱槿[8]等作物上先后发现多种该属病毒的严重为害.
黄秋葵Abelmoschus esculentu(L.)Moench又名羊角豆和秋葵等,属锦葵科秋葵属,生长于热带、亚热带和地中海气候地带,在印度、巴基斯坦、美国、埃及、尼日利亚、希腊和土耳其等国广泛种植,是一种深受欢迎的蔬菜作物.黄脉花叶病或曲叶病是黄秋葵生产上主要病害,由黄秋葵黄脉花叶病毒(Okra yellow vein mosaic virus,OYVMV)、秋葵黄脉花叶病毒(Bhendi yellow vein mosaic virus,BYVMV)、黄秋葵曲叶病毒(Okra leaf curl virus,OkLCV)、杰济拉棉花曲叶病毒(Cotton leaf curl Gezira virus,CLCuGV)或木尔坦棉花曲叶病毒(Cotton leaf curl Multan virus,CLCuMV)等侵染引起,其中OYVMV和BYVMV是生产上最主要制约因子[9-10].上述这些病毒均属菜豆金色花叶病毒属.
近年来,中国大陆从中国台湾及日本引进黄秋葵种植.目前,在广东、北京、上海、山东、江苏、浙江、海南和福建等地均有栽培.2008年,笔者首次在广东省广州市花都区蔬菜基地发现黄秋葵黄脉曲叶病.PCR检测[11]及室内烟粉虱传毒试验均证明病株中存在菜豆金色花叶病毒属病毒.为了明确侵染引起广东黄秋葵黄脉曲叶病的病原病毒种类,以及进一步防治该病害提供依据,我们对该病毒代表分离物的基因组进行了克隆与序列分析.
1 材料与方法
1.1 毒源
黄秋葵黄脉曲叶病样采自广东省广州市花都区花东蔬菜基地.以室内介体烟粉虱传毒获得的病毒分离物Okra06作为毒源进行基因克隆.
1.2 DNA 提取
采用 2%CTAB 法[12]提取病株总 DNA,作为PCR模板.
1.3 PCR扩增、克隆和序列测定
利用菜豆金色花叶病毒属病毒特异简并引物AV494和CoPR[13-14]进行 PCR 扩增,获得 DNA-A 上570 bp大小的片段,将该片段进行克隆、序列测定和比较分析.根据该片段序列又设计了1对特异引物OPL1(5'-accaggaatcacacgaattcggtc-3')和OPR1(5'-accgacaccacgagtaacatcaga-3'),用于扩增DNA-A近全长序列,将PCR特异片段进行克隆、测序与分析.
应用菜豆金色花叶病毒属病毒卫星分子DNA β特异引物 β01 和 β02[15],PCR 扩增获得 DNA β 全长序列,进行克隆和序列测定;再根据测得的序列设计1对反向引物 β03(5'-gacccaaacactttcaacccatta-3')和β04(5'-atttgatgagcgatggtgacttgg-3'),扩增包括引物β01和β02序列区在内约1000 bp的片段,加以验证.
上述各PCR产物分离纯化后,分别克隆到pMD-18T载体[宝生物工程(大连)有限公司]上,随机各挑选3个克隆进行序列测定.引物由宝生物工程(大连)有限公司合成,序列测定由上海英骏生物技术有限公司完成.
1.4 序列分析
通过上述方法分别获得分离物Okra06的DNAA和DNA β全长序列.利用BLAST程序在GenBank中对这2个序列进行相似性检索,利用 DNAStar MegAlign 5.01(DNASTAR Inc.)Clustal W 方法进行多序列比较分析,并构建系统进化树.
2 结果与分析
2.1 黄秋葵黄脉曲叶病症状
病株表现为矮化,病株叶片向上或向下卷曲、叶背面叶脉呈网状突起,对着光可见其叶支脉呈墨绿色或存在墨绿色的线条(图1A、1B).病株后期,叶片从边缘开始逐步退绿黄化,叶正面的叶脉黄化明显、背面叶脉肿大(图1C、1D).
2.2 病毒分离物Okra06基因组DNA-A全序列及特征

图1 黄秋葵黄脉曲叶病症状Fig.1 The symptoms of okra yellow vein and leaf curl disease
利用菜豆金色花叶病毒属病毒特异简并引物AV494和CoPR,从病毒分离物Okra06病株总DNA中PCR扩增获得1条预期大小的DNA片段.序列分析显示,该片段长为570 bp;在GenBank中,与其有较高相似性的均为菜豆金色花叶病毒属病毒,其中与CLCuMV分离物G6[8]的相似性最高(99%),说明分离物Okra06也应属菜豆金色花叶病毒属.为此,根据该片段序列,又设计了一对特异引物OPL1和OPR1,PCR扩增出一条预期大小约2600 bp DNA片段,健康对照未扩增出任何片段.序列测定结果显示,该片段长为2614 bp.上述2个DNA片段序列重叠部分核苷酸序列完全一致,拼接后得到分离物Okra06的DNA-A全序列长为2737 nt(GenBank登录号:FJ770370).
Okra06 DNA-A具有菜豆金色花叶病毒属病毒基因组典型特征,为闭合环状单链DNA,推导编码6个ORFs,分别是病毒链上的AV1基因(位于276~1046 nt)、AV2基因(位于116~481 nt)以及互补链上的AC1基因(位于1495~2586 nt)、AC2基因(位于1146~1598 nt)、AC3基因(位于1049~1453 nt)和AC4基因(位于2127~2429 nt),在AV2与AC1之间有266 nt(位于2587~115 nt)的基因间隔区(Intergenic region,IR),该区域中含有病毒复制和转录所需的调控元件,包括11 nt茎和11 nt环的茎环结构(2717~13 nt),保守的TAATATTAC序列.
2.3 分离物Okra06 DNA-A与其他双生病毒的相似性比较结果
BLAST检索结果表明,GenBank中与分离物Okra06 DNA-A有同源关系的序列均属菜豆金色花叶病毒属病毒,其中相似性较高的病毒共有15种49个分离物或株系(表1),它们分别是可侵染棉花的CLCuMV、CLCuGV、拉贾斯坦棉花曲叶病毒(Cotton leaf curl Rajasthan virus,CLCuRV)、布里瓦拉棉花曲叶病毒(Cotton leaf curl Burewala virus,CLCuBuV)、班加罗尔棉花曲叶病毒(Cotton leaf curl Bangalore virus,CLCuBV)和阿拉巴德棉花曲叶病毒(Cotton leaf curl Alabad virus,CLCuAV)等6种病毒,以及可侵染黄秋葵或秋葵的 CLCuGV、OYVMV、OkLCV、BYVMV、黄秋葵黄化皱缩病毒(Okra yellow crinkle virus,OYCrV)、伊瓜拉黄秋葵黄斑驳病毒(Okra yellow mottle Iguala virus,OYMIV)、黄秋葵斑驳病毒(Okra mottle virus,OkMoV)、德里秋葵黄脉病毒(Bhendi yellow vein Delhi virus,BYVDV)、布巴内斯瓦尔秋葵黄脉病毒(Bhendi yellow vein Bhubhaneswar virus,BYVBV)和哈里亚纳秋葵黄脉病毒(Bhendi yellow vein Haryana virus,BYVHV)等10 种病毒.
分离物Okra06与上述49个病毒分离物DNA-A全序列比较结果显示:Okra06与CLCuMV 17个分离物DNA-A的相似性均大于89%,其中与分离物G6的相似性最高,为 99.7%;二者 AV1、AV2、AC1、AC2、AC3和 AC4基因的相似性分别为 100%、100%、99.6%、99.8%、100%和99.7%,即使菜豆金色花叶病毒属基因组中最易变异的IR区相似性也达98.9%,推导编码的6个蛋白质氨基酸序列相似性为99.0% ~100%.除与 CLCuRV-[Sirsa:04]和OYCrV-[Cameroon]的相似性为89.0%外,Okra06与 CLCuRV(Abohar、Sri)、CLCuBuV、CLCuAV、BYVMV、OYVMV、CLCuBV、BYVDV、BYVHV 和BYVBV等9个病毒22个分离物的相似性仅为77.4% ~86.3%,而与 OYCrV -[Mali]、CLCuGV、OYMIV、OkLCV及OkMoV等5个病毒8个分离物的相似性均小于70%(63.1% ~69.0%)(表1).
2.4 卫星分子DNA β结构及相似性比较结果
应用菜豆金色花叶病毒属病毒卫星分子DAN β的特异引物 β01和 β02,从分离物 Okra06病株总DNA中PCR扩增获得一条1321 bp DNA片段,而健康对照无任何扩增片段,克隆测序后得到该片段序列.相邻反向引物β03和β04 PCR扩增获得的特异片段长为1026 bp,该片段与β01/β02扩增获得的片段序列重叠,二者除2 bp差异(由引物β01和β02引入,位于引物近5'端)外,其余序列完全一致.因此,拼接后获得Okra06 DNA β全长序列为1346 nt(GenBank登录号为:FJ770371).
该序列为闭合环状单链DNA,推导在其互补链上有一个ORF(位于193~549 nt),编码含118个氨基酸的C1蛋白,在764~994位核苷酸之间富含A,在1246~15位核苷酸之间含有一个长为115 nt的保守区域(Conserved region,CR),CR区含有双生病毒科病毒共有的茎环结构和TAATATTAC序列.
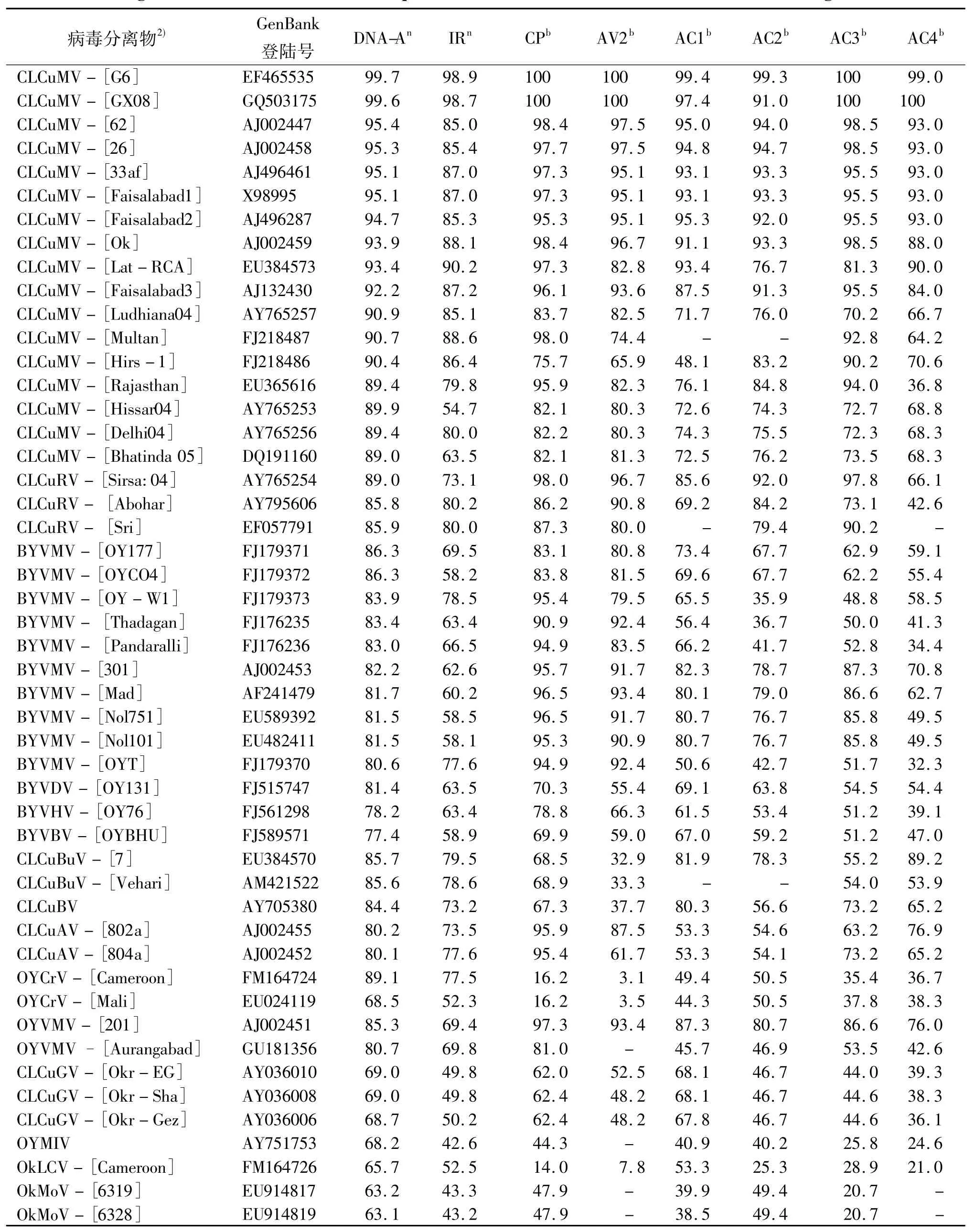
表1 Okra06与49个菜豆金色花叶病毒属病毒分离物或株系DNA-A及各基因编码的氨基酸序列相似性比较1)Tab.1 Percentages of nucleotide or amino acid sequences identities between Okra06 and 49 isolates of begomoviruses %
BLAST检索及序列相似性比较表明,Okra06 DNA β与伴随菜豆金色花叶病毒属10种36个DNA β卫星分子的相似性较高,其中与CLCuMV-[G6]DNA β序列相似性最高(为99.5%),与CLCuMV-[Gx08]DNA β相似性也达到 99.3%;与伴随CLCuMV的其他12个DNA β及伴随CLCuV的8个DNA β相似性为82.6% ~92.2%;而与侵染黄秋葵或秋葵的 BYVMV、OYVMV、OkLCuMV、OkLCV、CLCuGV等5种病毒伴随的7个DNA β相似性仅有48.9% ~58.7%.该卫星分子与CLCuMV-[G6]编码的C1氨基酸相似性也是最高,为100%.CR是DNA β中最保守的区域,Okra06与伴随CLCuMV、CLCuV、CLCuBuV、新德里番茄曲叶病毒(Tomato leaf curl New Delhi virus,ToLCNDV)、玫瑰茄黄脉花叶病毒(Mesta yellow vein mosaic virus,MYVMV)和云南赛葵黄脉病毒(Malvastrum yellow vein Yunnan virus,MaYVV)等6种病毒的26个DNA β的CR相似性均大于88.9%;但与伴随侵染黄秋葵或秋葵的OYVMV等5种病毒7个DNA β的CR相似性均不超过44.5%.
系统进化关系分析结果显示,Okra06 DNA β与CLCuMV -[G6]DNA β、CLCuMV - [Gx08]DNA β亲缘关系最近,三者形成一个独立分支;进一步与其他12个CLCuMV DNA β 及8个CLCuV DNA β 聚类在一起,而与侵染黄秋葵或秋葵的 BYVMV、OYVMV、OkLCuMV等病毒的DNA β亲缘关系均相对较远(图2).
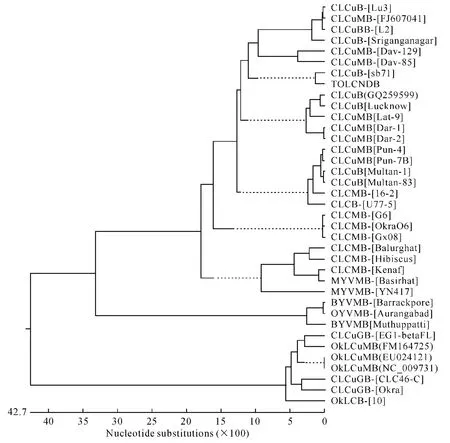
图2 Okra06 DNA β与伴随菜豆金色花叶病毒属病毒36个DNA β的系统关系树Fig 2 Phylogenetic tree of DNA β of Okra06 and 36 other Begomoviruses
3 讨论与结论
对来自广东黄秋葵黄脉曲叶病株的病毒分离物Okra06基因组DNA-A全序列进行了分析,其具有菜豆金色花叶病毒属单组分病毒基因组典型特征,且与已登陆GenBank中CLCuMV各分离物的相似性均大于89%,其中与分离物G6的相似性最高,达99.7%.根据目前双生病毒科病毒分类标准[16],分离物Okra06应属于菜豆金色花叶病毒属的木尔坦棉花曲叶病毒种(CLCuMV).
该病毒分离物也伴随有卫星DNA β,其大小约为DNA-A的一半,除茎环结构和TAATATTAC序列外,与病毒DNA-A无序列同源性.菜豆金色花叶病毒属病毒伴随的DNA β分子中含有一个115个核苷酸的保守区,推测是辅助病毒DNA-A编码的复制蛋白识别作用位点[17],Okra06 DNA β也不例外地含有该保守区.Okra06 DNA β还含一个约230个核苷酸A-rich区,该区域可能与DNA β分子包装过程中的尺寸要求有关[18].该卫星分子与侵染棉花的CLCuMV、CLCuV、CLCuBuV 病毒的 DNA β 分子相似性较高(大于82.6%),其中与同是分离自广东省广州市的 CLCuMV-[G6]DNA β序列相似性最高(99.5%),与来自中国广西的 CLCuMV-[Gx08]DNA β相似性也高达99.3%;但与侵染黄秋葵或秋葵 的 BYVMV、OYVMV、OkLCuMV、OkLCV 和CLCuGV等5种病毒DNA β相似性仅有48.9% ~58.7%.这说明伴随 CLCuMV侵染广东黄秋葵的DNA β与世界上其他地区侵染黄秋葵的菜豆金色花叶病毒属病毒卫星分子是不同的.另外,对来自广东、广西不同地理区域的CLCuMV多个分离物研究还发现,其DNA-A及伴随的DNA β分子序列相似性高达98% ~100%,变异很小(结果待发表),说明发生在我国的 CLCuMV DNA β(即 Okra06 DAN β 和G6 DNA β)与其辅助病毒CLCuMV稳定伴随.
应用菜豆金色花叶病毒属病毒基因组B组分特异引物[10,19-20]进行 PCR,未能在 Okra06 中检测到该组分的存在.目前,已报道的CLCuMV均仅有A组分,而且发现含卫星 DNA β分子的双生病毒CLCuMV、CLCuBV、CLCuGV、BYVMV 和 OYVMV 等也均为单组分病毒[16].同时,农杆菌介导的侵染性克隆接种试验结果证明,Okra06 DNA-A和DNA β混合接种即可引起本生烟Nicotiana benthamiana产生曲叶症状(文中未显示).因此,笔者认为:侵染广东黄秋葵的CLCuMV分离物Okra06也是一个单组分菜豆金色花叶病毒属病毒.
CLCuMV-[G6]是在我国发现的第一个CLCuMV分离物[8],该分离物侵染锦葵科黄槿属朱槿Hibiscus rosa-sinensis Linn.(又称为扶桑、大红花等)引起曲叶病[8];随后,将分离自我国朱槿的CLCuMV各分离物称之为朱槿株系,该株系分离物可侵染朱槿、棉花引起曲叶病[21-22].本研究证明侵染黄秋葵的Okra06也是CLCuMV,而且该分离物与朱槿分离物G6相似性高达99.7%.因此,我们认为,侵染广东黄秋葵引起黄脉曲叶病Okra06与先前报道的CLCuMV-[G6][8]同属木尔坦棉花曲叶病毒朱槿株系.
根据目前文献,可侵染黄秋葵的菜豆金色花叶病毒属病毒至少有11个种或暂定种,其中CLCuMV-[Ok](AJ002459)与Okra06的相似性为93.9%,说 明 二 者 间 仍 存 在 一 定 差 异;OYVMV[9]、BYVMV[10]、BYVDV、BYVHV、BYVBV 与 Okra06 为害黄秋葵或秋葵的症状相似,但其相似性只有77.4% ~86.3%,表明Okra06与它们明显不同;而OYCrV、OYMIV、OkLCV、OkMoV 和 CLCuGV 与Okra06的相似性为63.1% ~89.1%,说明这5种病毒与Okra06亲缘关系也较远.因此,引起广东黄秋葵黄脉曲叶病的病毒分离物Okra06与世界其他地区报道可侵染黄秋葵的菜豆金色花叶病毒属病毒是不同的.
棉花曲叶病毒是棉花上的毁灭性病害.该病害最先(1967年)发生在巴基斯坦木尔坦地区(Multan),并于20世纪80年代末在巴基斯坦木尔坦地区开始流行,其后快速扩散到该国其他棉区及印度[20].该病害是多种菜豆金色花叶病毒属病毒侵染引起的,其中CLCuMV是引起巴基斯坦和印度棉花曲叶病大流行的主要病原病毒之一[21].在我国,目前各棉区还未发生棉花曲叶病毒病,但现已在我国广东和广西表现为曲叶症状的朱槿和表现黄脉曲叶症状的黄秋葵病株上分别检测鉴定到 CLCuMV[8,22];更为重要的是,近期在广西某个试验田中发现了由CLCuMV自然侵染引起的棉花曲叶病植株[23].虽然广东、广西等华南地区极少种植棉花,发生在广东和广西的CLCuMV不会立即传播到我国棉花产区,但该病毒传播介体烟粉虱在我国华南地区、长江流域和黄河流域等普遍发生,通过介体烟粉虱带毒传播到我国棉区是完全有可能的.因此,入侵广东和广西并已定殖的CLCuMV对我国棉花生产构成了严重威胁[21],应引起我国有关部门的高度重视.
[1]FAUQUET C M,MAYO M A,MANILOFF J,et al.Virus Taxonomy:Ⅷth Report of the International Committee on Taxonomy of Viruses[M].London:Academic Press,2005:301-326.
[2]刘玉乐,蔡健和,李冬玲,等.中国番茄黄化曲叶病毒:一个双生病毒新种[J].中国科学:C辑,1998,28(2):148-153.
[3]何自福,虞皓,罗方芳.广东番茄曲叶病毒G3分离物基因组 DNA-A的分子特征[J].植物病理学报.2005,35(3):208-213.
[4]孙海霞,季英华,熊如意,等.2008年侵染江苏省番茄的粉虱传双生病毒发生分布[J].江苏农业学报,2009,25(6):1278-1281.
[5]吴永汉,张纯胄,许方程,等.温州地区番茄曲叶病毒病发生与防治[J].中国蔬菜,2007(5):57-58.
[6]谢艳,周雪平,张仲凯,等.从云南分离的烟草曲顶病毒为菜豆金色花叶病毒属的一个新种[J].科学通报,2001,46(17):1459-1462.
[7]张鲁斌,周国辉,李华平,等.侵染广州番木瓜的曲叶病毒DNA-A分子特征及生物学测定[J].中国农业科学,2005,38(9):1805-1810.
[8]毛明杰,何自福,虞皓,等.侵染朱槿的木尔坦棉花曲叶病毒及其卫星DNA全基因组结构特征[J].病毒学报,2008,24(1):64-68.
[9]ALI M,HOSSAIN M Z,SARKER N C.Inheritance of yellow vein mosaic virus(YVMV)tolerance in a cultivar of okra(Abelmoschus esculentus(L.)Moench) [J].Euphytica,2000,111:205-209.
[10]JOSE J,USHA R.Bhendi yellow vein mosaic disease in India is caused by association of a DNA β satellite with a Begomovirus[J].Virology,2003,305(2):310-317.
[11]董迪,何自福,柴兆祥.广东黄秋葵黄脉曲叶病样中检测到烟粉虱传双生病毒[J].植物保护,2010,36(1):65-68.
[12]DOYLE J J,DOYLE J L.Isolation of plant DNA from fresh tissue[J].Focus,1990,12:13-15.
[13]何自福,虞皓,罗方芳.番茄烟粉虱传双生病毒PCR检测[J].中国病毒学,2004,19:67-69.
[14]WYATT S D,BROWN J K.Detection of subgroup III geminivirus isolates in leaf extracts by degenerate primers and polymerase chain reaction [J]. Phytopathology,1996,86(12):1288-1293.
[15]ZHOU Xue-ping,XIE Yan,TAO Xiao-rong,et al.Characterization of DNA β associated with begomoviruses in China and evidence for co-evolution with their cognate viral DNA-A[J].J Gen Virol,2003,84:237-247.
[16]FAUQUET C M,BRIDDON R W,BROWN J K,et al.Geminivirus strain demarcation and nomenclature [J].Archives of Virology,2008,153:783-821.
[17]BRIDDON R W,MANSOOR S,BEDFORD I D,et al.Identification of DNA components required for induction of cotton leaf curl disease[J].Virology,2001,285:234 ~243.
[18]SAUNDERS K R,BRIDDON W,STANLEY J.Replication promiscuity of DNA-β satellites associated with monopartite begomoviruses,deletion mutagenesis of the Ageratum yellow vein virus DNA-β satellite localizes sequences involved in replication[J].J Gen Virol,2008,9:3165-3172.
[19]ROJAS M R,GILBERTSON R L,RUSSELL D R,et al.Use of degenerate primers in the polymerase chain reaction to detect whitefly transmitted geminiviruses[J].Plant Disease,1993,77:340-347.
[20]BRIDDON R W,MARKHAM P G.Cotton leaf curl virus disease[J].Virus Research,2000,71:151-159.
[21]何自福,董迪,李世访,等,木尔坦棉花曲叶病毒已对我国的棉花生产构成严重威胁[J].植物保护,2010,36(2):147-149.
[22]林林,胡冬梅,蔡健和,等.侵染南宁市朱槿的木尔坦棉花曲叶病毒基因组结构及寄主范围研究[C]∥彭友良,朱有勇.中国植物病理学会2009年学术年会论文集.北京:中国农业科学技术出版社,2009:336.
[23]CAI J H,XIE K,LIN L,et al.Cotton leaf curl Multan virus newly reported to be associated with cotton leaf curl disease in China[J].Plant Pathology,2010,59(4):794-795.

