女性初潮前后骨代谢生化因子与雌激素、瘦体重相关分析
何淑敏 赵仁清 陈明
1 温州大学体育学院(浙江温州 325035) 2 浙江师范大学体育与健康科学学院
初潮是女性骨骼生长发育的关键时期[1],但这个时期的骨代谢变化特征及其与何因素有关,尚不明了。骨钙素(osteocalcin,OC)、骨碱性磷酸酶(bone-speci fic alkaline phosphatase,BAP) 和抗酒石酸酸性磷酸酶(tartrat-resistant acid phosphatase,TRAP)是骨组织产生的代谢活性物质[2-4],反映骨组织合成和分解代谢的变化。探讨初潮前后这些代谢活性物质的变化有助于了解骨组织合成、分解代谢的特征。雌激素、雄激素和肌肉力量是影响骨代谢的重要因素[1],但初潮时期它们的变化与骨代谢的关系仍不清楚。本文采用线性回归及偏相关分析探讨在女性初潮前后骨代谢生化因子的变化特征及其相关影响因素,对于青春期女性骨骼健康有重要意义。
1 对象和方法
1.1 研究对象
受试者为浙江温州地区120名小学生,首先填写一份个人信息表,主要了解出生日期、联系方式、疾病史及外伤史等一般情况,并进行一般体格检查,排除有影响骨代谢的疾病史(主要有先天性心脏病、肾脏系统疾病、糖尿病、代谢性疾病、结缔组织病等)及近期使用影响骨代谢的药物。115名女孩符合条件参加本项研究。向受试者和家长介绍实验的过程,并取得家长的同意和学生的配合。
1.2 实验设计
本实验为两部分。首先测量115名受试者相关指标,包括身高(H)(反映骨骼纵向生长变化)、体重(W)、脂肪含量(FM)、瘦体重含量(LM)(反应全身肌肉力量的发育情况),血清雌二醇(E2)、睾酮(T)、性激素结合蛋白(SHBG)等相关激素及血清骨代谢生化因子OC、BAP和TRAP。测量完成后对全部受试者进行随访调查,获取其初潮时间,计算每个受试者在测量时相距初潮的时间,以此为自变量,拟合骨代谢生化因子及相关指标的回归曲线方程。
1.3 测试方法
采用HW-600B电子身高体重测量仪(中国郑州凯元电子有限公司)测量体重、身高。体重数值精确到0.1 kg,身高精确到0.5 cm。
采用BOD POD S/T身体成分分析仪(美国)测量瘦体重和脂肪含量。
于早晨6~8点采集血液标本,在水浴箱中凝固后取血清置-20℃冰箱中待测。
采用酶联免疫法测定血清E2和T,上海西唐生物科技有限公司提供试剂盒。E2组内和组间误差分别为8.5%和13.3%,T分别为5.4%和8.2%。采用酶联免疫法测定血清SHBG、OC、BAP和TRAP,上海沪尚生物科技有限公司提供试剂盒。SHBG组内和组间误差分别为3.3%和5.3%,OC分别为4%和6%,BAP分别为10%和10%,TRAP分别为3.9%和5.1%。
1.4 统计学分析
采用 SAS 8.1(SAS Institute Inc.,Cary,NC,USA)统计软件进行数据分析。数据采用组平均值和标准差进行描述。随访获得女孩初潮时间,计算每位受试者测量时相距初潮的时间,以此作为自变量(independent variables)(时间轴),拟合骨代谢生化标志物及其相关指标的回归曲线。采用偏相关方法分析身高、雌二醇、睾酮、性激素结合蛋白和瘦体重含量与骨代谢生化标记物之间的相关性,并排除年龄、身高和体重等因素的影响。P< 0.05为有显著性差异。
2 结果
2.1 受试者生理化指标测试结果
表1是115名受试者参加实验时的平均年龄、身高、体重、FM、LM,血清E2、T、SHBG及骨代谢生化标志物TRAP、BAP和OC的测试结果。
2.2 骨代谢生化因子、雌激素、身高、瘦体重含量的增长曲线(图1~图6)
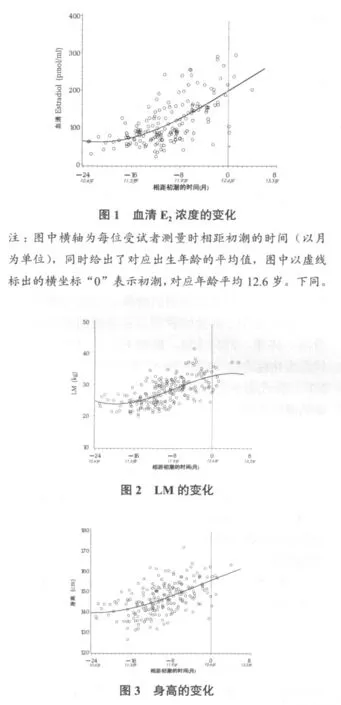
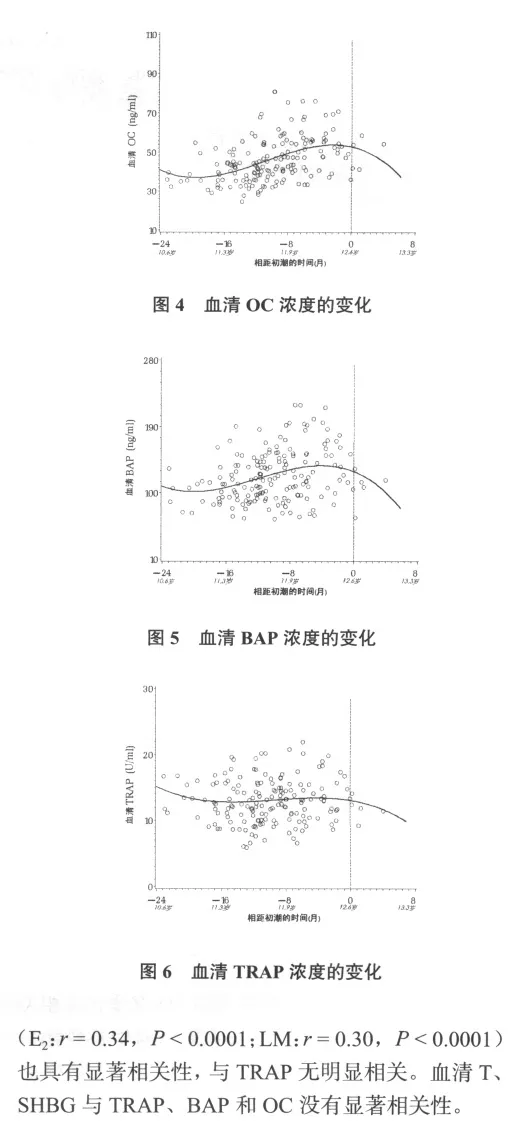
女孩初潮之前,血清E2、LM从之前较低的水平迅速增加(图1、2),接近初潮时,E2增加的速度加快,而LM在初潮时则减慢了增长速度,接近最高值。血清OC和BAP在初潮前呈现增加趋势(图4、5),但在临近初潮时由原来的升高转为下降,而血清TRAP无论在初潮之前还是在初潮时期均呈持续下降趋势(图6)。
2.3 骨代谢生化因子与身高、性激素、结合蛋白及瘦体重含量的相关分析
表2显示,从初潮前至初潮,H与BAP(r= 0.22,P= 0.001)、OC(r= 0.21,P= 0.002)和 TRAP(r= 0.14,P= 0.04)显著相关,而 E2、LM 与 BAP(E2:r= 0.2,P= 0.003;LM :r= 0.15,P= 0.029)、OC

表1 受试者生理生化指标测试结果(n = 115)
3 讨论
骨代谢生化标志物与骨骼发育程度紧密相关[5,6]。初潮前后,随着骨骼向成熟转变,骨代谢也可能出现相应的变化。本研究结果显示:一直呈增长趋势的血清OC、BAP在接近初潮时与血清TRAP一起呈下降趋势,反映这个时期骨合成和分解代谢明显减慢。这说明以高代谢率为特征的骨骼快速生长期(青春前期及早期)在女孩初潮时已近尾声,取之以骨代谢率减慢的发育成熟、矿物质大量沉积为特征的成熟阶段。有文献报道,在青春前期和早期的骨骼快速生长阶段,一些骨代谢生化标志物明显增高,而在青春期成熟阶段迅速下降[1],这与本研究结果一致。本研究对骨合成、分解代谢生化标志物进行综合探讨,表明骨代谢分解过程和合成过程都出现明显减慢的趋势,说明初潮是骨代谢变化的关键转折点。

表2 身高、雌二醇等与骨代谢生化标志物的相关分析
身高反映长骨生长变化,其变化本质是骨骼生长速度的变化,因此,探讨身高与骨代谢生化标志物相关性是从另一个角度研究骨骼生长变化与骨代谢之间的关系[1]。有报道,青春期某些骨代谢生化标志物变化与身高的增长呈正相关[7]。但青春期跨越时间长(包括青春前期、早期、中期和成熟期),其不同发育阶段骨骼生长发育的变化差异十分巨大,把整个青春期作为自变量研究就忽略了各生长阶段的特点和差异,因此,针对青春期特定发育阶段进行研究十分必要。本实验结果显示,女孩身高增长与BAP、OC和TRAP高度相关,说明身高在初潮时期的变化与骨合成、分解代谢关系密切,即骨骼的生长速度与骨代谢密切相关。Szulc[8]的研究也表明,骨代谢生化标志物的变化与身高的快速增长高度相关。身高与骨代谢之间的相关性主要由于身高增长速率在初潮前14个月达到最高,之后迅速下降[9],近初潮时增长速度明显减慢,骨代谢速度也下降。
雌激素是促进骨骼生长发育的重要激素[1]。本实验结果显示,血清E2与BAP和OC高度正相关,增长曲线显示,OC、BAP从青春早期到初潮前均呈上升趋势,此时雌激素也快速增加,二者之间显著正相关,表明初潮前雌激素是骨代谢重要的调节因素。接近初潮时OC、BAP迅速下降,而雌激素增长速度却提高,二者之间似乎存在负相关。本实验未检验初潮后的相关性,但这在其它报道中得到了证明。 Blumsohn等[6]报道青少年血清雌激素与骨代谢生化标志物呈高度负相关,其研究受试者是雌激素达到或接近分泌高峰的青春中、后期女孩(已经出现规律月经),此时雌激素对骨骼的影响体现在明显抑制骨代谢、促进成熟的作用,因此出现负相关。这表明雌激素对骨骼发育具有双重影响,低水平雌激素促进骨骼生长,而高浓度雌激素抑制骨骼生长、促进成熟[9]。
本实验结果显示,E2与TRAP无显著相关。TRAP是骨分解代谢过程中的产物,因此,提示这个时期低的雌激素水平不会显著抑制骨组织的吸收过程,而是促进骨代谢的合成过程(BAP和OC是骨合成代谢的产物)。这表明在青春期不同发育阶段,骨代谢生化标志物和雌激素的变化不一致,它们之间的关系也随着变化。Rotteveel等[10]的研究表明,雌激素与骨代谢生化标志物之间的相关性可能受青春期发育阶段影响,不同生长阶段其相关性也不同。本研究结果证明了这一观点。
肌肉力量是促进骨骼生长发育的重要因素,但目前尚无精确反映全身肌肉力量发展的指标,大多以瘦体重含量反映肌肉力量发育状况[11]。大量实验证明,瘦体重含量与骨密度、骨量的发育高度相关,是促进青少年骨骼生长发育的重要因素[12,13],但还不清楚肌肉力量与骨代谢之间的关系。本实验结果表明,初潮阶段LM与BAP、OC高度相关,与TRAP不相关,表明初潮期女孩肌肉力量是影响骨合成代谢、促进骨骼生长发育的重要因素。
虽然有文献报道血清T、SHBG是影响青少年骨骼生长发育的关键因素,但较少研究其对骨代谢的影响。此外,大多文献是关于青春期成熟阶段或成年人的研究[14,15],而较少针对初潮时期各因素间相关性的研究。本研究结果未发现在初潮阶段血清T、SHBG与BAP、OC和TRAP显著相关,原因可能有:初潮时期影响骨骼生长发育的因素可能来自T、SHBG以外;血清T、SHBG反映循环血中的水平,因而研究结果只提示循环血中T、SHBG对局部骨代谢无明显影响,但并不否定骨组织局部T变化对代谢的影响;由于激素调节骨骼生长发育的机制十分复杂,本研究结果可能提示,血清T、SHBG对女性青少年骨骼生长发育的影响可能不是直接调节骨代谢过程,而通过激发其它机制实现对骨骼生长发育的调节作用。
4 总结
女孩初潮时期骨代谢率减慢是重要特征,此时期身高增长与骨代谢密切相关,雌激素和肌肉力量是骨代谢的相关影响因素。
[1]Clarke BL and Khosla S. Female reproductive system and bone. Arch Biochem Biophys,2010,503(1):118-128.
[2]Turan S,Topcu B,Gokce I,et al. Serum alkaline phosphatase levels in healthy children and evaluation of alkaline phosphatase z-scores in different types of rickets.J Clin Res Pediatr Endocrinol,2011,3(1):7-11.
[3]Jurimae J. Interpretation and application of bone turnover markers in children and adolescents. Curr Opin Pediatr,2010,22(4):494-500.
[4]Gracia-Marco L,Vicente-Rodriguez G,Valtuena J,et al. Bone mass and bone metabolism markers during adolescence:The HELENA Study. Horm Res Paediatr,2010,74(5):339
[5]Parfitt AM,Travers R,Rauch F,et al. Structural and cellular changes during bone growth in healthy children.Bone,2000,27(4):487-494.
[6]Blumsohn A,Hannon RA,Wrate R,et al. Biochemical markers of bone turnover in girls during puberty. Clin Endocrinol(Oxf),1994(5),40 :663-670.
[7]Bollen AM. A prospective longitudinal study of urinary excretion of a bone resorption marker in adolescents. Ann Hum Biol,2000,27(2):199-211.
[8]Szulc P,Seeman E,Delmas PD. Biochemical measurements of bone turnover in children and adolescents. Osteoporos Int,2000,11(4):281-294.
[9]Juul A. The effects of oestrogens on linear bone growth.Hum Reprod Update,2001,7(3):303-313.
[10]Rotteveel J,Schoute E,Delemarre-van de Waal HA.Serum procollagen I carboxyterminal propeptide(PICP)levels through puberty:relation to height velocity and serum hormone levels. Acta Paediatr,1997,86(2):143-147.
[11]Warden SJ,Hurst JA,Sanders MS,et al. Bone adaptation to a mechanical loading program signi ficantly increases skeletal fatigue resistance. J Bone Miner Res,2005,20(5):809-816.
[12]Hawley NL,Rousham EK,Johnson W,et al. Determinants of relative skeletal maturity in South African children. Bone,2011,doi:10.1016,[Epub ahead of print].
[13]Pietrobelli A,Faith MS,Wang J,et al. Association of lean tissue and fat mass with bone mineral content in children and adolescents. Obes Res,2002,10(1):56-60.
[14]Lormeau C,Soudan B,d'Herbomez M,et al. Sex hormone-binding globulin,estradiol,and bone turnover markers in male osteoporosis. Bone,2004,34(6):933-939.
[15]Wang Q,Alen M,Nicholson PH,et al. Differential effects of sex hormones on peri- and endocortical bone surfaces in pubertal girls. J Clin Endocrinol Metab,2006,91(1):277-282.

