环丙沙星和磺胺二甲嘧啶在大菱鲆体内的药代动力学比较
孙爱荣,李 健,常志强,刘德月
(1.上海海洋大学水产与生命学院,上海 201306;
2.中国水产科学研究院黄海水产研究所,农业部海洋渔业资源可持续利用重点开放实验室,山东青岛 266071)
大菱鲆(Scophthalmus maximus),英文名为Turbot,是原产于欧洲沿海的一种名贵比目鱼,在中国又称多宝鱼,隶属于硬骨鱼类、鲽形目、鲆科、菱鲆属[1]。大菱鲆于1992年引入我国,由于其生长快,营养价值高等优点而成为我国北方特别是山东半岛地区的主要海水养殖鱼类。
环丙沙星(Ciprofloxacin)和磺胺二甲嘧啶(Sulfadimidine SM2),均具有广谱抗菌活性,杀菌效果好。目前已见环丙沙星在欧洲鳗鲡(Anguilla anguilla)[2]、中国对虾(Fenneropenaeus chinensis)[3]、奶山羊(Dairy goats)[4]、鲤(Cyprinus carpio)[5]、鳗鲡(Anguilla japonica)[6]、霉形体肺炎猪(Mycoplasma hyopneumoniae)[7]、山羊(Goats)[8]、猪(Pigs)[9]、肉仔鸡(Broiler Chickens)[10]、鲫(Carass Iusaratus)[11]等体内的药代动力学报道,而关于其在大菱鲆体内的药代动力学还未见相关报道。磺胺二甲嘧啶在黑 鮶 (Sebastodes fuscescens)[12]、银 鲫 (Carassius auratus gibelio)[13]、鲫鱼(Crucian Carp)[14]、大菱鲆(Scophthalmus maximus)[15]等体内的药代动力学已有报道。本试验主要研究环丙沙星和磺胺二甲嘧啶在大菱鲆体内的代谢动力学规律,对其主要参数进行了比较,并提出合理的给药方案,以期为指导大菱鲆养殖生产中的合理用药提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 健康大菱鲆(Scophthltmus maximus),体重(163±8.0)g,饲养于中国水产科学研究院黄海水产研究所烟台海阳实验基地。水温(23.1±0.8)℃,连续充气,流水条件下暂养两周,实验前检测无药物残留,投喂大菱鲆专用配合饲料。
1.1.2 试验药品及试剂 环丙沙星标准品(含量≥98.0%)、磺胺二甲嘧啶标准品(含量≥99.8%),Sigma公司;环丙沙星原药粉(含量≥94.9%),浙江新华制药有限公司;磺胺二甲嘧啶原粉(含量≥98.0%),青岛德邦药业有限公司;乙腈,Merck公司,磷酸、三乙胺,国药集团化学试剂有限公司;正己烷,天津市广成化学试剂有限公司。
1.1.3 试验仪器及设备 Agilent1100型高效液相色谱仪(HPLC):美国安捷伦科技公司生产;SB5200超声波清洗机:宁波新芝生物科技股份有限公司生产;HSC-24B型恒温水浴氮吹仪:天津市横奥科技发展有限公司生产;XHF-1型高速分散器:上海金达生化仪器有限公司生产。
1.2 试验方法
1.2.1 给药方法及采样 给药:给药时环丙沙星和磺胺二甲嘧啶原粉均用适量NaOH助溶,再用0.9%生理盐水配成所需浓度的药液。口服剂量20 mg/kg,用干净毛巾固定鱼体,用弃去针头的1 mL无菌注射器吸取药物水溶液灌入大菱鲆前胃,观察无回吐者用于试验。尾静脉注射剂量为10 mg/kg,用干净毛巾擦干鱼体左侧,酒精棉消毒后注射。
采样:分别于给药后的 0.083、0.25、0.5、1、2、4、6、8、12、16、24、36、48、60、72 h 尾静脉无菌取血,放入预先涂有10 g/L肝素钠的5 mL离心管,5000 r/min,离心10 min,取上层血浆,于-20℃冰箱保存。同时取肌肉、鳃、肾脏和肝脏等组织样品,于-20℃冰箱保存。同一时间点取6尾鱼。
1.2.2 样品预处理 血浆处理:血浆样品于室温下自然解冻后,摇匀后吸取1 mL于10 mL离心管,加入2 mL乙腈,漩涡振荡器振荡20 s,静置2 h,5000 r/min离心20 min,取上清液,于40℃恒温水浴下氮气吹干,1 mL流动相溶解残渣,加入2 mL正己烷去脂肪,振荡静置,弃去上层液体,下层液过0.22 μm的微孔滤膜,过滤后的液体进行高效液相色谱测定。
组织处理:组织样品于室温下自然解冻后,准确称取1 g组织(肌肉、鳃、肝脏、肾脏),2 mL乙腈,16000 r/min匀浆30 s,再用2 mL乙腈清洗刀头,合并两次提取液,振荡30 s,静置2 h,5000 r/min离心20 min,取上清液,于40℃恒温水浴下氮气吹干,1 mL流动相溶解残渣,加入2 mL正己烷去脂肪,振荡静置,弃去上层液体,下层液过0.22 μm的微孔滤膜,过滤后的液体进行高效液相色谱测定。
1.2.3 色谱条件 环丙沙星色谱条件如下:色谱柱为 Agilent TC-C18(4.6 mm ×250 mm,5 μm);流动相由乙腈和0.01 mol/L磷酸(用三乙胺调节至pH 3.42)按18∶82(V/V)的比例混合而成;荧光检测器的激发波长为282 nm,发射波长为452 nm;柱温30℃;流速1.0 mL/min,进样量20 μL。
磺胺二甲嘧啶色谱条件如下:色谱柱为Agilent TC-C18(4.6 mm ×250 mm,5 μm);流动相由乙腈和0.017 mol/L磷酸按20∶80(V/V)的比例混合而成;紫外检测器的检测波长为267 nm;柱温30℃;流速 1.0 mL/min,进样量20 μL。
1.2.4 线性范围 分别准确称取环丙沙星、磺胺二甲嘧啶标准品各0.01 g,用适量NaOH助溶,然后用流动相定容至100 mL,配成100 μg/mL的母液,再依次用流动相稀释成 50.00、10.00、5.00、2.00、1.00、0.50、0.20、0.10、0.05、0.02、0.01 μg/mL的标准溶液用HPLC进行检测,以浓度为横坐标,峰面积为纵坐标做标准曲线,进行回归分析,分别求出回归方程和相关系数。
1.2.5 回收率、精密度和最低检测限 取0.1、1、10 μg/mL三个浓度水平的环丙沙星、磺胺二甲嘧啶标准液各1 mL,分别加入1 g肌肉、鳃、肝脏、肾脏和1 mL血浆五种空白组织中,每个浓度有三个平行,按1.2.2处理样品后进行HPLC测定,按照公式进行计算:回收率(%)=(实测药物浓度/理论药物浓度)×100%。
将上述样品于一天内分别重复进样五次和分五天测定,计算3个浓度水平响应值峰面积的变异系数(CV%),以此衡量方法的精密度。
1.2.6 数据处理 采用DAS2.0药动学软件对药时数据进行分析,并计算主要参数(分布相半衰期t1/2α、消除相半衰期 t1/2β、曲线下面积 AUC、达峰时间 Tmax、峰浓度 Cmax)。
2 结果与分析
2.1 线性范围 环丙沙星标准液和磺胺二甲嘧啶标准液在0.01~50.00 μg/mL浓度范围内均有良好的相关性,线性回归方程分别为YCIP=667.66X+5.0977,R2=0.9997;YSM2=65.534X+3.4462,R2=0.9999。
2.2 回收率、精密度和最低检测限 实验条件下,环丙沙星在血浆、肌肉、鳃、肝脏和肾脏中的回收率分别为 88.22% ~99.37%、80.30% ~89.85%、83.67% ~88.72%、88.47% ~95.36%和 84.39% ~97.33%,日内精密度分别为 0.30% ~1.0%、1.15% ~2.18%、1.32% ~2.23%、0.63% ~1.58%和0.77% ~2.01%,日间精密度分别为2.30% ~5.08%、2.25% ~4.72%、2.48% ~4.81%、3.64% ~5.94%和3.81% ~6.45%,本方法的定量检测限为0.01 μg/mL;磺胺二甲嘧啶在血浆、肌肉、鳃、肝脏和肾脏中的回收率分别为92.88% ~105.30%、65.96% ~83.71%、80.75%~90.58%、88.91% ~98.61%和 90.31% ~97.89%,日内精密度分别为0.28% ~1.15%、1.23% ~2.52%、1.25% ~2.58%、0.89% ~2.02%和0.92% ~2.34%,日间精密度分别为2.31% ~5.34%、2.47% ~3.84%、2.53% ~4.55%、3.34% ~5.62%和3.52% ~5.81%,本方法的定量检测限为0.02 μg/mL,符合药物分析的要求。
2.3 环丙沙星和磺胺二甲嘧啶在大菱鲆体内的药-时曲线 大菱鲆静注和口服环丙沙星、磺胺二甲嘧啶后,其血浆、肌肉、鳃、肝脏和肾脏的药-时曲线分别见图1-图4。
2.4 环丙沙星和磺胺二甲嘧啶在大菱鲆体内的房室模型及药代动力学参数 大菱鲆分别以20 mg/kg剂量一次性口服和10 mg/kg剂量一次性静脉注射环丙沙星和磺胺二甲嘧啶后,其药时数据用DAS2.0软件进行分析处理,结果表明,口服给药药时数据均符合一级吸收二室开放模型,其药代动力学方程分别为:CCIP=14.811e-0.337t+4.028e-0.063t-18.839e-0.616t、CSM2=64.981e-0.141t+4.59e-0.004t-69.571e-0.19t;静注给药的药时数据均符合无级吸收二室开放模型,其药代动力学方程分别为:CCIP=21.784e-1.098t+1.514e-0.043t、CSM2=33.028e-5.687t+8.674e-0.013t。口服给药后主要药动学参数如表1和表2。
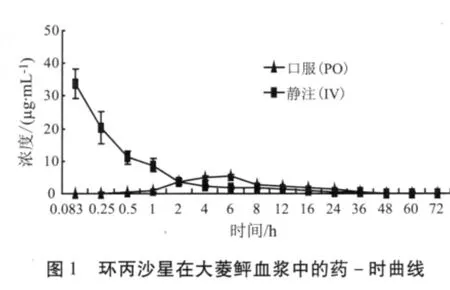
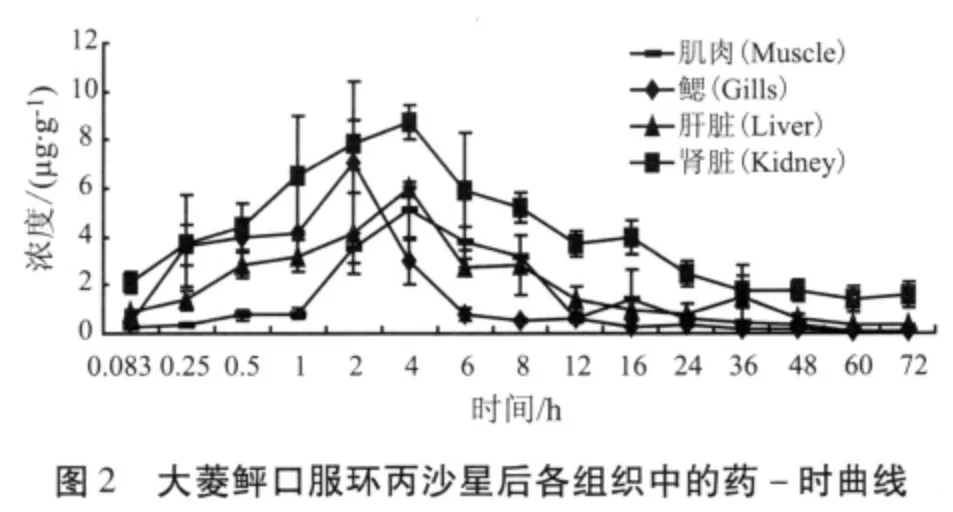
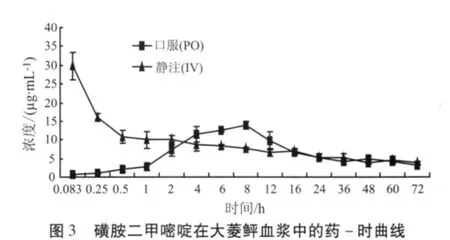


表1 环丙沙星在大菱鲆各组织中的主要药动学参数比较
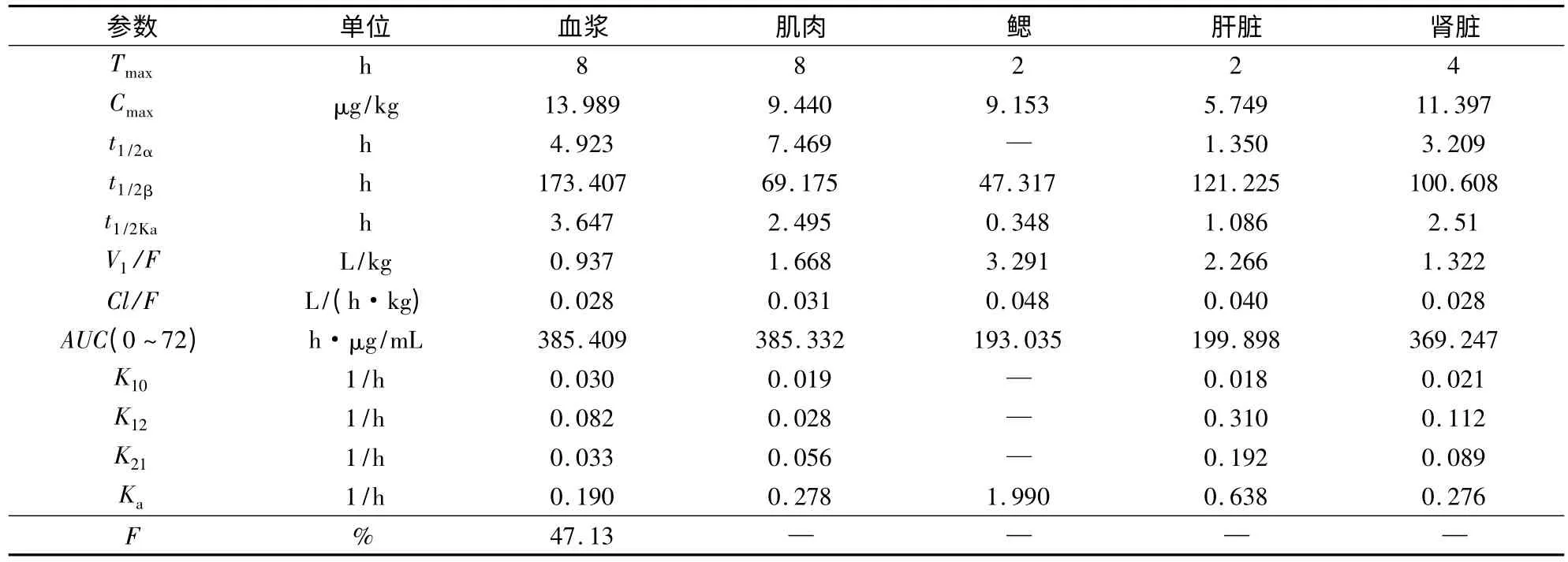
表2 磺胺二甲嘧啶在大菱鲆各组织中的主要药动学参数比较
3 讨论
3.1 环丙沙星和磺胺二甲嘧啶在大菱鲆体内的药代动力学规律比较
3.1.1 环丙沙星和磺胺二甲嘧啶在大菱鲆体内的吸收规律 通过本实验结果可以得出,大菱鲆静注环丙沙星和磺胺二甲嘧啶后血药房室模型均符合无级吸收二室开放模型,与环丙沙星静注健康奶山羊[4]、肉仔鸡[10]和磺胺二甲嘧啶静注猪[22]、星布罗鸡[23]、奶山羊[24]的房室模型获得结果一致,与环丙沙星静注鲤[5]不同;大菱鲆口服环丙沙星和磺胺二甲嘧啶后血药房室模型均符合一级吸收二室开放模型,与环丙沙星口服鲤[5]的相同,与大菱鲆[15]、黑鮶[12]、银鲫[13]、星布罗鸡[23]、鲫鱼[14]口服磺胺二甲嘧啶的房室模型不同,出现此结果可能是由生活环境因素和种属差异造成的。
大菱鲆口服环丙沙星和磺胺二甲嘧啶的血药达峰时间分别为6 h和8 h,大菱鲆口服环丙沙星后血药达峰时间明显慢于鲤(0.44 h)[5]、鳗鲡(2.33 h)[6]、猪(1.39 h)[9,16]、犊牛(2.3 h)[16]。大菱鲆口服磺胺二甲嘧啶后血药达峰时间慢于星布罗鸡(5.95 h)[23],与黑鮶(8 h)[12]相同,而快于鲫鱼(9.62 h)[14]。该结果与杨雨辉等[5]报道的喹诺酮类药物在冷水性鱼类体内的的吸收速度较慢是一致的。大菱鲆是冷水性鱼类,生活在水温较低的环境中,所以与其它动物对环丙沙星和磺胺二甲嘧啶的吸收存在差异。
大菱鲆口服环丙沙星和磺胺二甲嘧啶的吸收相半衰期分别为1.125 h和3.647 h,磺胺二甲嘧啶在大菱鲆体内的吸收相半衰期长于环丙沙星,且磺胺二甲嘧啶的吸收相半衰期长于黑鮶(1.69 h)[12]、银鲫(0.665 h)[13]、星布罗鸡(0.265 h)[23]、鲫鱼(0.782 h)[14],这说明同一生物体对于不同药物的吸收速度不同,环丙沙星在大菱鲆体内的吸收速度快于磺胺二甲嘧啶;同时同一种药物在不同的生物体的吸收速度也不同,磺胺二甲嘧啶在大菱鲆组织中的吸收速度慢于其它动物。
大菱鲆口服环丙沙星后,其生物利用度为60.57% ,低于人(70%)[17]、鸡(70.09%)[18],而高于猪(51.58%)[9]、牛(53%)[16]、马(6.8%)[19],这种现象主要是由物种的差异所造成的,大菱鲆口服磺胺二甲嘧啶后,其生物利用度为47.13%,低于环丙沙星在大菱鲆体内的生物利用度,环丙沙星的血浆蛋白结合率较低,且该药的脂溶性高,导致环丙沙星在大菱鲆体内的吸收度相对较为完全。
3.1.2 环丙沙星和磺胺二甲嘧啶在大菱鲆体内的分布规律 由表1、2可知,大菱鲆口服环丙沙星和磺胺二甲嘧啶的分布相半衰期分别为2.057 h和4.923 h,大菱鲆口服环丙沙星后,其分布相半衰期高于鲤(0.31 h)[5]、肉仔鸡(0.114 h)[10],环丙沙星分布速度快于磺胺二甲嘧啶。张长坤[24]等报道了在水温(15±1)℃条件下给大菱鲆(420±20)g以100 mg/kg的剂量灌服磺胺二甲嘧啶后,在血浆中的达峰时间(4 h)、吸收相半衰期(0.919 h)及消除相半衰期(8.8 h)均小于本实验的结果,且其药物的清除率0.142 L/(h·kg),大于本实验大菱鲆的清除率,大菱鲆的最适生长温度为(14~17)℃,可能是由于温度差异造成的;且成鱼的代谢速度较快,这与Kasuga报道的噁喹酸在虹鳟上的代谢相同。
环丙沙星口服给药后,鳃组织首先达到峰值,其次是肝脏,肾脏和肌肉,血浆最后达到峰值,药物在各个组织中的峰浓度为肾脏>鳃>肝脏>血浆>肌肉,磺胺二甲嘧啶给药后鳃和肝脏首先达到峰值,肾脏其次,血浆最后达到峰值,药物在组织中的含量为血浆>肾脏>肌肉>鳃>肝脏,说明在同一试验条件下,不同的药物在同一生物体内各个组织的分布特征不同。肝脏、鳃和肾脏组织具有丰富的毛细血管而且其渗透性较好,药物会首先到达这些组织,然后再向其他组织运转。药物在鳃组织的浓度较大,由此推出除肝脏和肾脏是鱼类的主要排泄器官外,鳃组织也可能是药物排泄的途径之一。
3.1.3 环丙沙星和磺胺二甲嘧啶在大菱鲆体内的消除规律 大菱鲆口服环丙沙星和磺胺二甲嘧啶的消除相半衰期分别为11.028 h和173.407 h,环丙沙星的消除相半衰期远远小于磺胺二甲嘧啶,环丙沙星消除速度快于磺胺二甲嘧啶。由表1可知大菱鲆口服环丙沙星后,其消除相半衰期大于鲤(6.47 h)[5]、鲫(4.59 h)[11]、人(3.5 ~ 5.4 h)、犊牛(8 h)、猪(3.1 h)[20]、猪(3.32 h)[9]、犬(4.3 h)[21],而远远小于鳗鲡(34.66 h)[6],说明口服环丙沙星在大菱鲆体内消除较缓慢。由表2可知,大菱鲆口服磺胺二甲嘧啶后,其消除相半衰期大于黑鮶(19.97 h)[12]、银鲫(12.961 h)[13]、星布罗鸡(6.973 h)[23]、鲫鱼(14.834 h)[14],说明在本实验条件下,磺胺二甲嘧啶在大菱鲆体内的代谢速度较慢,药物在体内存留的时间较长,同一药物在不同的生物体内代谢的规律不同。药物在生物体内的消除速度与药物本身的理化性质、蛋白质的结合率等因素有关,水产动物代谢药物的速度与水温有很大关系,一般情况下水温越低,代谢速度越慢,大菱鲆是冷水性鱼类,生活的环境水温较低,故环丙沙星和磺胺二甲嘧啶在大菱鲆体内的消除速率较慢。
环丙沙星在大菱鲆各个组织的消除相半衰期为肾脏>肝脏>肌肉>鳃>血浆,肾脏和肝脏药物浓度高且消除相半衰期长,这可能是由于肝脏和肾脏具有很好的渗透性,并且含有比较丰富的血管,所以药物在这些组织中的含量较高,且持续的时间长,另外值得注意的是鳃组织,给药后鳃组织首先达到峰值,浓度高于肝脏,消除较快,可以推出鳃可能是鱼体排泄药物的途径之一。磺胺二甲嘧啶在肝脏、肾脏消除半衰期长于肌肉和鳃,说明药物自口灌入后首先进入血液和鳃,由血液向其他组织扩散,肝脏从4~72 h组织浓度均小于血浆和肌肉,这与环丙沙星给药后肝脏浓度大于血浆和肌肉是相反的,磺胺类药物与乙酰辅酶A结合生成无活性的乙酰化磺胺,本文与有些报道的磺胺类药物在肝脏中的乙酰化的结论是一致的,这与复方新诺明在鲈鱼[25]、磺胺甲噁唑在罗非鱼[26]体内的代谢规律相同。
3.2 环丙沙星和磺胺二甲嘧啶给药方案的探讨探讨给药方案主要是确定给药的剂量和给药的间隔时间,环丙沙星和磺胺二甲嘧啶在健康大菱鲆体内的消除半衰期分别为11.028 h、173.407 h,给药间隔一般以一天为宜。给药剂量与最小抑菌浓度(MIC)、给药间隔时间和药代动力学参数有关,环丙沙星对大部分敏感菌MIC低于0.25 mg/L,很少超过1 mg/L;磺胺二甲嘧啶对大部分敏感菌MIC为128 mg/L,根据本实验单次给药药动学参数,通过徐叔云[27]提出的公式计算给药方案:Css=F×X0/(Vd×K10×τ),(Css:期望达到的稳态血药浓度;F:生物利用度;X0:每日给药剂量;Vd:表观分布容积;K10:药物在中央室消除速率;τ:给药间隔时间)。根据上述公式计算可得,建议口服给药,环丙沙星按鱼体重每次给药剂量为28.01 mg/kg,每天一次,连续3~5 d,磺胺二甲嘧啶按鱼体重每次给药剂量为18.32 mg/kg,每天一次,连续3~5 d。
[1]张永明.大菱鲆(Scophthlmus maximus)盾纤毛虫病的病理学观察及中草药防治效果研究[D].青岛:中国海洋大学,2009.
[2]房文红,于慧娟,蔡友琼,等.恩诺沙星及其代谢物环丙沙星在欧洲鳗鲡体内的代谢动力学[J].中国水产科学,2007,14(4):622-629.
[3]方星星,王 群,李 健.复方新诺明和恩诺沙星在两种水产动物体内的药物代谢动力学及残留研究[D].青岛:中国海洋大学,2003.
[4]卜仕金,冯淇辉.环丙沙星在健康奶山羊的药动学及其乳汁和组织浓度[J].中国兽医学报,1999,19(4):408-411.
[5]杨雨辉,佟恒敏,卢彤岩,等.环丙沙星在鲤体内吸收、代谢和生物利用度[J].水产学报,2003,27(6):582-589.
[6]吴 皓,尹文林,邵健忠,等.环丙沙星在鳗鲡体内的药代动力学研究[J].黑龙江畜牧兽医,2004,(6):72-73.
[7]方炳虎,曾振灵,王志强,等.环丙沙星在霉形体性肺炎猪体内的组织药代动力学研究[J].中国兽医科技,2007,37(2):176-180.
[8]李英伦.环丙沙星在山羊体内药代动力学研究[J].四川农业大学学报,1996,14(4):609-612,636.
[9]方炳虎,冯淇辉,陈杖榴,等.环丙沙星在猪体内的生物利用度及药物动力学[J].中国兽医学报,1999,19(6):588-590.
[10]谢恺舟,卜仕金,张雨梅,等.肉仔鸡静注和内服环丙沙星(ciprofloxacin)的药物动力学[J].中国兽医学报,2002,22(6):617-619.
[11]蒋志伟,王宝安,朱国强,等.盐酸环丙沙星在鲫鱼体内的药代动力学及组织分布研究[J].江苏农业研究,1999,20(2):14-16.
[12]孙玉增,张世娟,秦华伟,等.磺胺二甲嘧啶在黑鲪体内的药物代谢动力学和残留消除研究[J].中国动物检疫,2010,27(2):39-41.
[13]艾晓辉,陈正望.磺胺二甲嘧啶在银鲫体内的药动学及组织残留研究[J].淡水渔业,2001,31(6):52-54.
[14]范能全.磺胺二甲嘧啶在鲫鱼体内的药代动力学研究[J].重庆师范大学学报(自然科学版),2010,27(3):23-26.
[15]张长坤,王茂剑,宫向红,等.磺胺二甲嘧啶在大菱鲆体内的药代动力学研究[J].海洋湖沼通报,2010,(2):86-90.
[16]Nouws J F M,Mevius D J,Vree T B,et al.Pharmacokinetics,renel clearance and metabolism of ciprofloxac in following intravenous and oral admisnistration to calves and pigs[J].The Veterinary Quarterly,1988,10(3):156-163.
[17]Vance B K,Guay D R,Rotschafer J C.Clinical pharmacokinctics of ciprofloxaxin[J].Clin Phammcokinet,1990,19(6):434-461.
[18]Atta A H,Sharif L.Pharmacokinetics of ciprofloxacin following intravenous and oral administration in broiler chickens[J].J Vet Pharmacol Therap,1977,(20):326-329.
[19]Dowling P M,Wilsom R C,Tyler J W.Pharmacokinetics of ciprofloxacin in ponies[J].J Vet Pharmacol Therap,1995,(18):7-12.
[20]Bergan T,Dalhoff A,Rohwedder R.Pharmacokinetics of ciprofloxacin[J].Infectoin(Supplement),1988,(16):S3-S13.
[21]张风琴,宋坤改,林赴田.环丙氟哌酸药代动力学性能的研究[J].中国抗生素杂志,1991,16(3):203-208.
[22]陈杖榴,卢光志,刘建新.磺胺二甲嘧啶在猪体内的代谢动力学研究[J].华南农业大学学报,1988,(3):46-50.
[23]赵秀然,李爱华,张渊魁.磺胺二甲嘧啶(SM_2)在星布罗鸡体内代谢动力学的探讨[J].江西农业大学学报,1986,(4):55-60.
[24]扈文杰,李富娥,王建元.磺胺二甲嘧啶在奶山羊体内药代动力学研究[J].中国兽医科学,1986,(11):16-18.
[25]方星星,李 健,王 群,等.复方新诺明在花鲈体内的残留及消除规律[J].海洋科学,2003,27(9):16-20.
[26]袁科平,艾晓辉.磺胺甲噁唑在罗非鱼体内的药代动力学及组织浓度研究[J].水利渔业,2008,28(3):25-27.
[27]徐叔云,卞如濂,陈 修.药理实验方法学[M].第3版.北京:人民卫生出版社,2002:699-759.?

