水热法制备超细焦绿石型三氧化钨及其表征
彭志宏,吴 旭,周秋生,喻晓剑,齐天贵,刘桂华,李小斌
(中南大学 冶金科学与工程学院,长沙 410083)
水热法制备超细焦绿石型三氧化钨及其表征
彭志宏,吴 旭,周秋生,喻晓剑,齐天贵,刘桂华,李小斌
(中南大学 冶金科学与工程学院,长沙 410083)
在水热条件下利用纯 WO3作为添加剂能够直接从钨酸钠溶液中制备出超细焦绿石型三氧化钨(WO3·0.5H2O)粉体。结果表明:往100 g/L的钨酸钠溶液中添加WO3,在密闭压力容器内,在140 ℃下反应24 h,反应率能达到80%左右。采用XRD和SEM等测试手段对水热产物进行表征,产物为结晶良好的立方体结构,颗粒的平均尺寸小于1 μm。EDS检测表明:所得产品含微量的Na元素,经盐酸洗涤后可得到几乎不含杂质Na的WO3·0.5H2O粉体。利用IR光谱测定水热条件下钨酸钠溶液的离子结构变化,初步认为制备WO3·0.5H2O的生长基元为 WO42−。
钨酸钠溶液;水热处理;焦绿石型三氧化钨;超细粉体
焦绿石型三氧化钨(WO3·0.5H2O)以扭曲的 WO6八面体为结构基元、通过W-O刚性骨架的角顶构筑形成具有圆环孔道的层状结构[1]。由于其具有分子筛的网状结构和介稳性,在燃料电池[1−2]、传感[3]和光致变色[4]等领域展现出广泛的应用前景,因此,近年来有关WO3·0.5H2O粉体材料的研究引起了广泛的关注。
目前公开报道的WO3·0.5H2O制备方法主要有软化学合成法和水热合成法。1988年,COUCOU和FIGLARZ[5]采用软化学合成法,以(NH4)10W12O41·5H2O为前躯体制备出 WO3·0.5H2O。但是该法所得的WO3·0.5H2O 存在晶格缺失,而且含水量一般比完整的 WO3·0.5H2O要少。水热合成法由于具备许多优点已被广泛用于无机材料合成和材料处理[6],在水热条件下,溶液的黏度下降,扩散、传质过程顺利,反应物活性提高,因此水热合成可代替某些高温固相反应。1989年,GÜNTER等[7]采用水热法,在体系pH值为3.0、 温度为300℃条件下合成钨酸镁的研究中偶然得到了WO3·0.5H2O。1990年,REIS等[8]发现,在pH值为 3.5~4.5之间可以得到 WO3·0.5H2O粉体。GUO等[1]认为用盐酸将钨酸钠溶液pH值调到6.0左右也能得到WO3·0.5H2O粉体,该方法使得制备WO3·0.5H2O的 pH值范围有了进一步的拓宽。国内关于制备WO3·0.5H2O的研究很少,徐英明等[9]以盐酸为添加剂调节pH值水热合成WO3·0.5H2O,该法所制备的粉体平均粒径较大,粉体团聚现象较明显,需经盐酸洗涤后才可以有效除去杂质 Na元素。李小斌等[10]通过添加有机物的方法制备的粉体粒径均匀,几乎不含杂质Na元素,焙烧后可直接得到 WO3,但该法有机物用量大,成本较高。
综上所述,在水热环境下控制适当的 pH值、反应温度和反应时间等条件,可以制备出粒度和结构比较稳定的粉体[9−10],但它们均存在不同程度的纯度、粒度和成本等方面的问题。基于WO3能在钨酸钠溶液中溶解,并改变体系的 pH值,本文作者提出在水热条件下添加三氧化钨(WO3)粉体,制备超细WO3·0.5H2O粉体的新方法。
1 实验
1.1 实验装置
DY−8群釜低压装置(中南大学机械厂生产),以甘油为加热介质,电加热,控温精度±1 ℃。
1.2 粉体制备
实验所用主要原料包括纯度为 99.5%的Na2WO4·2H2O晶体,纯度为99%、平均粒径为50 μm的WO3粉末。
首先,把Na2WO4·2H2O晶体溶于去离子水中,配制浓度为100 g/L(以WO3计)的钨酸钠溶液。然后,移取100 mL配制好的钨酸钠溶液至容积为150 mL的不锈钢密闭反应釜中,并添加一定质量的WO3粉末,在140 ℃下恒温水热反应不同时间。水热反应过程中,每隔一段时间将溶液冷却后进行取样,并测定反应体系溶液的 pH值以及反应率。反应最终沉淀产物用蒸馏水洗涤4~5次,然后在50 ℃真空干燥箱中恒温干燥4 h,所得粉体样品进行相关检测分析。
1.3 分析与测试
利用D8 X射线衍射仪(西门子公司生产,Cu Kα射线(l=1.540 56 Å),管压 40 kV,电流 30 mA)对粉体样品进行物相分析。利用 JSM−6360LV扫描电镜(日本 JEOL公司)对粉体样品进行形貌分析。利用GENESIS−60S能量色散 X 射线荧光光谱仪(美国EDAX公司)对粉体样品进行成分分析。利用6700型红外光谱仪(NICOLET公司)、采用溴化钾压片法采集溶液的红外光谱。溶液中的 WO3浓度用分光光度法(7230G分光光度计)进行分析,显色剂为硫氰酸钾,还原剂为三氯化钛。钨酸钠溶液反应率(η)的计算公式为:

式中:w0和wt分别代表原始钨酸钠溶液中和水热反应t时刻溶液中WO3的质量浓度,g/L。
2 结果与讨论
2.1 WO3添加量对钨酸钠溶液反应率的影响
李小斌等[10]的研究发现,在高温密闭条件下,向钨酸钠溶液体系中添加酸性有机物,控制溶液体系pH值在7.0~9.0之间,能够获得WO3·0.5H2O粉体,但酸性有机物对溶液污染严重,且难以实现碱液的循环。由于WO3易溶于碱性溶液,能起到中和游离碱降低体系 pH值、同时增大WO42−浓度的作用。因此,本文作者提出通过添加适量WO3粉体调节体系pH值,水热制备WO3·0.5H2O粉体的新思路,并着重考察WO3添加量对钨酸钠溶液反应率的影响。不同条件下钨酸钠溶液的反应率和溶液体系的 pH值随反应时间变化关系分别如图1和2所示。其中添加系数C为所添加的WO3的质量与溶液中所含WO3的质量的比值,曲线a和b分别代表添加系数C为4和2的反应体系。
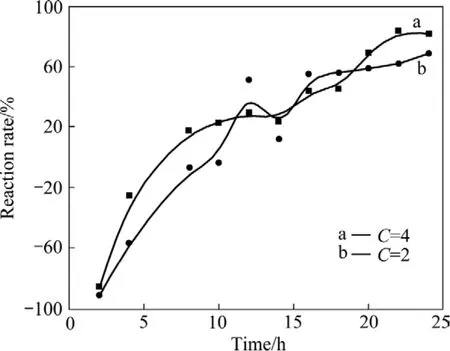
图 1 不同添加系数下钨酸钠溶液的反应率随水热反应时间的变化Fig. 1 Variation of reaction rate of Na2WO4 solution with hydrothermal reaction time at different adding coefficients
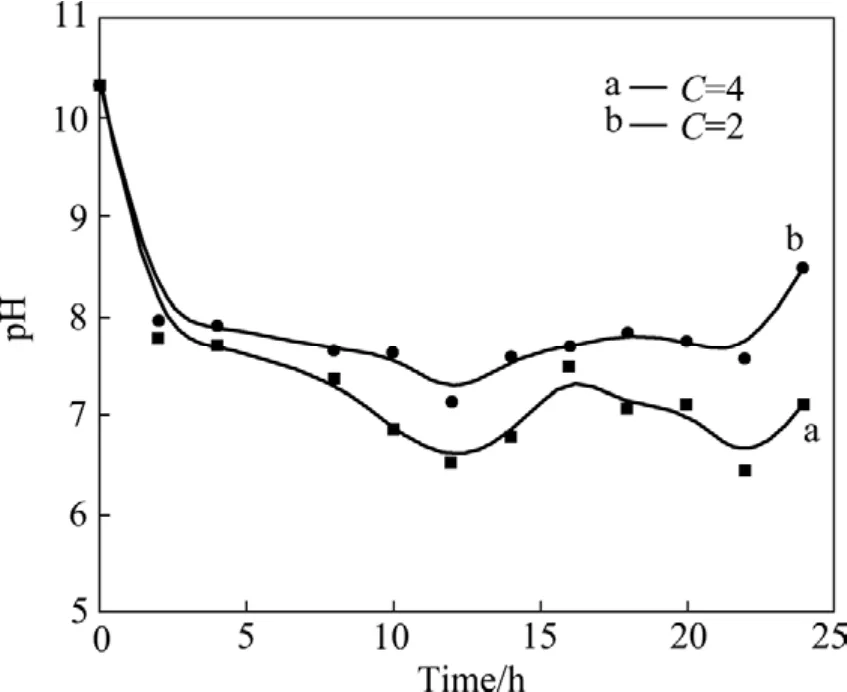
图 2 不同添加系数条件下钨酸钠溶液的 pH值随水热反应时间的变化Fig. 2 pH variation of sodium tungstate solution with hydrothermal reaction time at different adding coefficients
从图1和2可看出,钨酸钠溶液的反应率和pH值与反应时间和WO3添加量有关。当WO3添加系数为 4,反应时间大于 20 h,反应率可以达到 80%左右;当WO3添加系数为2,反应时间为25 h时,反应率约为70%。整个反应过程总体呈现先溶解后沉淀析出的状态,在反应的初始阶段,添加的WO3粉体溶解于钨酸钠溶液中,导致溶液WO42−浓度升高,溶液pH值显著降低。因此,在水热反应进行的前几个小时内,钨酸钠溶液反应率小于0;随着水热反应的进行,WO3·0.5H2O开始析出,溶液WO42−浓度降低,当反应进行到8 h以后,反应率大于0。随着反应率的升高,体系pH值缓慢降低;在反应的最后阶段,随着反应率的不断升高,溶液的 pH值呈现上升的趋势。反应过程溶液pH值变化表明:添加适量的WO3能将溶液pH值稳定在 6.5~8.0范围内,该 pH范围有利于WO3·0.5H2O的析出。对比反应体系a和体系b可以看出:在本试验条件下,添加系数C越大,反应率越高。这是因为添加的WO3量越多,溶解后体系pH值相对越低,能够为反应提供更多的H+,从而有利于提高反应率。
2.2 反应产物表征
不同添加系数的钨酸钠溶液体系水热反应不同时间后所得沉淀产物的XRD谱如图3所示。从图3可以看出,样品的衍射峰都非常尖锐,峰宽差别比较小。其中曲线a为添加系数2、水热反应24 h的沉淀产物,其衍射峰符合立方晶系 WO3·0.5H2O的特征峰,并且几乎没有杂峰,说明该粉体纯度高,添加物WO3已经转化成WO3·0.5H2O;而曲线b和c为添加系数为4、不同水热反应时间的沉淀产物,其衍射谱中均有部分杂峰,经分析认为产物包括新生成的 WO3·0.5H2O以及部分未溶解的WO3粉体。这是由于加入WO3量过多,当部分WO3溶解,降低了溶液的 pH值(pH<7)以后,剩下的WO3难以快速完全溶解,故样品中除水热反应析出的 WO3·0.5H2O外,尚含有部分未溶解的WO3。对曲线b和c的衍射谱进行比较后可以看出,反应48 h以后,WO3的峰强明显减弱,这说明在水热反应过程中,作为添加物的WO3在体系中存在继续溶解的现象,并且随后以 WO3·0.5H2O从溶液中沉淀析出。
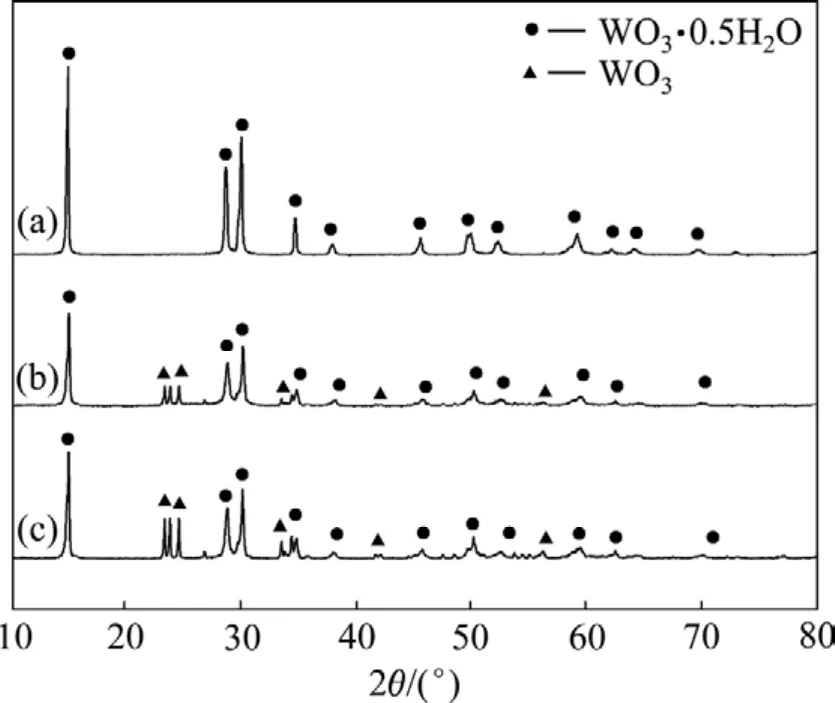
图 3 不同添加系数和反应时间下钨酸钠溶液水热反应产物的XRD谱Fig. 3 XRD patterns of hydrothermal products obtained from Na2WO4 solution at different adding coefficients and reaction times: (a) C=2, t=24 h; (b) C=4, t=48 h; (c) C=4, t=2 h
不同 WO3添加系数的钨酸钠溶液水热反应 24 h后得到的反应产物的扫描电镜照片如图4所示。从图4可以看出,添加WO3粉体后,钨酸钠溶液的水热反应产物为立方体结构,颗粒的平均尺寸小于1 μm。作为添加物的WO3粉体亦呈现明显的立方体结构,但颗粒粗大,其平均粒径达到50 μm左右(见图4(a))。在水热反应过程中,随着添加物WO3的溶解,体系pH值降低,为水热反应提供H+,有利于反应的进行,生成WO3·0.5H2O。但WO3添加量过多,体系pH更低,且有部分 WO3溶解不完全。WO3添加系数为 4的水热反应产物为WO3和WO3·0.5H2O的混合物,从图4(b)可以看出,残留有较多未溶解完全的细粒WO3粉体,且整体粒度较细,这一过程也说明添加的WO3粉体在水热反应体系中发生溶解。徐英明等[4]的研究也表明:水热反应体系pH降低,产物粒子尺寸变小。

图4 添加的WO3粉体和钨酸钠溶液水热反应产物的扫描电镜照片Fig. 4 SEM micrographs of WO3 added to system and hydrothermal products from Na2WO4 solution: (a) WO3 powders added; (b) Products, C=4; (c) Products, C=2
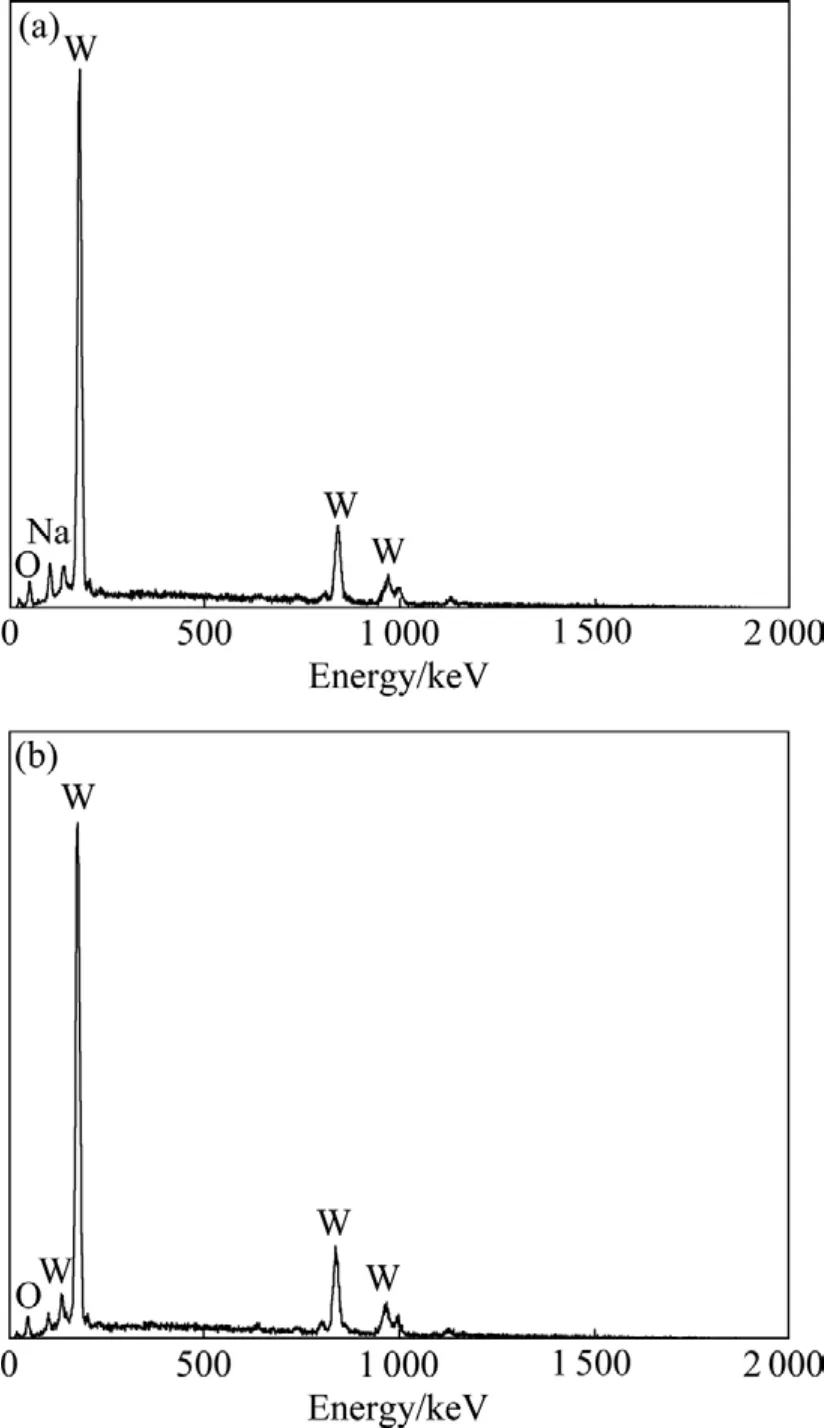
图5 WO3·0.5H2O粉体的EDS谱Fig. 5 EDS spectra of WO3·0.5H2O powders: (a) Original hydrothermal product; (b) Hydrothermal product washed by 1 mol/L HCl
钨酸钠溶液水热反应产物的 EDS分析结果(见图5)表明,产物中除了含有W、O等主要元素外,还含有微量的Na元素(图5(a))。将水热产物置于1 mol/L的盐酸中于常温下搅拌1 h后,Na元素的峰强明显减弱,几乎难以检测到(见图5(b))。水热产物中Na元素的存在有多方面的原因:一是由于反应得到的产品都是超细的颗粒,造成产品洗涤困难,因此产品在洗涤的时候不能完全将残留在产品表面的 Na+清除;二是由于当反应体系pH<7.0时,尤其是在钨酸钠溶液酸化程度比较高的情况下,溶液中还可能存在HW6O215−、W12O4110−、HW12O419−、H2W12O418−、W12O396−和 HW12O395−等多钨酸根离子或络合离子[11−12],其中部分离子易于与溶液中的 Na+和 H+等阳离子结合形成沉淀,夹带在WO3·0.5H2O粉体中一起进入固相中,当粉体的团聚现象比较明显时,这种夹带现象愈加严重;三是由于水热产物 WO3·0.5H2O本身是一类具有多维孔道结构的化合物[5,13],其三维孔道中易夹带微量的Na+。
因此,要制备不含Na元素的WO3·0.5H2O粉体,且要保证一定的反应率,WO3粉体的添加量应适当,以保证溶液pH维持在7.0~8.0之间,减少产品的团聚。同时为了完全除去产品中的 Na元素,在水热产物洗涤过程中应加入少量的盐酸。
2.3 反应机理探讨
较早的研究[14]表明,钨酸钠溶液浓度在0.01~0.02 mol/L、pH值为7.04~9.30时,溶液中除WO42−外还存在W2O72−,且该离子的数量随溶液浓度增加而增多。MAKSIMOVSKAYA和BURTSEVA[15]以及LIU等[16]认为将钨酸钠溶液pH调为7.0~8.5时,溶液中主要存在 W7O246−和 H2W12O4210−,是否存在 W2O72−则存在争论,这是因为后者的结构基元与前两者极其接近,均为 WO6八面体结构[17],很难用现代检测方法区分开。从元素组成来看,W2O72−更易与 H2W2O7-(WO3·0.5H2O)从结构上关联起来。
为了研究该过程的反应机理,通过 IR测试分析添加系数为2的溶液体系在水热反应过程中溶液离子结构变化情况(见图6),其中828.46 cm−1处的吸收峰可归属为 WO4原子基团的伸缩振动峰[18],WO4原子基团为简单四面体结构,是WO42−的结构基元,谱中并没有发现有W2O72−存在。从图6还可看出,随着水热反应的进行,变化较大的是828.46 cm−1处WO4原子基团,也就是WO42−所对应的吸收峰,该吸收峰逐渐减弱,表明随着WO3·0.5H2O的析出,WO42−浓度相应降低。
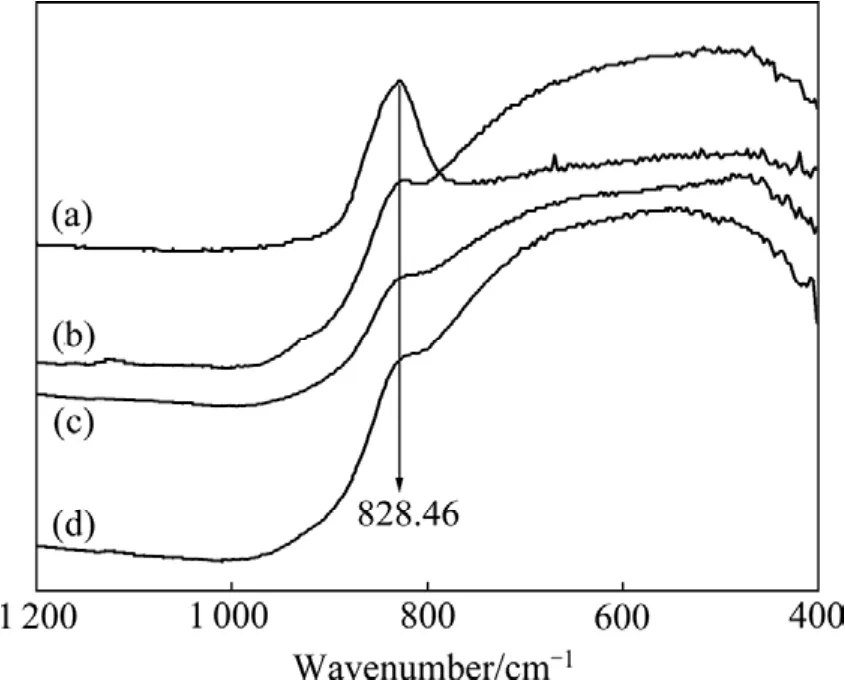
图6 不同水热反应时间下Na2WO4溶液的红外光谱Fig. 6 IR spectra of Na2WO4 solutions during hydrothermal reaction process: (a) t=0, pH=10.33; (b) t=4 h, pH=7.98;(c) t=24 h, pH=7.65; (d) t=60 h, pH=7.84
因此,可以初步认为 WO42−是 WO3·0.5H2O 结晶析出过程中的生长基元,添加 WO3粉体后通过 WO3在碱性溶液中水热条件下溶解−沉淀,实现晶型转变。WO3·0.5H2O 从钨酸钠溶液中水热沉淀析出可能按照以下反应式进行:
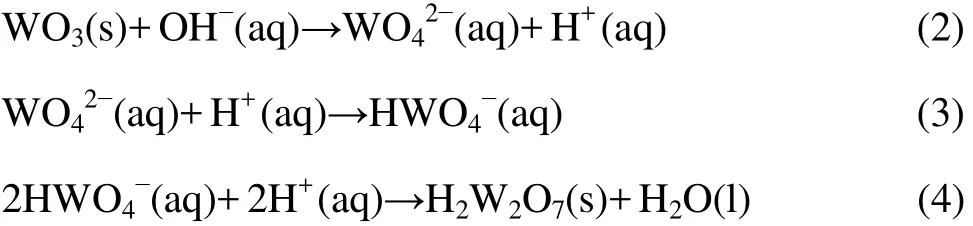
钨酸钠溶液水热反应机理及其离子的存在形态尚有待于进一步深入研究。
3 结论
1) 钨酸钠溶液中添加WO3粉体,通过WO3在碱性溶液水热条件下溶解−沉淀,实现晶型转变,能够制备出WO3·0.5H2O超细粉体。
2) 在140 ℃下,添加适量的WO3能将钨酸钠溶液的pH值控制在6.5~8.0之间,钨酸钠溶液的反应率可以达到80%左右。
3) WO42−是钨酸钠溶液水热反应过程中WO3·0.5H2O析出的生长基元。
REFERENCES
[1] GUO Jing-dong, LI Y J, STANLEY W M. Hydrothermal synthesis of electrode materials[J]. Journal of Power Sources,1995, 54(2): 461−464.
[2] YU Ai-shui, KUMAGAI N, YASHIRO H. Synthesis of pyrochlore tungsten trioxide thin film and electrochemical intercalation[J]. Solid State Ionics, 1997, 100(3/4): 267−273.
[3] LI Y J, TSAI P P. Lacunar pyrochlore-type tungsten oxides as humidity-sensing materials[J]. Solid State Ionics, 1996,86-88(part 2): 1001−1004.
[4] 徐英明, 霍丽华, 赵 辉, 高 山, 赵经贵. 介稳态氧化钨超微粉体的水热合成与光致变色性质研究[J]. 无机化学学报,2005, 21(4): 538−542.XU Ying-ming, HUO Li-hua, ZHAO Hui, GAO Shan, ZHAO Jing-gui. Hydrothermal synthesis and photochromism property of superfine powders of metastable tungsten oxide[J]. Chinese Journal of Inorganic Chemistry, 2005, 21(4): 538−542.
[5] COUCOU A, FIGLARZ M. A new tungsten oxide with 3D tunnels: WO3with the pyrochlore-type structure[J]. Solid State Ionics, 1988, 28/30(part 2): 1762−1765.
[6] BYRAPPA K, YOSHIMURA M. Handbook of Hydrothermal Technology: A technology for crystal growth and materials processing[M]. Norwich, New York: William Andrew Publishing,2001: 1−43.
[7] GÜNTER J R, AMBERG M, SCHMALLE H. Direct synthesis and single crystal structure determination of cubic pyrochlore-type tungsten trioxide hemihydrate WO3·0.5H2O[J].Materials Research Bulletin, 1989, 24(3): 289−292.
[8] REIS K P, RAMANAN A, WHITTINGHAM M S.Hydrothermal synthesis of sodium tungstates[J]. Chemistry of Materials, 1990, 2(3): 219−221.
[9] 徐英明, 程晓丽, 高 山. 焦绿石型 WO3超细粉体的水热合成与表征[J]. 哈尔滨理工大学学报, 2002, 7(6): 70−74.XU Ying-ming, CHENG Xiao-li, GAO Shan. Hydrothermal synthesis and characterization of superfine power of pyrochlore-type tungsten trioxide[J]. Journal of Harbin University of Science and Technology, 2002, 7(6): 70−74.
[10] 李小斌, 彭志宏, 李建圃, 刘桂华, 周秋生, 齐天贵. 一种从钨酸钠溶液制备氧化钨水合物的工艺: 中国,201010022046[P]. 2010−01−12.LI Xiao-bin, PENG Zhi-hong, LI Jian-pu, LIU Gui-hua, ZHOU Qiu-sheng, QI Tian-gui. A hydrothermal method of preparation tungsten oxide hydrate from sodium tungstate solution: China,201010022046[P]. 2010−01−12.
[11] DUNCAN J F, KEPERT D L. Polyanion equilibria in aqueous solution. PartⅠ: The quantitative analysis of acidified tungstate solutions[J]. Journal of the Chemical Society, 1961: 5317−5325.[12] DUNCAN J F, KEPERT D L. Polyanion equilibria in aqueous solution. Part Ⅱ: A thermodynamic study of the paratungstate an anion[J]. Journal of the Chemical Society, 1962: 205−214.
[13] SHIM J, LEE C R, LEE H K. Electrochemical characteristics of Pt-WO3/C and Pt-TiO2/C electrocatalysts in a polymer electrolyte fuel cell[J]. Power Sources, 2001, 102(1/2): 172−177.
[14] KARIMOVA L K. Chemistry and chemical technology of rare and nonferrous metals[M]. Tashkent: Fan, 1974: 59−70. (in Russian)
[15] MAKSIMOVSKAYA R I, BURTSEVA K G.17O and183W NMR studies of the paratungstate anions in aqueous solution [J].Polyhedron, 1985, 4(9): 1559−1562.
[16] LIU Shi-jun, CHEN Qi-yuan, ZHANG Ping-min, LI Song-qin.Raman spectral study on isopolytungstates in aqueous solution[J].Transactions of Nonferrous Metals Society of China, 1998, 8(4):688−692.
[17] COURCOT B, BRIDGEMAN A J. Structural and vibrational study of [Mo7O24]6−and [W7O24]6−[J]. The Journal of Physical Chemistry A, 2009, 113(39): 10540−10548.
[18] KAZUO N. Infrared and Raman spectra of inorganic and coordination compounds[M]. Beijing: Chemical Industry Press,1991: 147−160.
Preparation of ultrafine pyrochlore-type tungsten trioxide powder by hydrothermal method and its characterization
PENG Zhi-hong, WU Xu, ZHOU Qiu-sheng, YU Xiao-jian, QI Tian-gui, LIU Gui-hua, LI Xiao-bin
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
The ultrafine pyrochlore-type tungsten trioxide powders were hydrothermally synthesized from sodium tungstate solution by adding pure WO3powders to the reaction system. The results show that the precipitation rate of tungsten species in solution can reach 80%. XRD analyses results indicate that the precipitates are powders with cubic crystal structure. EDS analyses results reveal that a small amount of impurity of sodium is present in the precipitates and it can be completely removed by washing in the diluted hydrochloric acid. SEM micrographs show that the average diameter of the precipitates is less than 1.0 μm. Based upon IR technique, a new reaction mechanism is proposed that WO42−may be the growth unit of pyrochlore-type tungsten trioxide during the hydrothermal precipitation process of sodium tungstate solution.
sodium tungstate solution; hydrothermal process; pyrochlore-type tungsten trioxide; ultrafine powder
TF841.1
A
1004-0609(2012)02-0579-06
中央高校基本科研业务费专项资金资助项目(2010QZZD004)
2011-01-24;
2011-08-20
周秋生,教授,博士;电话:0731-88830453;E-mail: qszhou@csu.edu.cn
(编辑 李艳红)

