重组人血白蛋白的纯化研究
任华景 刘素霞 张 斌
(华北制药集团新药研究开发有限责任公司,河北石家庄050015)
重组人血白蛋白的纯化研究
任华景 刘素霞 张 斌
(华北制药集团新药研究开发有限责任公司,河北石家庄050015)
本文综述了血浆人血清白蛋白(pHSA)和基因重组人血清白蛋白(rHSA)的优缺点以及共同之处,讲述了一种纯化重组人血白蛋白的方法,为获得高纯度、安全、稳定的产品,各种色谱分离技术得到更多的应用 。由于rHSA在临床上有广泛的用途,所以其在国内外有很大的市场需要,现阶段尽管rHSA的纯化技术已有一定的发展,但纯化过程仍需优化以提高产品纯度及收率。
重组人血清白蛋白;人血白蛋白;分离纯化;研究人血清白蛋白(Human Serum Albumin,HSA)是由585个氨基酸
组成分子量为68KDa的蛋白组成,约占血浆总蛋白的60%,含17对二硫键。在人体内起着相当大的作用,如具有维持血液渗透压和携带血液中多种配基(包括氨基酸,脂肪酸,金属离子,类固醇及药物);组织进行交换等生理功能[1]。另外,人血清白蛋白在临床上广泛应用于休克、大出血、烧伤、白蛋白过少症等[2]。目前市场上销售的 HSA商品都是提取纯化人源血浆得到。然而人血来源有限,外加污染较为严重,如艾滋病及肝炎的蔓延,威胁人血制品的安全性,由此得出通过遗传工程开发HAS势在必行[3]。
1 rHSA与pdHSA的比较
1.1 结构方面比较
经高度纯化后,rHSA与pdHSA在分子结构上是一致的,是一条66.5-kDa单链、非糖基化多肽链,含17对二硫键和一个半胱氨酸位点,由585个氨基酸残基组成。rHSA的三级结构呈心形,67%为α-螺旋,不含β-折叠,由三个结构域(I、Ⅱ和Ⅲ)组成,每个结构域又各包含两个亚结构域[4]。Sadaharu等[5]分析了rHSA的三个结构域与药物的结合能力,发现I型区域与药物结合的能力最强,这是由其34位上游离的半胱氨酸残基所决定的。
1.2 功能方面比较
作为pdHSA最可能的临床替代品rHSA,在生理功能上具有与pdHSA十分相似性。用同位素125I标记rHSA与pdHSA注射大鼠体内静脉,发现二者在组织分布、尿液和粪便代谢、血液半衰期等方面都无显著差异[6]。在用于治疗烧伤、白蛋白过少、出血性休克等病症时,由于病理条件下,毛细血管对HSA的通透性会大大增加,如果过量输入HAS,可能会透过毛细血管壁而导致器官水肿,从而使病情加重[7]。通过基因工程手段获得的rHSA二聚体,在保留相应的生理功能不变的情况下,既延长了其血浆半衰期,又降低了其毛细血管通过率,将很有可能解决这一问题[8]。
1.3 安全可靠性方面比较
近些年来pdHSA存在很多缺点,例如含有血源捐赠者自身所携带的病毒(如艾滋病病毒、肝炎病毒等)和其他潜在的致病因子,从而使患者在使用pdHSA制品时面临很大风险[9]。而影响rHSA安全应用于临床的主要潜在危险因素是其所含有的极少量酵母成分,包括蛋白质和甘露聚糖等多糖成分,这些成分可能会在重复注输时导致急性免疫反应,从而危害患者健康[10]。因此,提高rHSA的分离纯化技术,减少杂质含量,会大大提高rHSA的安全性。
2 重组人血清白蛋白(Recombinant HSA,rHSA)的纯化技术
近20年以来,国内外很多实验室和公司已经开始尝试通过遗传工程方法来制备HSA。微生物产重组人血清白蛋白的专利在1989年已有发表[11],至今 HSA基因已被引入真菌、细菌、动物以及植物中进行表达[12]。目前的研究集中于用细胞外分泌型的毕氏酵母发酵法制备HSA,由于其有表达量高,分泌的杂蛋白较少,易于纯化等优势存在,是目前比较好的HSA生产方式,并且有进行大规模生产的潜力[13]。
采用毕氏酵母为宿主细胞,表达量已经达到每升发酵液克级水平,甚至有的单位称已经达到更高水平,但rHSA的纯化方面我国的研究仍远不及日本等国家。
rHSA的纯化不同于pHSA等血浆蛋白及其它的重组蛋白,主要在于:
(1)纯化体系复杂。rHSA是通过酵母发酵生产的,由于发酵液中含有大量的酵母细胞组分和分泌物,如蛋白酶、杂蛋白、脂肪酸、核酸、多糖、色素、热原物质等[14]。另外如果不及时去除发酵液中的蛋白酶,rHSA就会被降解;终产物中如果含有酵母细胞组分,哪怕只有很少很少的含量,输入人体内转化为抗原,对于这种不同物种之间的相互作用,会对人体产生很大的危害。
(2)常用剂量大,纯度要求非常之高。对于像疫苗这样需要微量输入的重组蛋白质来说,99.999%的纯度已经足够,但对于 rHSA达到这样的纯度程度还是不够的。即使有很微量的有害杂质,将可能产生致命的危险。
(3)HSA单位成本低,需求量大。
要想在市场上立足,rHSA的成本必须低于 pHSA才行。其中rHSA的纯化成本占生产总成本的大部分,所以要实现大规模生产,降低纯化成本是根本。由此可见,rHSA走向工业化并商业化的两大难点——成本和质量 (即纯度)将是对rHSA纯化技术需解决的问题。
日本的 Green Cross公司对 rHSA的研究虽然不是起步最早,但发展很快,对高效表达、分泌rHSA的重组菌株构建、发酵条件优化、rHSA的分离纯化、纯品的鉴定、rHSA结构分析以及 rHSA的工业化生产进行了大量系统性研究,野田宗宏等人在专利CN1127299A和CN11364643A中描述了酵母发酵后利用加热发酵液、稀释、调酸、扩张床阳离子层析、加热、疏水层析、螯合吸附、阴离子交换、硼酸钙沉淀等步骤得到高纯度的rHSA[15],其流程图如图1所示。目前我公司在此基础上进行了改进工艺,提高了rHSA的纯度,其流程图如图2所示。
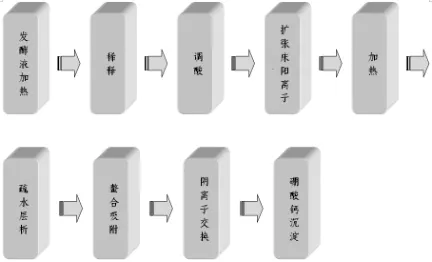
图1rHSA纯化流程图
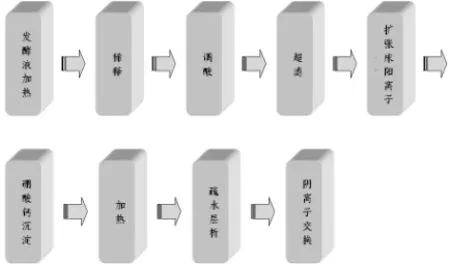
图2rHSA纯化流程图
3 展望
rHSA纯化技术的研究已取得很大程度突破性进展,已经有研究报道纯度可高达99.999999%,接近与工业化。从分子结构上来看,纯化得到的高纯度的rHSA与pHSA是完全相同,并且通过SDS-PAGE分析、HPLC分析、配基结合能力均相同[16]。rHSA的结构不均一程度比pHSA要低[17],含有的总脂肪酸量也略低。二者的免疫化学特性相同,理化功能相同[3]。但Wataru Ohtani等人对纯化的rHSA进行免疫分析,结果得出,rHSA中仍残存生产菌细胞蛋白及甘露聚糖等多糖成分。其中使人产生抗体的正是甘露聚糖,这样一来就对输注rHSA的安全性造成了很大的威胁[18]。并且在纯化rHSA的研究中我们发现宿主细胞色素并没有彻底去除。所以rHSA可否替代pHSA,或在何种前提条件下可以替代,仍然需要进一步的研究证实。因此,对如何解决产品纯度问题包括去除色素、去除宿主蛋白质及去除rHSA降解片段等仍需进行深入研究,尤其要加强纯化过程集成,提高纯化效率。由于高纯度 rHSA的纯化过程复杂,步骤繁多,成本高,收率低,实现全封闭式无污染自动化生产难度较大,因此为实现rHSA工业化产生了很大阻挠。虽然到目前为止,在世界范围内关于rHSA的生产仍未能实现工业化,但它代表了发展方向,是关于蛋白质分离纯化最富有挑战性的研究。
[1]邱荣德,李士云,陈俊刚,等.重组人血清白蛋白在Pichia pastoris中的表达与纯化[J].生物化学与生物物理学报,2000,32(1):59-62.
[2]Peters T.All about Albumin:Biochemistry,Genetics and MedicalApplicants[M].Academic Press,San Diego,1996.
[3]郭美锦,储炬,杭海峰,等.重组人血清白蛋白表达研究进展.生物工程进展, 2000,20(5).
[4]Kaoru Kobayashi.Summary of recombinant human serum albumin development [J].Biologicals,2006,34:55-59.
[5]Sadaharu M,Yu I,Victor T,et al.Functional analysis of recombinant human serum albumin domains for pharmaceutical applications[J].Pharm Res,2004,1(10):1924-1932.
[6]Ohtani W,Nawa Y,Takeshima K,et al.Physicochemical and immunochemical
properties of recombinant human serum albumin from Pichia pastoris[J].Analytical Biochemistry,199,256:56-62.
[7]Noda,Munehiro,c/o The Green Cross Corp.Human serum albumin and progress for producing the same[Z].EP0612761.
[8]Sadaharu M,Victor T,Giam C,et al.Recombinant human serum albumin dimer has high blood circulation activity and low vascular permeability in comparison with native human serum albumin[J].Pharm R,2006,23(5):882-890.
[9]Akinori Sumi,Kouzou Okuyama,Kaoru Kobayashi,et al.Purification of Recombinant Human Serum Albumin Efficient purification using STREAMLINE[J].Bioseparation.1999,8(5):195-200.
[10]Takeshima,Kazuya,c/o The Green Cross Crop.Recombinant human serum albumin,process for producing the same and pharmaceutical preparation containing the same[Z].EP0570916A2.
[11]Masanori S,Noboru M,Shintaro Y.A.cDNA coding for human normal serum albumin a,and a process for production of the albumin[Z].EP 0330451,1989208230.
[12]Kunal Aggarwal,Leila H.Choe,Kelvin H.Lee.Quantitative analysis of protein expression using amine-specific isobaric tags inEscherichia coli cells expressing rhsA elements[J].Proteomics,2005,5(9):2297-2308.
[13]Kaoru Kobayashi,Norifumi Nakamura,Akinori Sumi,et al.The Development of Recombinant Human Serum Albumin[J].Therapeutic Apheresis,1998,2(4):257-262.
[14]M.Belew,Li Mei Yan,Zhang Wei,et al.Purification of Recombinant Human Serum Albumin (rHSA)Produced by Genetically Modified Pichia Pastoris[J].Separation Science and Technology,2008,43(11-12):3134-3153.
[15]安德鲁·R·古迪,达雷尔·斯利普,亨德里克·范厄克,等.高纯度白蛋白生产方法[Z].CN100584857C.
[16]Ohtani W,Atsushi M,Yoshitaka I,et al.Structure of recombinant human serum albumin from Pichia pastoris[J].Yakugaku Zassh,1997,117(4):220-232.
[17]Dodsworth N,Harris R,Denton K,et al.Comparative studies of recombinant human albumin and human serum albumin derived by blood fractionation[J].Biotechnol.Appl Biochem,1996,24(2):171-176.
[18]Ohtani W,Ohda T,Sumi A,et al.Analysis of Pichia pastoris components in recombinant human serum albumin by immunological assays and by HPLC with pulsed amperometric detection[J].Anal Chem,1998,70:425-429.
任华景(1985—),女,助理工程师,研究方向为从事重组人血白蛋白纯化研发工作。
曹明明]
- 科技视界的其它文章
- 深基坑地基土加固施工技术

