大豆浓缩蛋白与还原糖美拉德反应产物的理化及抗氧化活性的研究*
李 鑫,刘 骞,韩建春,李 菁
(东北农业大学食品学院,哈尔滨 150030)
大豆浓缩蛋白(简称SPC)是用高质量的低温变性豆粕为主要生产原料,通过醇法或酸法除去醇溶性和/或水溶性后所制得的含有65%~90%(干基)蛋白质(N×6.25)的粉状大豆蛋白产品。目前,国内生产厂家一般采用醇法生产大豆浓缩蛋白,其主要原因是醇法大豆浓缩蛋白豆腥味较低,而且生产时不产生废水,使得醇法大豆浓缩蛋白成为市场上主要的大豆浓缩蛋白。但醇法大豆浓缩蛋白在加工过程中,由于乙醇的作用,使其结构发生改变,这样很大程度上制约着大豆浓缩蛋白的应用。因此,加强和改善大豆浓缩蛋白的理化特性以及其他生物活性,扩大其在食品及其他领域的应用,成为国内外科学家们研究的热点。
将碳水化合物以共价键与蛋白质分子上的α或ε-氨基或羧基相结合形成糖基化蛋白的化学反应称之为蛋白质的美拉德修饰作用[1],主要包括缩合、降解、裂解、聚合等一系列反应。糖基化反应是自然条件下发生的非酶褐变,是食品加工和保存过程中涉及广泛的蛋白质与多糖和小分子等碳水化合物发生的反应。另外,美拉德反应的速率主要受到反应物的组成、时间、温度、反应物浓度、pH等多种因素影响[2-6]。美拉德修饰可在一定程度上克服蛋白质遇热不稳定问题,与化学和酶法对蛋白质改性相比,不需化学试剂,安全性高,可极大改善蛋白质的乳化性、溶解性、热稳定性及抗氧化性等功能特性。管军军等人利用微波辐射的方法,合成了大豆分离蛋白—乳糖复合物,从功能性的研究表明,大豆分离蛋白—乳糖美拉德反应产物溶解性与热稳定性较大豆分离蛋白有显著的提高,而且抗氧化性也随之增加[7]。姜瞻梅等人研究乳清蛋白与7种不同的还原糖通过干热美拉德反应,测定其反应产物的反应特性,表明乳清蛋白糖基复合物的游离氨基酸含量均显著降低,同时抗氧化活性明显增强[8]。
目前国内外对大豆蛋白美拉德反应的研究,主要集中在对大豆蛋白的功能特性等方面的改善作用[9-10],而对大豆蛋白—还原糖美拉德反应产物特性以及其抗氧化活性的研究在我国未见太多报道。本试验通过测定3种还原糖(葡萄糖、果糖与木糖)和大豆浓缩蛋白反应不同时间产生美拉德产物的理化性质和抗氧化活性(主要包括pH值、色差值、游离氨基含量、还原能力和自由基清除能力),系统分析还原糖种类和反应时间对大豆浓缩蛋白—还原糖美拉德反应产物理化特性和抗氧化活性的影响,可为大豆浓缩蛋白糖基复合物作为天然色素和天然抗氧化剂的应用提供基本的技术依据。
1 材料与方法
1.1 材料与试剂
大豆浓缩蛋白(65%蛋白含量):黑龙江双河松嫩大豆生物工程有限责任公司;葡萄糖、果糖、木糖、铁氰化钾:上海国药集团;TNBS(2,4,6-三硝基苯磺酸)、ABTS(2,2′-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐):Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
KDN-F自动定氮仪:上海纤检仪器有限公司;JD500-2型电子天平:沈阳龙腾电子称量仪器有限公司;pHS-25型pH计:上海精科雷磁仪器厂;DK-8B型电热恒温水浴锅:上海精宏实验设备有限公司;TGL-16C型高速离心机:上海安亭科学仪器厂;AL-104型精密电子天平:上海梅特勒—托利多仪器设备有限公司;WSC-S测色色差计:上海光学物理研究所。
1.3 试验方法
1.3.1 美拉德反应产物(MRPs)的制备 称取一定量的大豆浓缩蛋白分别与还原糖均匀混合,SPC与还原糖的质量比为11003d11,磁力搅拌至固体全部溶解,后用蒸馏水定容至100mL,使溶液中SPC和还原糖的浓度都为0.3mol/L。取上述溶液10mL转移到25mL的具塞试管中,盖紧。在95℃水浴中加热0.5~6.0h,并每隔一段时间取样,然后立即放入冰水中冷却。获得的MRPs在4℃下保存,用于分析其理化特性和抗氧化活性。
1.3.2 测定美拉德反应产物的pH 用pH计测定不同反应时间MRPs的pH。
1.3.3 颜色的测定 用色差仪测定,先按照间歇测试方式进行色差仪的调试,然后取一定量的MRPs,将其放入比色皿中,并将测试探头放在比色皿上进行测定。使用O/D测试头,可测定物体本身的颜色和光泽及各检测样之间的色度差值。白板的校正值为L*=90.26,a*=-1.29,b*=5.18。
1.3.4 游离氨基含量的测定 参照Benjakul的方法[11],取125μL 8倍稀释的MRPs样品与2.0mL、0.2125mol/L、pH为8.2的磷酸盐缓冲液混合,再加入浓度为0.01%的TNBS溶液1.0mL,用漩涡振荡器混合均匀,并在50℃水浴中避光保温30min,然后加入2.0mL浓度为0.1mol/L的亚硫酸钠终止反应。反应后的样品在室温下冷却15min,在420nm波长下测定吸光度。以L-亮氨酸为标准物,按同样方法绘制出亮氨酸浓度与吸光值之间的标准曲线回归方程,根据测定样品的吸光值,利用标准曲线方程,计算得出样品中的游离氨基含量。
1.3.5 还原能力的测定 采用Yen等人的方法[12],做适当修改。取0.5mL 8倍稀释的样品,加入2.5mL浓度为0.2mol/L、pH为6.6的磷酸盐缓冲液和2.5mL浓度为1.0%的铁氰化钾溶液,充分混合。将混合物在50℃水浴下保温20min,再加入2.5mL 10%的三氯乙酸溶液,然后将混合物在3000r下离心10min。取2.5mL上层清液,加入2.5mL蒸馏水和0.5mL 0.1%的三氯化铁溶液,混合均匀,在700nm处测定其吸光值。
1.3.6 ABTS自由基清除活性的测定 参照Re等人的方法[13],并稍作修改。用pH 4.5的醋酸钠缓冲溶液配制7mmol/L的ABTS储备液,ABTS储备液和最终浓度为2.45mmol/L的过二硫酸钾反应产生ABTS自由基,混合物预先在室温黑暗处放置12~16h。稳定后的ABTS自由基溶液,用pH 4.5的醋酸钠缓冲溶液(20mmol/L)稀释,使其在734nm处吸光度为0.7±0.02。然后取3mL该溶液与100μL MRPs样品(8倍稀释)充分混合,避光放置6min,在734nm处测定吸光度值。按照下面的公式计算ABTS自由基清除率:

式中:Ac为反应前ABTS自由基溶液的吸光值,As为反应后样品溶液的吸光值。
1.3.7 羟基自由基清除 参照Lee等人的方法[14],取0.75mM邻二氮菲1mL,而后依次加入PBS液2mL和蒸馏水1mL,充分混合,再加入0.75mM硫酸亚铁溶液1mL并混合均匀。然后加入0.01%过氧化氢1mL,在37℃下保温60min,于536nm处测其吸光值,其值为AP。然后用1mL蒸馏水代替1mL过氧化氢,测得值即为AB。最后用8倍稀释的MRPs样品1mL代替之前试验中的1mL蒸馏水,测得值为AS。
清除率(%)=(AS-AP)/(AB-AP)×100%
1.4 统计方法
每个试验重复3次,结果表示为平均数±标准差。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序,采用Sigmaplot 9.0软件作图。
2 结果与分析
2.1 pH的变化
结果见图1。

图1 不同加热时间反应产生的美拉德反应产物pH的变化
由图1可以看出,大豆浓缩蛋白与3种还原糖美拉德反应体系的pH随着反应时间的增加,各反应体系的pH均显著下降(P<0.05),从初始的7.31~7.36,下降至6.86~7.08。还原糖种类的不同对反应体系的pH有显著影响,另外,大豆浓缩蛋白—木糖反应体系的pH下降最显著(P<0.05)。pH的下降,不仅是因为在反应过程中羰氨缩合封闭了游离氨基,而且也与反应过程中甲酸、乙酸等酸性物质的生成有关[15]。Brands等研究发现,酪蛋白—葡萄糖体系中形成的有机酸含量比不添加酪蛋白的体系多,因此可以推断,体系中有机酸的生成依赖于羰基基团和氨基基团中的碳氧双键[16]。Li等人向大米蛋白中添加不同还原糖,研究美拉德反应体系中pH的变化,结果表明大米蛋白和葡萄糖形成的MRPs样品的pH要高于其他还原糖的MRPs样品[17]。另外,在美拉德反应的中间阶段,由于一些具有缓冲能力的酸性化合物的产生,包括甲酸、醋酸、丙酮醛、乙二醛等,抑制了美拉德反应体系的酸性,所以当加热时间延长时,pH的降低趋于平稳状态。
2.2 颜色的变化
由图2可以看出,随着反应时间的增加,大豆浓缩蛋白与3种还原糖美拉德反应体系的a*值显著增加(P<0.05)。同时,相对于葡萄糖和果糖体系来说,大豆浓缩蛋白—木糖反应体系的a*值增加最显著(P<0.05)。Morales等人研究发现,MRPs中的大部分颜色主要产生在反应的后期[5]。同时,不断增加的a*值也说明,在3种体系中的类黑精的产生是颜色变化的主要原因[18]。由于类黑精是以短肽和色素结合而成的混合体,反应时间越长,越有利于产生色素物质,从而加深反应产物的褐变程度。

图2 不同加热时间反应产生的美拉德反应产物颜色的变化
2.3 游离氨基含量的变化
在加热过程中,MRPs游离氨基含量的变化如图3所示。

图3 不同加热时间反应产生的美拉德反应产物游离氨基含量的变化
随着加热时间的延长,大豆浓缩蛋白与各还原糖反应体系中的游离氨基含量都呈现出下降趋势(P<0.05),尤其在0~2h的加热时间内,各体系中游离氨基含量明显持续下降(P<0.05)。在美拉德反应过程中,其游离氨基含量的变化一定程度上反映美拉德反应的进程,所消耗的游离氨基越多,反应越彻底。这个结果表明,当加热进行时,蛋白质或氨基酸的α-或ε-NH2基团更大程度的与糖共价结合形成糖基化蛋白,同时,MRPs重新排列成一个更稳定的酮胺或阿马杜里产物[19]。
2.4 还原能力的变化
还原能力的测定结果如图4所示。

图4 不同加热时间反应产生的美拉德反应产物还原能力的变化
从700nm处吸光度的变化曲线可以看出,随着加热时间的延长,各体系中MRPs的还原能力显著增加(P<0.05),大豆浓缩蛋白—木糖体系的MRPs的还原能力要显著高于其他两种还原糖反应体系(P<0.05)。Yoshimura等人研究表明,蛋白质—还原糖MRPs的还原能力与颜色变化程度有良好的线性关系,反应体系褐变程度越深,还原能力越高[20]。Morales等人通过研究指出,在葡萄糖—赖氨酸MRPs中存在许多能消除过氧化物的化合物(主要存在于褐色素中),过氧化物间接引发脂类氧化[5]。另外,MRPs显著抗氧化能力很可能与它们强有力消除过氧化物有关。
2.5 ABTS和羟基自由基清除活性的变化
如图5(a)所示,随着反应时间的延长,各体系中MRPs的ABTS自由基清除活性显著增加(P<0.05),与还原能力相同,木糖反应体系产生的MRPs的ABTS自由基清除活性要显著高于其他两种还原糖反应体系(P<0.05)。以反应时间6h为例,木糖体系产生的MRPs对ABTS自由基清除活性可达52.90%,而葡萄糖和果糖产生的MRPs的ABTS自由基清除活性分别为40.14%和44.43%。尹姿等人研究发现,木糖—甘氨酸产生的MRPs对ABTS自由基的清除能力随着加热时间的延长而逐渐增强[21];同时,随着反应产物浓度的增大,其清除率逐渐增大,浓度为3.2mg/mL时,自由基清除率达到了98.5%左右。
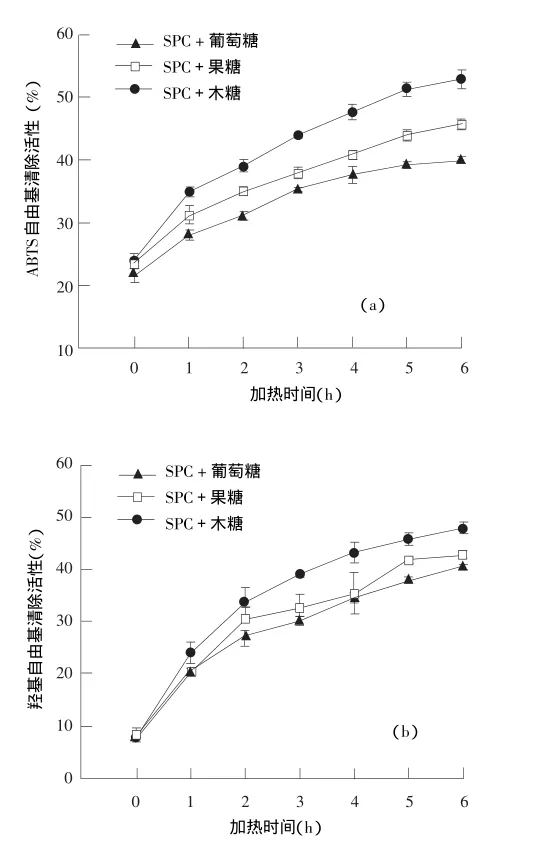
图5 不同加热时间产生的美拉德反应产物ABTS自由基(a)与羟基自由基(b)清除活性的变化
如图5(b)所示,与ABTS自由基清除活性相似,随着反应时间的延长,各反应体系的羟基自由基清除率均显著增强(P<0.05),木糖体系MRPs的羟基自由基清除率提高最为显著(P<0.05)。MRPs在发挥抗氧化作用时,有可能是作为氢供体,其本身也是金属螯合剂,可以螯合Fe2+,因此MRPs拥有比较强的羟基自由基清除能力,也有可能与具有螯合Fe2+的能力有关[22]。
3 结论
本试验通过3种还原糖分别与大豆浓缩蛋白发生美拉德反应,研究其产物的理化特性及抗氧化活性。经过试验证实该反应是一个酸度和颜色逐渐增强的反应。在反应过程中均有一定的新物质产生,反应过程中所生成的MRPs具有良好的抗氧化功能,其中木乳糖反应体系得到的MRPs具有最高程度的褐变和最显著的还原能力以及自由基清除能力。因此,大豆浓缩蛋白—还原糖反应体系产生的MRPs可以作为一种抗氧化剂来防止食物的脂质氧化。
[1]Serpen A,Ataç B,Gökmen V.Adsorption of Maillard reac⁃tion products from aqueous solutions and sugar syrups us⁃ing adsorbent resin[J].Journal of Food Engineering,2007,82(3):342-350.
[2]Giusti A M,Bignetti E,Cannella C.Exploring new fron⁃tiers in total food quality definition and assessment:From chemical to neurochemical properties[J].Food and Biopro⁃cess Technology,2008,1(2):130-142.
[3]Karoui R,Nicolaï B,De Baerdemaeker J.Monitoring the egg freshness during storage under modified atmosphere by fluorescence spectroscopy[J].Food and Bioprocess Technology,2008,1(4):346-356.
[4]Lertittikul W,Benjakul S,Tanaka M.Characteristics and
antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influ⁃enced by pH[J].Food Chemistry,2007,100(2):669-677.
[5]Morales F J,Jiménez-Pérez S.Free radical scavenging ca⁃pacity of Maillard reaction products as related to colour and fluorescence[J].Food Chemistry,2000,72(1):119-125.
[6]Jing H,Kitts D D.Chemical and biochemical properties of casein-sugar Maillard reaction products[J].Food and Chemical Toxicology,2002,40(7):1007-1015.
[7]管军军,白新鹏,方希修.微波合成大豆蛋白-糖接枝物理化性质的研究[J].食品科学,2007(28):30-35.
[8]赵艳娜,辛岩,姜瞻梅.乳清蛋白糖基化反应特性及抗氧化性的研究[J].中国乳品工业,2010,38(8):18-21.
[9]赵剑飞.大豆分离蛋白与糖基化分离蛋白乳化性的研究[J].食品工业科技,2005(12):76-78.
[10]罗永康,张爱荣.糖基化反应改善蛋白质功能特性的研究进展[J].食品科技,2004(7):4-6.
[11]Benjakul S,Morrissey M T.Protein hydrolysates from Pa⁃cific whiting solid wastes[J].Journal of Agricultural and Food Chemistry,1997,45(9):3423-3430.
[12]Yen G C,Duh P D.Antioxidative properties of methanolic extracts from peanut hulls[J].Journal of the American Oil Chemists’Society,1993,70(4):383-386.
[13]Re R,Pellegrini N,Proteggente A,et al.Antioxidant activ⁃ity applying an improved ABTS radical cation decolouriza⁃tion assay[J].Free Radical Biology and Medicine,1999,26(9):1231-1237.
[14]Lee J C,Kim H R,Kim J,et al.Antioxidant property of an ethanol extract of the stem of Opuntia ficus-indica var.Saboten[J].Journal of Agricultural and Food Chemistry,2002,50(22):6490-6496.
[15]Rufian-Henares J A,Morales F J.A new application of acommercial microtiter plate-based assay for assessing the antimicrobial activity of Maillard reaction products[J].Food Research International,2006,39(1):33-39.1
[16]Brands C M J,Van-Boekel M A J S.Reactions of mono⁃saccharides during heating of sugar-casein systems:Build⁃ing of a reaction network model[J].Journal of Agricultural and Food Chemistry,2001,49(10):4667-4675.
[17]Li Y,Lu F,Luo C,et al.Functional properties of the Mail⁃lard reaction products of rice protein with sugar[J].Food Chemistry,2009,117(1):69-74.
[18]Adams A,Borreli R,Flogiano V,et al.Thermal degrada⁃tion studies of foods melanoidins[J].Journal of Agricultural and Food Chemistry,2005,53:4136-4142.
[19]Friedman M.Food browning and its prevention:an over⁃view[J].Journal of Agricultural and Food Chemistry,1996,44(3):631-653.
[20]Yoshimura Y,Iijima T,Watanabe T,et al.Antioxidative effect of Maillard reaction products using glucose-glycine model system[J].Journal of Agricultural and Food Chemis⁃try,1997,45(10):4106-4109.
[21]尹姿,张曦,景浩.木糖-甘氨酸美拉德反应蓝色产物抗氧化能力和细胞毒性的研究[J].食品科技,2011,36(6):272-276.
[22]Wagner K H,Derkits S,Herr M,et al.Antioxidative po⁃tential of melanoidins isolated from a roasted glucose-gly⁃cine model[J].Food Chemistry,2002,78(3):375-382.

