超氧化物歧化酶及其应用的研究进展
徐靖
(西安外事学院医学院,陕西西安710077)
超氧化物歧化酶(superoxide dismutase;SOD)是生物体内存在的一种抗氧化金属酶,它能够催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用,与很多疾病的发生、发展密不可分[1-2]。其分布较广,于微生物及动植物中的均有发现,按所含金属离子主要分为三类:铁超氧化物歧化酶(Fe-SOD)、锰超氧化物歧化酶(Mn-SOD)和铜锌超氧化物歧化酶(Cu/Zn-SOD)[3-4],已有研究表明,在生物体内存在还存在一种细胞外铜锌超氧化物歧化酶(EC-SOD)[5]。在链霉菌属中还存在一种镍超氧化物歧化酶Ni-SOD[6],此外在S coelicotor中曾报道存在性质类似于Fe-SOD的Fe/Zn-SOD[7]。超氧化物歧化酶能够修复受损细胞,复原自由基对人及动植物机体造成的损伤。超氧化物歧化酶具有许多独特的生物及生理学特性,可以治疗多种疾病,并且在防辐射、抗肿瘤,植物抗逆性等方面也有积极的作用。本文从超氧化物歧化酶的定义及分类、结构、分布、测定方法以及其自身特性的应用方面进行综述,以期为进一步开发其潜在应用价值提供理论参考。
1 SOD的基本概念
1.1 超氧化物歧化酶的结构及特性
Fe-SOD由3个His、1个Asp和1个H2O形成扭曲的配位四面体[8]。Mn-SOD则是氨基酸残基构成的四面体。Cu/Zn-SOD分子是由非共价键疏水相互作用连接的两个相同的亚基通过缔合形成四方锥结构[9-13]。三种SOD的主要理化特性详见表1。
1.2 超氧化物歧化酶的分布
真菌里一般含Mn-SOD和Cu/Zn-SOD。大多数真核藻类在其叶绿体基质中存在Fe-SOD,类囊体膜上结合着Mn-SOD,而多数藻类中不含Cu/Zn-SOD。植物细胞中的Fe-SOD主要存在于叶绿体中[16]。大多数原始的无脊椎动物细胞中都存在Cu/Zn-SOD,脊椎动物则一般含有Cu/Zn-SOD和Mn-SOD。人、鼠、猪、牛等红细胞和肝细胞中含Cu/Zn-SOD,且其主要存在于细胞质,同时也存在于线粒体内外膜之间。而从人和动物肝细胞中也纯化了Mn-SOD,其一般存在于线粒体基质中[17]。
2 超氧化物歧化酶的测定
超氧化物歧化酶活性的主要测定方法有邻苯三酚自氧化法、黄嘌呤氧化酶-细胞色素C还原法[18]、化学发光法及荧光动力学法等。近年来又建立了多种新方法,如简易凝胶过滤扩散法、放射免疫法、极谱氧电极法、微量测活方法等[19-22]。严万里等[23]鉴定了SOD活性测定中的影响因素,为研究SOD活性的测定提供理论参考。
3 超氧化物歧化酶特性的应用及修饰
3.1 超氧化物歧化酶基因多态性在病理学方面的应用
哺乳动物组织存在的Cu/Zn-SOD(SOD1)、Mn-SOD(SOD2)和EC-SOD(SOD3)分别在机体中发挥着独立的作用[24-26],它们的表达因在不同组织和疾病状态下而不同。a.Cu/Zn-SOD的活性的增加会减轻氧化物增多而造成的肝损伤[17]。VALENTINE JS等[27]研究显示,家族性侧索硬化症与Cu/Zn-SOD的基因突变存在相关性。b.Mn-SOD则可以清除由呼吸链反应中所产生的自由基,减轻机体所受到的过氧化导致的损伤[28-29]。Kazuhiko等[30]的研究表明MnSOD基因多态性与冠心病、血浆总超氧化物歧化酶(T-SOD)和Mn-SOD活性的有关系。杨茂平等[31]采用比色法测定血浆T-SOD和Mn-SOD活性,检测了冠心病患者和对照者的Mn-SOD基因多态性,结果显示,MnSOD的基因多态性通过影响血浆Mn-SOD活性成为导致冠心病加剧的危险因素。c.EC-SOD是一种分泌性糖蛋白,其可以清除体内多余的O·,保护一氧化氮的活性,在人体血管中NO可以调节血压、抑制血小板和黏附、聚集舒张动脉、改变血管的基础张力从而保持血管血流畅通[32]。EC-SOD的过表达可以有效减少肺损伤中嗜中性粒细胞的堆积,从而减轻肺部急性炎症[33-34]。EC-SOD的多态性除了与抗氧化作用有关外,还发现与血压升高和脑梗死的范围增加有关[35-36]。人体关节中含有大量的EC-SOD,它们结合在关节软骨的汇总的I型胶原蛋白上,可以有效地清除氧自由基,保护胶原蛋白,可以期待在将来可以将EC-SOD可能会成为预防和治疗关节炎的有效药物[37]。
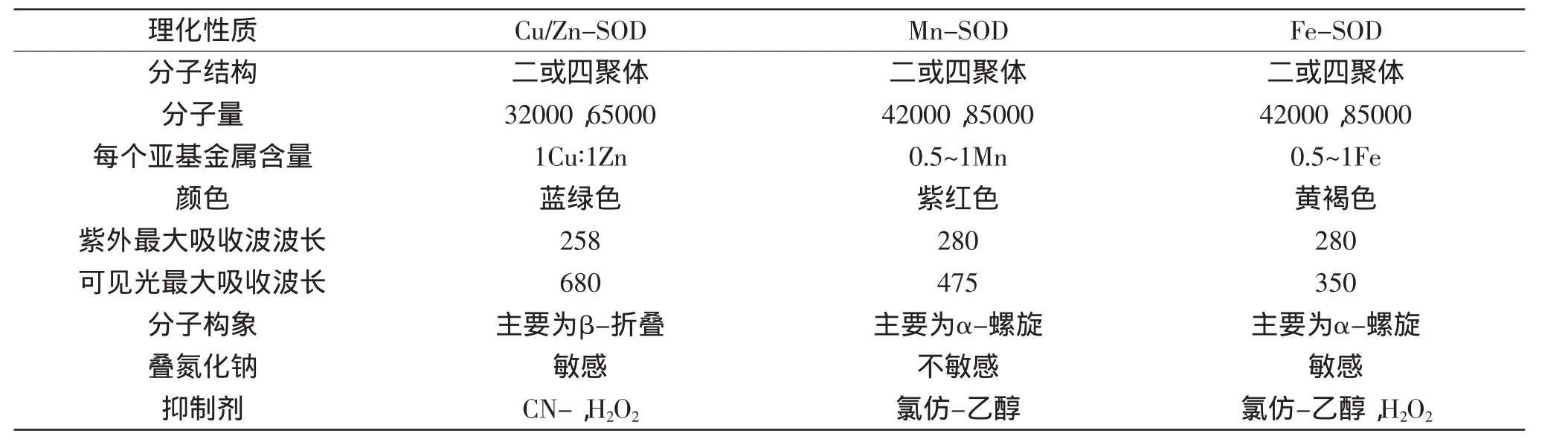
表1 三种过氧化物歧化酶的理化性质[14-15]Table1 Physiochemical characteristics of three SODs
还有学者认为慢性酒精中毒就是因为体内的超氧化物歧化酶由于酒精的过量摄入而减少,从而导致过多的O·留在机体中,攻击生物膜中的多不饱和脂肪酸,形成多种脂质过氧化物,使细胞流动性下降,导致细胞功能障碍。因此提高体内SOD水平,有利于慢性酒精中毒者的治疗[38]。
3.2 超氧化物歧化酶在抗肿瘤方面的应用
高浓度活性氧会损伤细胞内的脂质、DNA和蛋白质,使健康的正常细胞受到刺激转化为肿瘤[39]。而Mn-SOD活性对细胞的这种静止和扩增的转换可以通过调节细胞内的氧的水平来控制[40]。大量研究证实Mn-SOD与癌症的易感性和治疗效果有关系。MnSOD表达缺失或表达水平的下降,可诱导癌细胞的凋亡。鼻咽癌中MnSOD的表达比正常组织中的含量明显升高[41],而王明臣等[42]发现前列腺癌组织中MnSOD的转录水平明显低于正常组织。张默涵等[43]的研究表明:乳腺浸润性导管癌组织中Mn-SOD mRNA和蛋白表达明显下降,其实验结果证实检测MnSOD的表达可作为临床诊治及判定乳腺浸润性导管癌愈后的指标。薛玉仙等[44]进行的体外细胞实验证实了Mn-SOD可以明显诱导结肠癌细胞的凋亡;而转染MnSOD cDNA的骨肉瘤细胞生长受到明显的抑制。
3.3 超氧化物歧化酶对辐射的防护作用
癌症患者在接受放射治疗时,会引发电离辐射损伤[45]。放射产生的氧自由基(ROS)的连锁反应会造成细胞生物膜损伤,导致生物分子的氧化损伤,酶活性降低或者消失,引发放射后效应,因此,阻断ROS的产生或清除已产生的ROS是防治放射损伤的有效策略[46]。以O·为特异性识别底物的SOD是生物体防御氧化损伤的一种重要的酶,是放射损伤较理想的防护剂[47]。有报道表明重组人源性Mn-SOD(rhMn-SOD)对小鼠紫外线辐射所致的外周器官氧化损伤有一定的保护作用[48],而小鼠腹腔注射CuZn-SOD能减轻急性辐射造成的皮肤损伤[49]。Lefaix等[50]研究表明肌注Cu/Zn-SOD能使辐射引起的皮肤纤维化衰退。Jin等[51]将野生型和缺少胞质C,Zn-SOD、线粒体Mn-SOD或者二者均缺的突变型酵母菌株暴露于离子辐射中,结果表明,突变型的菌株对辐射更敏感,而野生型菌株有更高的抗氧化酶活性。说明超氧化物歧化酶可以保持抗氧化酶的活性,并且使机体免受离子辐射危害。
3.4 超氧化物歧化酶在植物抗逆性方面的应用
大多数植物由于其在生长过程中在自然界中易受到强光、干旱、温度和辐射等外界因子的胁迫,而这些逆境条件都会引起自身ROS含量的升高而给植物细胞带来细胞损伤,因此植物抗逆性是实际生产中备受关注的一个问题。姜岩岩等[52]研究得出低温敏感性番茄通过提高SOD的活性来适应低温;耐低温的番茄受伤害程度较低。姚冉等[53]从一株地热芽孢杆菌(Geobacillus)中克隆得到Cu/Zn-SOD基因,构建了植物表达载体pZP211-Cu/ZnSOD,并通过农杆菌介导对烟草进行遗传转化。对转基因烟草进行耐盐性检测,证明Cu/Zn-SOD基因确实能够提高烟草对盐胁迫的耐受。
近年来也有采用体外组织或是细胞培养技术对SOD诱导进行研究,结果表明:在实验材料一致,SOD对外界条件的可控制性和灵敏性方面存在优势,同时还能够消除器官分化带来的影响[54]。
不同的SOD基因在转基因植株的表达主要有两种:一种是过量表达SOD的转基因植株未提高胁迫耐性,另一种是SOD过量表达赋予转基因植株较好的活性氧胁迫耐性。通过转SOD基因技术来培育高抗逆农作物新品种和基因克隆与表达技术来实现SOD的大规模发酵生产,已成为国内外SOD研究领域的热点之一[55]。这其中既包括了来自细菌如大肠杆菌的Fe-SOD基因,也有来自动植物细胞如人的Cu/Zn-SOD基因[56]。Mn-SOD在烟草和玉米叶绿体中的过量表达能够增强转基因烟草和玉米对质膜的保护作用和对除草剂引起的氧胁迫的耐受性[57,59]。研究者将烟草的Mn-SOD cDNA转入苜蓿使其在转基因植株线粒体中过量表达,从而提高了冷害的耐受性和下一年的产量;还有报道称Mn-SOD融合基因转移到烟草的叶绿体中之后,可以抵抗除草剂引起的氧胁迫[57-58]。
虽然SOD基因的过量表达在一定程度上提高了转基因植物对氧胁迫的耐受性,但是仍需要SOD与其他的抗氧化酶共同作用才能使超氧物阴离子自由基被有效清除[60]。
3.5 超氧化物歧化酶的修饰
虽然超氧化物歧化酶有许多的生理及生物学特性可以为人类加以利用,但是在相关领域实际应用时,由于其有许多缺陷限制了其应用。为了克服这些缺点,国内外的学者尝试各种方式对SOD分析进行改造。
3.5.1 聚乙二醇(PEG)修饰超氧化物歧化酶 将利用三聚氯氰活化法、氰脲酰氯法等活化后的PEG与SOD缩合,修饰SOD。尹亮等发现修饰效果最好的是分子量6000的PEG,有较强的酸、碱和酶抗性,并且活性残余率较高,修饰后的SOD各方面的耐受性显著提高[61-62],其温度稳定性与天然蛋白相比也有明显的提高。
3.5.2 脂肪酸类修饰超氧化物歧化酶 研究表明,月桂酸修饰后的得到的SOD,与天然SOD相比,温度、pH、人胃液中的稳定性大大提高,回收率提高到90%以上,酶活提高了一倍[63-64]。
3.5.3 糖类修饰超氧化物歧化酶 壳聚糖是聚阳离子黏多糖,活性基团羟基、氨基等可以被活化剂活化。Liu等用研究结果表明,两种糖化SOD都能够显著升高细胞内SOD酶活以及增强对小鼠腹腔诱导的巨噬细胞的亲和力,从而更好的被巨噬细胞摄取;进一步研究发现,两种多糖修饰物均能够有效降低由60Coγ射线辐射诱导的炎症细胞因子TGF-β及IL-1β的表达[65-66]。
3.5.4 β-环状糊精修饰超氧化物歧化酶 用β-环状糊精修饰的SOD,78℃作用40m in后,活力保留率比未修饰的酶提高21.3%,pH 4和pH10的酸碱环境中分别作用40m in后,活力保留率比未修饰的酶分别提高10.2%和29.5%[67]。
3.5.5 固化酶技术修饰超氧化物歧化酶 交联剂固定化酶通常情况下,壳聚糖作为载体,利用交联剂将本身的活性基团结合于戊二醛等分子上,再与SOD结合。采用壳聚糖为载体,戊二醛为交联剂的固定方法进行了SOD的制备,制备好的固定化SOD在许多方面明显优于天然SOD,强碱和强酸条件下,保持着高活性。这种包埋固定技术得到了具有稳定保存,抗酸抗碱等诸多优点的SOD[68-69]。
3.5.6 脂质体包裹修饰超氧化物歧化酶 利用冷冻干燥法,薄膜分散法,超声波分散法等将SOD包封于类脂质双分子层中,形成微型泡囊体,制备脂质体SOD。将未修饰的SOD和用脂质体包裹的SOD分别作用于肝癌细胞,后者在作用2h后,肝癌细胞中伴随着GSH显著提高,活性氧水平明显降低,说明修饰的SOD有效地降低了细胞内的氧化应激,有明显的抗氧化效果,说明脂质体SOD有稳定性、靶向性、定向性等特点[70]。
修饰后的SOD不仅能够保留天然酶的活性,还具有了更加较之天然SOD显著的诸多优势如:a.半衰期的延长,b.免疫原性的降低,c.膜通透能力的增加,d.理化性质的优化。这些特点将使其的应用领域进一步拓展。
4 展望
人类的衰老与人体内的ROS的生成密切相关,且已有研究表明,超氧化物歧化酶与人的大脑记忆、表达和调控能力有关。进一步研究控制SOD表达量在癌症中发挥的作用,可以作为一种临床诊断的指标,成为判定及治疗肿瘤中的药物靶点[71]。在存在适当的稳定剂及基质的条件下,补充外源的超氧化物歧化酶可以调节人体代谢、提高免疫力,对防止某些疾病、抗辐射治疗对机体的损伤、延缓人体衰老有一定的作用,可以考虑将其作为食品中的保鲜剂、抗氧化剂以及营养强化剂,有着很大的开发潜力。
[1]McCord JM.Superoxid edismu tase:An enzymatic function for erythrocuprein(hem ocup rein)[J].JBiol Chem,1969,244:6049-6055.
[2]Wallace DC.Mitochondria l diseases in man and mouse[J] Science,1999,283:1482-1488.
[3]Smith RAJ,Kelso GF,Blaikie FH,et al.Usingmitochondriatargeted molecules to studymitochondrial radical production and its consequences[J].Biochem Soc Trans,2003,31:1295-1299.
[4]Wu WK,Mak CH,Ko RC.Cloning and differential expression ofmanganese super oxide demitasse(Mn-SOD)of Trichinellap seudospiralis[J].Parasitol Res,2008,102:251-258.
[5]章轶锋,唐善虎,秦文玲,等.铜锌超氧化物歧化酶的研究进展[J].四川畜牧兽医,2008(1):33-35.
[6]PrashaniM,Hyun-SilK,Mahanama D,etal.Molecular cloning and characterization of Mn-superoxide dismutase from disk abalone(Haliotisdiscus discus)[J].Comparative Biochemistry and Physiology,2006:318-324.
[7]于平.超氧化物歧化酶研究进展[J].生物学通报,2006,41(1):4-6.
[8]张晓燕.超氧化物歧化酶的研究现状及在食品中的应用综述[J].扬州职业大学学报,2002,6(1):34-37.
[9]王震宙,陈红兰.SOD的应用研究进展[D].上海:中国科学院上海冶金研究所,2000.
[10]蔡敬杰,樊志.超氧化物歧化酶的研究进展[J].天津化工,1997(2):2-4.
[11]张艳红,廖晓全,袁勤生.人锰超氧化物歧化酶(hMn-SOD)研究进展[J].药物生物技术,2001,8(6):352-356.
[12]丁书茂,杨旭.超氧化物歧化酶及其模拟化合物研究进展[J].高等函授学报:自然科学版,2004,17(1):1-5.
[13]张欣.超氧化物歧化酶(SOD)及其研究进展[J].内蒙古石油化工,2010(6):14-15.
[14]杨卫健,张双全.超氧化物歧化酶的研究及应用前景[J].淮阴师范学院学报:自然科学版,2002(4):82-86.
[15]辛瑞晓.哈维氏弧菌超氧化物歧化酶的原核表达及免疫原性的研究[J].青岛:中国海洋大学,2011.
[16]裴轶琨.酵母SOD高产菌的选育及发酵条件的研究[J].长春:吉林大学,2006.
[17]HIRONORI N,IKUO I,AYANO I,et al.Relationship between oxidative stress and antioxidant systems in the liver of patients with wilson disease:hepatic manifestation in wilson disease as a consequence of augmented oxidative stress[J]Pediatr Res,2006,60(4):472-477.
[18]王舍文.刘建荣,静天玉,等.掇量超氧化转歧化醇邻苯三酚/ VC测活法[J].河北大学学报:自然科学版,2000,20(1):61-62.
[19]圭向东,肖亚中,郭振,等.外界条件对玉米以及马齿苋叶片SOD活性诱导研究[J].生物学杂志,2003(1):27-29.
[20]柯世省,王克满.刺梨汁SOD及其同工酶的活力测定与定位染色[J].浙江农业学报,2001,13(3):176-178.
[21]谢秋玲,郭勇.超氧化物歧化酶活力测定方法及其进展[J].广东药学,1997(4):1-4.
[22]武强.健康成人血清邻苯三酚法测定超氧化物歧化酶参考范围的建立[J].检验医学,2013,28(2):114-116.
[23]严万里,陈晓明,郭丽燕,等.超氧化物歧化酶活性测定的影响因素研究[J].生物学通报,2011,46(3):50-53.
[24]IIDA R,TSUBOTA E,TAKESHITA H,et al.Multiplex single base extension method for simultaneous genotyping of non-synonymous SNP in the three human SOD genes[J].Electrophoresis,2008,29(23):4788-4794.
[25]Hiroki Fujita,Hiromi Fujishima,Keiko Takahashi,et al.SOD1,but not SOD3,deficiency accelerates diabetic renal injury in C57BL/6-Ins2 Akita diabetic mice[J].Metabolism,2012,61(12):1714-1724.
[26]Sabrina Bauer.Elevated free fatty acids and impaired adiponectin bioactivity contribute to reduced SOD2protein in monocytes of type 2 diabetes patients.[J].Experimental and Molecular Pathology,2010,90(1):101-106.
[27]VALENTINE JS,DOUCETTE PA,POTTER SZ.Copperzinc superoxide dismutase and amyotrophic lateral sclerosis[J].Annu Rev Biochem,2005,74:563-593.
[28]YI JF,LIYM,LIU T,et al.Mn-SOD and Cu/Zn-SOD polymorphisms and interactions with risk factors in gastric cancer[J].World JGastroenterol,2010,16(37):4738-4746.
[29]ARCAROLI JJ,HOKANSON JE,ABRAHAM EG,et al.Extracellular superoxide dismutase haplotypes are associated with acutelung injury and mortality[J].Am J Respir Crit Care Med,2009,179(2):105-112.
[30]KAZUHIKO N,CHIH-KEN C,YOSHIMOTO S,et al.Association analysis of SOD2variants with methamphetamine psychosis in Japanese and Taiwanese populations[J].Human Genetics,2006,120(2):243-252.
[31]杨茂平,叶林秀,邱红,等.锰超氧化物歧化酶9 Ala/Val基因多态性与冠心病的关系[J].武汉大学学报:医学版,2008,29(6):775-779.
[32]Younghwa Kim,Byung Hak Kim,Hyangkyu Lee,et al.Regulation of skin inflammation and angiogenesis by EC-SOD via HIF-1αand NF-κB pathways[J].Free Radical Biology and Medicine,2011,51(11):1985-1995.
[33]Zahid N R,Mitchell SA,Rodney JF,et al.Over expression of extracellular superoxide dismutase reduces acute radiation induced lung toxicity[J].Cancer,2005(5):59-62.
[34 ARCAROLI JJ,HOKANSON JE,ABRAHAM EG,et al.Extracellular superoxide dismutase haplotypes are associated with acutelung injury and mortality[J].Am J Respir Crit Care Med,2009,179(2):105-112.
[35]NAGANUMA T,NAKAYAMA T,SATO N,et al.A haplotypebased case-controlstudy examining human extracellular superoxide dismutase gene and essential hypertension[J].Hypertens Res,2008,31(8):1533-1540.
[36]TAKAHIRO N,TOMOHIRO N,NAOYUKI S,et al.Association of extracellular superoxide dismutase gene with cerebral infarction in women:a haplotype-based case-control study[J].Hereditas,2008,145(6):283-292.
[37]章轶锋,唐善虎,秦文玲,等.铜锌超氧化物歧化酶的研究进展[J].四川畜牧兽医,2008(1):33-35.
[38]李沛,扈美庄,何新萍,等.饮酒成年男子红细胞免疫状态与超氧化物歧化酶和过氧化脂质关系的研究 [J].现代预防医学,2008,35(13):2587-2590.
[39]杨书云,李海波,张建斌.浸润性乳腺癌HDAC1 mRNA表达的临床病理意义[J].临床与实验病理学杂志,2011,27(9):929-932.
[40]EHAB HS,SUJATHA V,AMANDA LK,et al.Manganese superoxide dismutase activity regulates transitions between quiescent and proliferative growth[J].Aging Cell,2008,7(3):405-417.
[41]刘青,王雅棣,董稚明,等.锰超氧化物歧化酶和E-钙黏蛋白在鼻咽癌组织中的表达及意义[J].中华放射肿瘤学杂志,2009,18(1):37-41.
[42]王明臣,郭茂锋,赵国强,等.前列腺癌及良性前列腺增生组织中MnSOD基因的mRNA表达水平研究[J].中国老年学杂志,2006,26(2):164-165.
[43]张默函,周宪春,李良昌,等.锰超氧化物歧化酶在乳腺浸润性导管癌中的表达及临床意义[J].临床与实验病理学杂志,2012,28(9):956-958,962.
[44]Zhang Y,Qin X,Zhang Y,et al.Combination of ZD55-MnSOD therapy with 5-FU enhances antitumor efficacy in colorectal cancer[J].JCancer Res Clin Oncol,2008,134(2):219-226.
[45]贾晓民.超氧化物歧化酶对荷瘤体免疫细胞的辐射防护作用[D].苏州:苏州大学,2003.
[46]谢继青,李玉华,杨春梅,等.超氧化物歧化酶的药理作用[J].中国生化药物杂,2009,30(1):72-75.
[47]Khan M A,Van D J,Yeung IW,et al.Partial volume rat lung irradiation;assessment of early DNA damage in different lung regions and effectof radical scavengers[J].Radiother Oncol,2003,66(1):95-102.
[48]殷铭俊,潘家祜,王尊生,等.重组人源性锰超氧化物歧化酶对小鼠紫外线辐射所致氧化应激的保护作用[J].中国临床药学杂志,2006,12(5):86-89.
[49]Abe M,Nishidai T,Yukawa Y,et al.Studies on the radio protective effects of superoxide dismutase inmice[J].Int JRadiat Oncol Biol Phys,1981,7:205-209.
[50]Lefaix JL,Delanian S,Leplat JJ,etal.Successful treatment of radiation-induced fibrosis using Cu/Zn-SOD and Mn-SOD:An experimental study[J].Int JRadiat Oncol Biol Phys,1996,35:305-308.
[51]Jin H L,In Y C,In SK,et al.Protective role of superoxide dismutase against ionizing radiat ion in yeast[J].Biochim Biophys Acta,2001,1526:191-198.
[52]姜岩岩,徐晓飞,郝桂杰,等.夜间低温对栽培和野生番茄果实抗逆性的影响[J].华北农学报,2012(6):97-101.
[53]姚冉,李轶女,张志芳,等.Cu/Zn-SOD基因植物表达载体的构建及其在烟草中的表达[J].生物技术通报,2012(11):78-82.
[54]曹淑华,查向东.超氧化物歧化酶研究综述[J].安徽农业科学,2003,31(4):599-601.
[55]郭兴,潘登奎,罗晓丽.植物超氧化物歧化酶的研究及其在基因工程中的应用[J].山西农业科学,2008,36(3):3-6.
[56]Gupta AS,Heinen JL,Holaday AS.Increased Resistance to Oxidative Stress in Tnmsgenic Plants that Overespress Chloroplastie Cu/Zn Superoxide Dismutase[J].Proe Nail AcadSci USA,1993,90:1629-1633.
[57]Bow le r C,S looten L,V andenbranden S,et al.Manganese superoxide dismutase can reduce cellular damage mediated by oxygen radicals in transgenic plants[J].The EMBO Journa,1991,10:1723-1732.
[58]McK ersie BD,Bow ley SR,Jones KS1W.inter survival of transgenic alfalfa overexpressing superoxide dismutase[J].PlantPhysio,1999,119:839-848.
[59]Breusegem FVSL,Stassart JM,Moens T.Effects of overproduction of tobacco MnSOD inmaize chloroplasts on foliar tolerance to cold and oxidative stress[J].Exp Bot,1999,50:71-78.
[60]汪本勤.植物SOD的研究进展[J].河北农业科学,2008,12(3):6-9,12.
[61]陈红漫,刘剑利.玉米SOD的纯化与化学修饰[J].食品科学,2007(2):70-73.
[62]尹亮,赵树进.聚乙二醇修饰超氧化物歧化酶稳定性变化的研究[J].生物技术,2003(4):29-30.
[63]Zhan ZJ,Zhou ZG,ShanWG.Preparation and characterization of Cu,Zn-superoxide dismutase covalently modified by polyunsaturated fatty acids[J].Biochemistry(Moscow),2009,74(11):1266-1269.
[64]陈红漫,刘剑利.玉米SOD的纯化与化学修饰[J].食品科学,2007(2):70-73.
[65]曹向宇,刘剑利,朱俊丰,等.右旋糖苷修饰玉米SOD研究[J].食品研究与开发,2010,31(3):17-19.
[66]Jingfeng Liu,Li Teng,Chunhui Liu,et al.Augmented inhibitory effect of superoxide dismutase on superoxide anion release from macrophages by chemical modification with polysaccharide and attenuation effects on radiation-induced inflammatory cytokine expression in vitro[J].Journal of Drug Targeting,2009,17(3):216-24.
[67]李磊,马长清,刘飞鸽,等.超氧化物歧化酶的固定化及其酶学性质[J].中国生物制品学杂志,2009,22(2):153-157.
[68]王政,刘忠信,汪晓青,等.超氧化物歧化酶的微胶囊化[J].中国食品添加剂,1999(2):15-17.
[69]周诗毅,袁均林,贺红武.包埋法固定SOD及固定化酶性质的研究.华中师范大学学报:自然科学版,2005,39(1):97-99.
[70]滕利荣,逯家辉,王婧,等.牛血清白蛋白对超氧化物歧化酶的化学修饰[J].生物技术,2004,14(3):37-40.
[71]Shinji Fukui,Tomomi Ookawara,Hiroshi Nawashiro,et al.Post-ischemic transcriptional and translational responses of ECSOD in mouse brain and serum[J].Free Radical Biology and Medicine,2002,32(3):289-298.

