甲醛超临界水气化动力学模型
赵 亮 张 军 钟 辉 丁启忠 陈孝武 徐成威 任宗党
(东南大学能源热转换及其过程测控教育部重点实验室,南京210096)
生物质超临界水气化技术因其具有气化率高(可达100%)、H2含量高(可超过50%)、二次污染小(不产生焦油)和能耗小(可直接利用湿生物质)等特点,已成为国内外研究的热点[1].然而鉴于实际生物质[2]、生物质模型化合物[3]以及大分子中间产物[4]超临界水气化转化过程的复杂性,实验及理论研究其转化路径相对比较困难,至今对其超临界水降解转化机理还了解较少.
甲醛是生物质超临界水气化降解过程中生成的重要小分子中间产物[5].从研究简单小分子中间产物开始进而对较大分子中间产物的降解反应机理进行研究,是对最终确定生物质在超临界水中气化降解反应机理的一条有效的途径.文献[1,6-7]实验研究了甲醛在超临界水中的降解转化,推测了甲醛超临界水降解过程中可能的转化路径.然而由于转化过程的复杂性以及低浓度小分子中间产物定性定量检测的困难,仅采用实验方法不能对甲醛超临界水降解反应机理进行更为详细的研究.因此,Ohno 等[8]采用量子化学计算软件理论分析了甲醛单分子直接分解过程,给出了其详细转化路径,然而此研究未考虑超临界水反应介质对甲醛降解过程的重要影响.除此之外,Watanabe 等[6]在实验基础上进一步提出了甲醛超临界水降解过程初步转化路径,建立了相关动力学模型,但是该动力学模型未对中间产物的转化过程进行详细分析.而文献[1]发现甲醛降解过程中还生成了一定含量的甲酸甲酯和甲缩醛,因此本文进一步完善甲醛超临界水降解的动力学模型,同时深入分析转化过程中各中间产物的相互关系,揭示甲醛在超临界水中的主要转化机理.
1 模型的建立
Watanabe 等[6-7]采用釜内容积为6 mL 的间歇式316 不锈钢反应釜进行实验研究,实验前向釜内加入0.1 g 多聚甲醛和1.0~3.0 g 去离子水,并充入一定氩气使釜内初压达到1 MPa.然后将反应釜置于高温盐浴中加热,使釜内温度快速达到400 ℃(此时釜内压力30 MPa),在400 ℃下停留3~28 min 后迅速水冷反应釜至室温,开始收集气相产物(GC 分析),泄压后收集液相产物(HPLC 分析).张国妮等[1]采用反应段容积为137 mL 的连续式316 L 不锈钢反应器进行实验研究.实验前配置6%~14 %甲醛溶液作为反应物料.首先用去离子水作为流动介质,使反应系统达到实验条件(温度500~600 ℃、压力25~30 MPa、停留时间14~34 s),之后切换加料罐使相应甲醛溶液进入反应器.待进入反应器的甲醛溶液浓度达到基本稳定后借助分液漏斗分离收集气液产物(GC 分析).连续式超临界水降解系统中,反应停留时间t 定义为[9]

式中,v 为反应段容积;ρ 为反应条件下物料密度;F 为物料质量流量.
研究表明[1,6-7],甲醛超临界水降解过程中主要 生 成 了 H2,CO,CO2,CH3OH,HCOOH,CH3OOCH 和CH2(OCH3)2.本文结合文献[1,6]的研究结果,确立了10 个重要基元反应,建立如下转化路径:
Cannizzaro 反应

脱羧反应
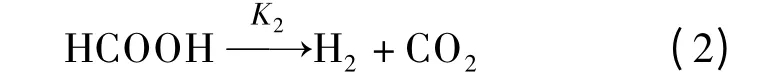
脱羰反应

HCHO 直接分解反应
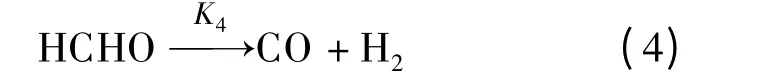
水气变换反应
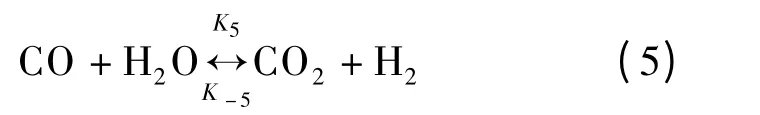
负氢离子转移反应

HCOOH 合成反应

醇醛缩合反应

CH3OH 脱氢反应
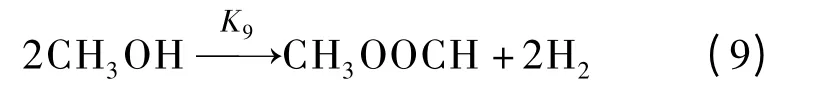
酯化反应
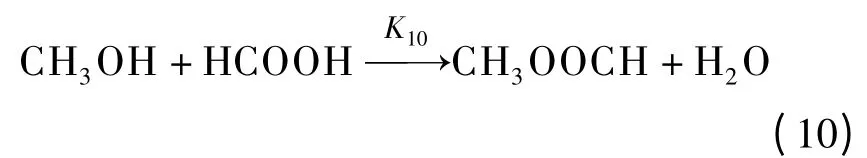
利用经典化学动力学基本定理,列出上述各组元的反应速率方程,即


式中,Ki(i =1~10)表示第i 个基元反应速率常数;K-5为水气变换逆反应速率常数.本文采用Watanabe等[6-7]的甲醛降解实验数据及Resende[10]的数据处理方法进行动力学模型研究.基于400 ℃、30 MPa、甲醛初始浓度[HCHO]0=0.56 mol/L、停留时间3~28 min 情况下研究各组元浓度的变化[7],根据最小二乘法原理计算得到Ki,而K-5则由水气变换反应平衡常数Kp(Kp=K5/K-5,400 ℃时Kp=11.7[11])求得.最终求得的各基元反应速率常数如表1所示.由表可见,负氢离子转移、酯化、Cannizzaro 和HCOOH 脱羧反应进行较快,而水气变换反应速率非常低,这是由于低温、高压条件下自由基反应较弱[12],使得水气变换反应进行较慢;HCOOH 合成及醇醛缩合反应速率非常低,这表明该基元反应在本实验工况下很难发生.此外由表1可见,甲酸超临界水降解过程中,脱羧反应为主要反应,脱羰反应为次要反应,这与张永春等[9]的研究结论一致.在400 ℃、30 MPa 时由各基元反应速率常数求得的甲醛超临界水降解主反应通道如图1所示.

表1 400 ℃时各基元反应速率常数 s -1
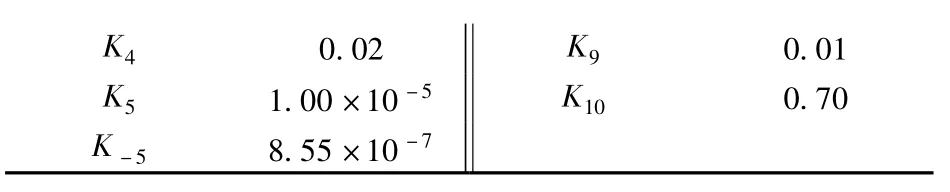
K4 0.02 K9 0.01 K5 1.00 ×10 -5 K10 0.70 K -5 8.55 ×10 -7
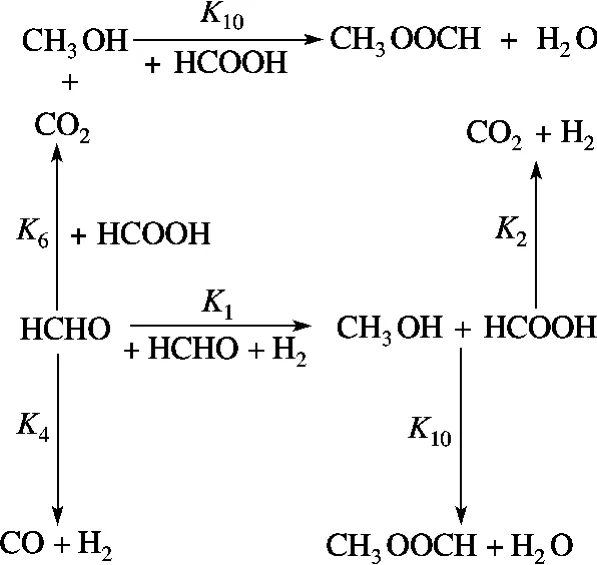
图1 甲醛超临界水降解过程主反应通道
2 结果与讨论
2.1 模拟结果与实验结果的对比
基于反应温度400 ℃、压力30 MPa、甲醛初始浓度0.56 mol/L 的实验数据[7],所建立的动力学模型预测结果如图2(a)所示,其中,y 为各组分气化产物产量.由图可见,该动力学模型较好地拟合了实验数据.为进一步验证该动力学模型预测的正确性,将不同甲醛初始浓度下(0.15,0.54,1.70 mol/L)该模型的预测结果与相关实验结果[6]进行比较.由图2(b)~(d)可见,该动力学模型预测结果与实验结果基本一致.此外短反应停留时间内甲醛以及其超临界水降解产物的产量变化显著,随着反应停留时间的延长降解产物的变化则较小,Watanabe 等[6]对该变化过程进行了较为详细的描述.然而与Watanabe 等[6]的研究不同,本文动力学模型还考虑了甲酸甲酯和甲缩醛组分的存在,由图2(b)~(d)可见,甲醛超临界水降解过程中生成了较为明显的甲酸甲酯及少量的甲缩醛.
由于Watanabe 等[6-7]采用间歇式高压反应釜进行实验研究,反应停留时间较长(3~28 min),因而本文采用连续式超临界水反应装置对短停留时间内模型预测的可靠性进行初步验证.受限于现有实验装置的反应停留时间范围,对400 ℃、25 MPa、[HCHO]0=0.1 mol/L、短停留时间(8,16 s)条件下甲醛超临界水降解进行实验.本文采用安捷伦6890 N气相色谱仪对气体产物进行分析,结果如图3所示.由图可见,短反应停留时间(<1 min)的模型预测与实验结果基本吻合.此外由图3可见,与停留时间3~28 min 不同,短停留时间下甲醛超临界水降解气体产物中CO 含量相对较高,而CO2含量较低.

图2 甲醛超临界水气化产物产量
2.2 各组分生成及消耗速率

图3 短停留时间的甲醛超临界水降解气体产物含量
基于本文动力学模型,在反应温度400 ℃、压力30 MPa、甲醛初始浓度0.56 mol/L 条件下,对甲醛超临界水气化转化各组分生成及消耗速率展开了进一步研究,结果如图4所示.其中,r 为各组分生成及消耗速率.由图4(a)可见,HCHO 直接分解、HCOOH 脱羧以及CH3OH 脱氢反应是甲醛超临界水降解过程中H2生成的主要路径,在该区域内随着停留时间的延长,通过HCHO 直接分解反应生成的H2迅速减少,由CH3OH 脱氢反应生成的H2逐渐增加,而HCOOH 脱羧反应生成的H2先显著增加后逐渐减少.总的来看,当停留时间在0~15 min 时,H2总生成速率很快;当停留时间大于15 min 时,H2总生成速率变得较为缓慢.此外由图还可见,通过水气变换反应生成的H2较少,这表明低温(400 ℃)、高压(30 MPa)下水气变换反应较难进行.由图4(b)可见,CO 主要通过HCHO 直接分解反应生成,其他反应路径生成的CO 则很少,同时随着停留时间的延长CO 总生成速率迅速降低.由图4(a)、(b)可知,甲醛超临界水降解过程中HCHO 直接分解反应路径与还原性气体产物的生成密切相关.由图4(c)可见,负氢离子转移以及HCOOH 脱羧反应是CO2生成的主要路径,水气变换反应生成的CO2则很少,因而通过控制负氢离子转移反应路径的进行是提高气体产物中还原性气体含量的有效途径.同时由图可见,随着停留时间的延长CO2总生成速率先迅速增加而后快速降低.当停留时间较长(>15 min)时,CO2不再生成,其产量保持基本稳定.由图4(d)可见,Cannizzaro 以及负氢离子转移反应是HCHO 消耗的主要路径,HCHO 直接分解以及醇醛缩合反应消耗的HCHO 较少.此外当反应时间在0~10 min 内HCHO 迅速被消耗,当反应时间为10 min时HCHO 浓度已经很低.由图4(e)可见,Cannizzaro 和负氢离子转移反应分别是HCOOH 生成和消耗的主要路径,且随着停留时间的延长Cannizzaro 反应生成的HCOOH 快速减少,而负氢离子转移反应消耗的HCOOH 先迅速增加而后逐渐减少.通过脱羧和酯化反应消耗了少量的HCOOH,而HCOOH 脱羰和合成反应消耗、生成的HCOOH 则很少.由图4(f)可见,通过Cannizzaro以及负氢离子转移反应生成了较多的CH3OH.随着停留时间的延长,Cannizzaro 反应生成的CH3OH 迅速减少而负氢离子转移反应生成的CH3OH 先迅速增加而后快速减少,而酯化反应消耗了少量CH3OH.此外通过醇醛缩合以及CH3OH 脱氢反应消耗的CH3OH 则相对很少.由图4(g)可见,通过CH3OH 脱氢以及酯化反应生成了较为明显的CH3OOCH,随着停留时间的延长酯化反应生成的CH3OOCH 先迅速增加而后快速减少,而CH3OH 脱氢反应生成的CH3OOCH先明显增加而后稳定增加.由图4(h)可见,相比其他组分,CH2(OCH3)2含量较低,而CH2(OCH3)2是通过醇醛缩合反应生成的,随着停留时间的延长CH2(OCH3)2先迅速增加而后逐渐减少.

图4 甲醛超临界水降解产物生成及消耗速率
2.3 化学平衡时的气体产物
目前研究生物质超临界水气化转化技术的主要目的是制取H2,CO 和CH4等可燃气体,因此提高气体产物中上述气体的含量及气体发热量具有重要意义.首先对生物质超临界水气化转化过程中的重要小分子中间产物甲醛进行研究,并基于本文动力学模型预测达到降解化学平衡状态时气体产物组成及发热量情况,如图5所示.由图5可见,在400 ℃、30 MPa 和较低甲醛初始浓度(<2 mol/L)时,随着初始浓度的增加气体产物中H2,CO2含量逐渐升高,CO 含量明显降低;甲醛初始浓度较高(>2 mol/L)时,气体产物组分含量变化较小.此外由化学平衡状态计算可知,随着甲醛初始浓度的增加,每摩尔甲醛生成的气体总量逐渐减少.当[HCHO]0<2 mol/L 时,随着甲醛初始浓度的增加,CO 和H2的总体积分数明显降低,从而可知其总摩尔数明显降低,且CO 和H2的摩尔发热量基本相当,使得每摩尔甲醛生成的气体产物高位发热量迅速减少;当[HCHO]0>2 mol/L 时,该发热量则缓慢减少.

图5 甲醛降解平衡状态气体产物含量及其发热量
3 结论
1)本文在已有研究基础上进一步揭示HCHO超临界水降解转化机理,增加了CH3OOCH 和CH2(OCH3)2生成的转化路径,建立了更为详细的HCHO 超临界水降解动力学模型.结果表明,该动力学模型较好地预测了相关实验数据,并适用于短反应停留时间(<1 min)转化过程,说明本模型较好地反映了降解过程的真实机理.
2)H2主要通过HCHO 直接分解、HCOOH 脱羧以及CH3OH 脱氢反应生成;CO 主要通过HCHO 直接分解反应生成;CO2主要通过负氢离子转移及HCOOH 脱羧反应生成;Cannizzaro 及负氢离子转移反应是HCHO,HCOOH 和CH3OH 生成或消耗的主要路径;通过CH3OH 脱氢以及酯化反应生成了较为明显的CH3OOCH;CH2(OCH3)2通过醇醛缩合反应生成且含量较低.
3)在达到化学平衡条件下,当[HCHO]0<2 mol/L 时,随着初始浓度的增加,H2和CO2含量逐渐升高,CO 含量和气体产物高位发热量明显降低;当[HCHO]0>2 mol/L 时,随着初始浓度的增加,气体含量及发热量变化很小.
References)
[1]张国妮,张军,徐益谦.超临界水中甲醛气化的实验研究[J].西安交通大学学报,2008,42(3):372-376.
Zhang Guoni,Zhang Jun,Xu Yiqian.Experimental research on formaldehyde gasification in supercritical water[J].Journal of Xi′an Jiaotong University,2008,42(3):372-376.(in Chinese)
[2]Demirbas A.Hydrogen production from biomass via supercritical water gasification[J].Energy Sources Part A:Recovery Utilization and Environmental Effects,2010,32(14):1342-1354.
[3]Resende F L P,Neff M E,Savage P E.Noncatalytic gasification of cellulose in supercritical water[J].Energy &Fuels,2007,21(6):3637-3643.
[4]Kruse A,Bernolie P,Dahmen N,et al.Hydrothermal gasification of biomass:consecutive reactions to longliving intermediates[J].Energy & Environmental Science,2010,3(1):136-143.
[5]Aida T M,Shiraishi N,Kubo M,et al.Reaction kinetics of D-xylose in sub-and supercritical water[J].Journal of Supercritical Fluids,2010,55(1):208-216.
[6]Watanabe M,Osada M,Inomata H,et al.Acidity and basicity of metal oxide catalysts for formaldehyde reaction in supercritical water at 673 K[J].Applied Catalysis A:General,2003,245(2):333-341.
[7]Osada M,Watanabe M,Sue K,et al.Water density dependence of formaldehyde reaction in supercritical water[J].Journal of Supercritical Fluids,2004,28(2):219-224.
[8]Ohno K,Maeda K.Global reaction route mapping on potential energy surfaces of formaldehyde,formic acid,and their metal-substituted analogues[J].The Journal of Physical Chemistry A,2006,110(28):8933-8941.
[9]张永春,张军,赵亮,等.超临界水中甲酸降解过程实验研究[J].燃料化学学报,2010,38(4):403-408.
Zhang Yongchun,Zhang Jun,Zhao Liang,et al.Decomposition of formic acid in supercritical water[J].Journal of Fuel Chemistry and Technology,2010,38(4):403-408.(in Chinese)
[10]Resende F L P.Supercritical water gasification of biomass[D].Michigan,USA:University of Michigan,2009:117-153.
[11]王毅.水煤浆加压气化合成氨装置CO 变换反应设计[J].煤化工,2010(6):28-31.
Wang Yi.On CO shift reaction and design for typical coal water slurry pressurized gasification[J].Coal Chemical Industry,2010(6):28-31.(in Chinese)
[12]Bühler W,Dinjus E,Ederer H J,et al.Ionic reactions and pyrolysis of glycerol as competing reaction pathways in near-and supercritical water[J].Journal of Supercritical Fluids,2002,22(1):37-53.

