紫露草花色形成的机理分析
李慧波,刘雅莉,岳 娟,娄 倩
(1.西北农林科技大学林学院,陕西 杨凌 712100; 2.西北农林科技大学园艺学院,陕西 杨凌 712100)
蓝紫色花具有较高的科研、观赏和文化价值[1-2],目前关于蓝紫色花着色的机理主要有以下3种:第1,液泡pH值理论,该理论认为花色变化依赖于pH值,花青素在强酸条件下显红色,中性或碱性条件下趋于蓝紫色[3];第2,金属螯合理论,认为某些金属离子会与花青素结合形成高度着色且稳定的络合物,可以使一些花色趋于蓝紫色[4];第3,分子结合理论,认为一些植物的色素分子之间彼此相互结合或堆叠,自身合成超分子色素,最终发展成蓝紫色[5]。此外,蓝紫色花的形成还受到花瓣表皮细胞形状[6]、色素空间分布及花发育阶段等多种因素的影响[7]。
紫露草(Tradescantiaalbiflora)是单子叶植物鸭跖草科(Commelinaceae)多年生草本植物,因其具有较纯正的蓝紫色花,且花期长、着花繁密,常被用作地被植物。本研究以具有蓝紫色花的紫露草为对象,通过综合分析花瓣表皮细胞形状、色素分布、金属元素种类含量及花色素成分,对紫露草花色形成的主要影响因素进行分析,以期为蓝紫色花花色形成机理的研究及花色育种提供理论依据。
1 材料与方法
1.1试验材料
1.1.1植物材料 紫露草新鲜花瓣于2012年5月上旬09:00采自陕西杨凌西北农林科技大学南校区。选取生长环境相同、长势一致且花蕾数多的植株,采集盛花期的花瓣,一部分迅速带回实验室进行测色、花瓣解剖学分析、原生质体提取及金属元素分析的样品制备;另一部分于-80 ℃冰箱中保存,用于花青素苷、黄酮醇苷的提取分析。
1.1.2仪器设备 花瓣颜色采用英国皇家园艺学会比色卡RHSCC(Royal Horticultural Society Colour Chart)和色差仪CR-400(Konica Minolta Investment Ltd.,China)完成测定;花瓣解剖结构分析使用显微镜Eclipse 50i(Nikon,Japan)进行观察;用于花瓣表皮细胞形状扫描电镜观察的样品采用EMITECH K850 CO2临界点干燥仪干燥,JEOLLFC-1600 Auto Fine Coater离子溅射仪镀金,JOEL扫描电子显微镜照相仪拍照;金属元素分析通过CEM Mars 微波消解仪(CEM,USA),820-MS电感耦合等离子体质谱仪(Varian,USA)确定;用于花色素测定的花瓣样品使用北京四环LGJ-10D冷冻机干燥,花色素成分分析采用日立L-2000系列高效液相色谱-二极管阵列检测器联用(HPLC-DAD,HITACHI公司)完成;微量元素标准品(Mg,Al,Ca,Fe,Zn,Cu,Mn,Cd)购自国家有色金属及电子材料分析测试中心。
1.2试验方法
1.2.1紫露草花瓣颜色的测定 RHSCC比色。花朵采集后迅速带回实验室,选取新鲜花瓣,在室内散射光条件下(避免日光直射)将花瓣中间部分与英国皇家园艺学会比色卡(RHSCC)进行对比。
色差仪测色。选取紫露草5个不同的单株,每株选择1个花瓣,将花瓣的中间部分对准色差仪的集光孔进行测量,计算其平均值。
1.2.2紫露草花瓣解剖结构和细胞特性的观察 紫露草花瓣横切面的观察。选取盛花期的紫露草新鲜花瓣,用刀片在花瓣中部切取长约10 mm,宽0.5~1.0 mm的片段,用镊子置于载玻片上,再用刀片纵切2~3次,得到较薄的横切面,置于显微镜下观察。
紫露草花瓣表皮细胞的观察。选取盛花期的紫露草新鲜花瓣,用刀片切取花瓣表皮约0.5 mm片段,置于显微镜下观察。
紫露草花瓣表皮细胞形状扫描电镜的观察。采用CO2临界干燥法制备扫描电镜样品。花瓣采集后先后通过2.5%戊二醛缓冲液浸泡2 h、0.1 mol·L-1磷酸缓冲液漂洗3次(15 min·次-1)、乙醇梯度脱水(30%-50%-70%-80%-90%-100%)15 min·次-1、乙酸异戊酯置换15 min·次-1,最后用EMITECH K850 CO2临界点干燥仪干燥,JEOLLFC-1600 Auto Fine Coater离子溅射仪镀金,JOEL扫描电子显微镜照相仪观察花瓣表皮细胞形状。
紫露草花瓣原生质体的制备。选取盛花期新鲜花瓣1 g横向切割成宽为2~3 mm的条带,置于10 mL酶解液(0.2 g纤维素酶,0.02 g离析酶,0.6 mol·L-1甘露醇,20 mmol·L-1MES-Tris,pH值5.8)中。放入真空旋转干燥仪中抽真空10 min,23 ℃黑暗条件下静止1~2 h进行酶解。酶解后取出,轻轻摇晃数下,加入适量洗液,轻摇,过0.1 mm筛,4 ℃ 882 r·min-1离心2 min,用宽口枪头吸出上清,可见原生质体沉淀于底部,轻轻摇晃使原生质体悬浮。
1.2.3紫露草花瓣中金属元素含量的测定 样品预处理。收集盛花期的紫露草新鲜花瓣(20 g)置于培养皿中,用双蒸水反复冲洗干净。冲洗后的花瓣置于烘箱中105 ℃杀青30 min后,80 ℃干燥至质量恒定。
金属元素分析。干燥后的样品在研钵中研细成粉末状,准确称取0.600 g,加入5 mL浓硝酸及1 mL双氧水,通过CEM Mars 微波消解仪消解。微波消解程序:1 200 W,120 ℃保持5 min;1 200 W,160 ℃保持10 min;1 200 W,180 ℃保持20 min。消解后的样品通过Varian 820-MS 电感耦合等离子体质谱仪,进行金属元素Mg、Al、Ca、Fe、Zn、Cu、Mn和Cd含量测定。功率1 400 W,等离子气流量18 L·min-1,载气流量1.80 L·min-1,采样深度7.5 mm,信号采集模式为跳峰。
1.2.4紫露草花瓣中花青素苷和黄酮醇苷种类及含量的测定 提取方法:于-80 ℃ 6 236 r·min-1冰箱中保存的紫露草花瓣通过LGJ-10D冷冻干燥机冷冻干燥36 h后研磨充分,称取0.05 g粉末2份,分别加入2 mL 3% HCL的甲醇和2 mL 100%甲醇中,置于4 ℃冰箱中避光浸提24 h,4 ℃ 5 000×g离心5 min,分离上清液,供花青素苷和黄酮醇苷定量分析。利用日立L-2000系列高效液相色谱-二极管阵列检测器联用(HPLC-DAD,HITACHI公司)进行花青素苷和黄酮醇苷的定量分析。分析条件:柱温40 ℃,流速0.5 mL·min-1,进样体积10 μL,花青素苷和黄酮醇苷的检测波长分别为530和360 nm。流动相A液为甲醇;B液为甲酸∶水(10∶90,体积比);C液为乙腈。线性梯度洗脱,0~40 min,B 95%~60%,C 5%~40%;45~60 min,C 100%。定量方法:分别在最大吸收波长530和360 nm同时检测花青素苷和黄酮醇苷含量。采用标准品外标法作标准曲线定量。标准品为飞燕草素、矢车菊素、矮牵牛素、天竺葵素、锦葵素、二氢杨梅素、二氢槲皮素、杨梅素、槲皮素及山奈酚。
2 结果
2.1RHSCC比对与CIELAB颜色坐标对紫露草花色的评价 紫露草花瓣颜色为蓝紫色系(Violet group N88B)(表1)。采用国际照明委员会表色系统(CIELAB)对花瓣的三刺激值(亮度L*值,红度a*值,黄度b*)进行测定,结果显示,紫露草花瓣花色亮度L*值为33.33,位于CIELAB色空间[8]L轴的上半轴;红度a*值为21.12;黄度b*值为-21.39,说明紫露草花瓣的蓝度较高。根据公式C*=(a*2+b*2)1/2及h=arctan(b*/a*)计算彩度C*为30.06,色相角h是314.63,在CIELAB色空间中属于蓝色向红色过渡的区域(表1)。
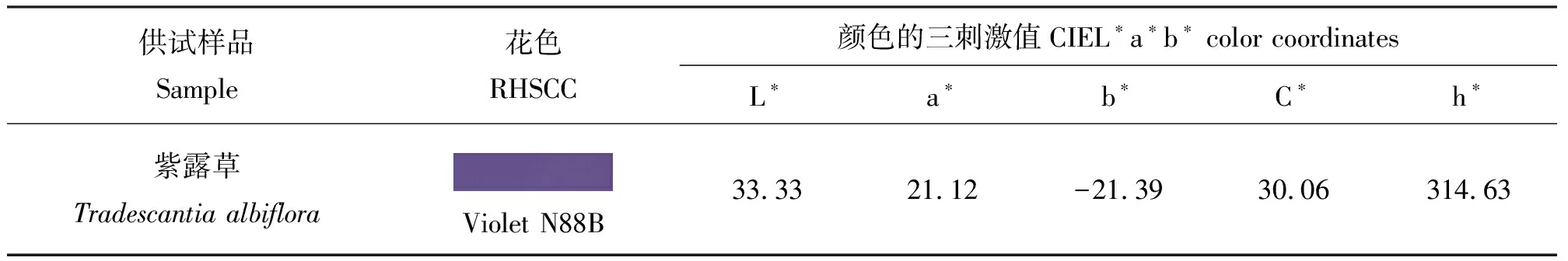
表1 紫露草的花色和色值实验结果Table 1 The colors and color parameters of Tradescantia albiflora’s petals
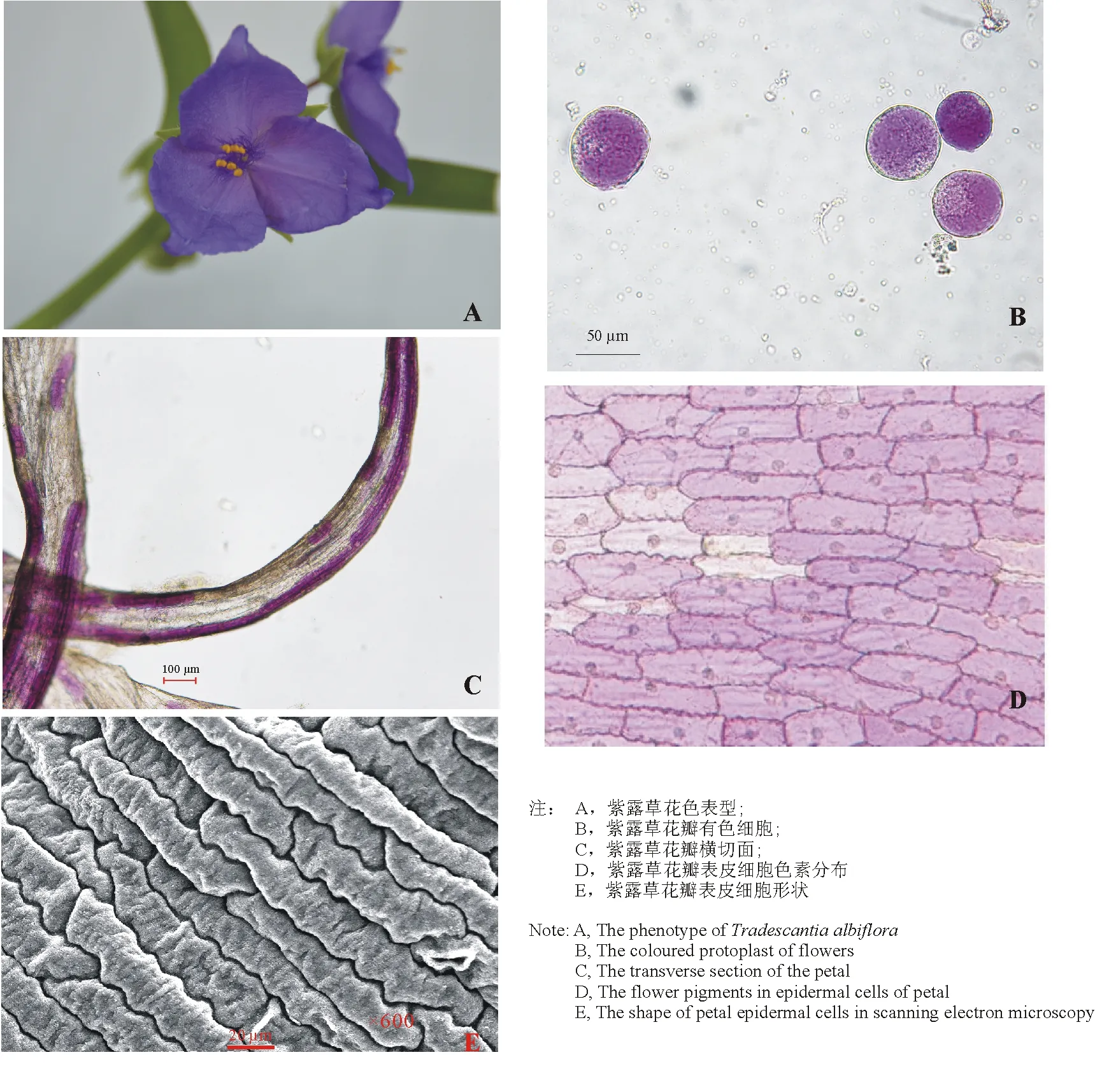
图1 紫露草花瓣解剖学和细胞特性Fig.1 Morphological and cell characteristics of petals of Tradescantia albiflora
2.2色素分布和表皮细胞形状对紫露草花色形成的影响分析 通过对紫露草花瓣横切面及表皮细胞解剖结构(图1)的观察,发现紫露草花瓣有明显的色素积累。色素物质主要集中于近轴面和远轴面的表皮层,深度20~30 μm。
花瓣表皮细胞的形状会对花色形成产生重要影响,一般认为花瓣上下表皮细胞形状不同会产生不同的色感,尤其是亮度(L*)差异较大。从紫露草花瓣表皮细胞扫描电镜(图1)可以看出,紫露草花瓣上下表皮细胞呈略扁平的长方形,这可能是造成紫露草花瓣正反面颜色相似的主要原因。
2.3金属元素对紫露草花色形成的影响分析 通过ICP-MS方法对紫露草花瓣中的金属元素Mg、Al、Ca、Mn、Fe、Cu、Zn和Cd同时进行分析。经测定(表2),发现紫露草花瓣中Ca元素含量极其丰富,为5 120.89 μg·g-1,是所测元素中含量第2高的Mg元素(2 360.71 μg·g-1)的2倍以上。其次为Al、Fe、Zn、Cu、Mn和Cd。

表2 紫露草花瓣中8种金属元素的测定结果Table 2 Contents of eight metal elements in Tradescantia albiflora’s petals μg·g-1
2.4紫露草花瓣中花青素苷和黄酮醇苷的定量分析 从紫露草花瓣中共检测出两种花青素苷和4种黄酮醇苷。其中,在530 nm下检测到两种花青素苷色谱峰,出峰保留时间分别为21.20和23.77 min,这与标样飞燕草素、矢车菊素保留时间基本一致;在360 nm下检测到4种黄酮醇苷色谱峰,出峰保留时间分别为28.60、44.13、47.65和49.09 min,与标样二氢杨梅素、槲皮素、杨梅素及山奈酚的保留时间一致。通过标准品外标法作标准曲线定量分析得到:矢车菊素6.671 1 mg·g-1,飞燕草素0.674 4 mg·g-1,二氢杨梅素0.167 7 mg·g-1,槲皮素0.101 8 mg·g-1,杨梅素0.207 4 mg·g-1,山奈酚0.327 2 mg·g-1。计算结果表明,紫露草花瓣主要成色色素为矢车菊素和飞燕草素,含有的主要黄酮醇类物质是山奈酚。
3 讨论
3.1RHSCC比色、“CIELAB”系统与花色测量 花色是观赏植物最重要的性状之一,也是观赏植物品种分类的重要依据。目前,常用的测色方法有目测、比色卡比色和色差仪测色。由于人们的视觉存在差异且对颜色的分类标准不同,通过目测的方法很难对花色尤其是交叉色系进行准确判定。比色卡自从1776年应用于园艺植物颜色的测定[9],由于其使用方便、购置费用低和移动性强等优点,被广泛使用,但是比色卡比色对试验者及测色环境的要求非常严格。目前,颜色数量化已经成为花色深入研究的前提,因此,具有测色精度高、环境因素影响小和颜色数量化等优点的色差仪在观赏植物界花色测定方面应用广泛。从本研究可以看出,在目测的基础上使用RHSCC比色卡比色可以较快速简便地对紫露草花色进行评价。但是,通过色差仪可以更为准确地对花瓣颜色进行定量分析,将紫露草花瓣的色值定位于“CIELAB”色空间[8]的数字化坐标。
3.2花瓣表皮细胞形状对花色的影响 许多植物花瓣中的色素都是定位于表皮细胞。Quintana等[10]指出,上下表皮细胞色素可能存在明显差异。表皮细胞的形状不同,有圆锥形、扁平或尖形。表皮细胞的形状可以明显影响花色,大多数花瓣下表皮通常是扁平状,这种结构可以更多地反射入射光而使花色变浅。上表皮细胞常呈圆锥状,它们可以增加进入表皮细胞入射光的比例,提高色素对光的吸收从而增加颜色的强度。此外,锥形细胞还可以增强色彩的饱和度。Martin等[11]认为,锥形细胞的出现与否与花蜜和/或花粉的聚集有关,同时,它们可能也会为传粉昆虫提供触觉线索,影响花瓣的光线反射,提高花瓣的温度,影响气体的排放等。在本研究中,通过扫描电镜观察表皮细胞形状,结果显示,紫露草花瓣表皮细胞呈略扁平长方形而非圆锥形或尖形,说明花瓣表皮细胞形状并不是紫露草蓝紫色花花色形成的主要影响因素。
3.3金属离子对花青素呈色的影响 花最终表现出来的颜色是由特定色素的合成、所有色素的浓度及许多其它物理、化学及细胞方面的因素共同决定。花青素是天然产物中不稳定的化合物之一,容易受到pH值和金属离子等理化因素的影响。金属元素影响色素结构进而影响花色。法国万寿菊(Tagetespatula)自然花色是浅黄色,通过明矾处理会变成金黄色,铬处理后会变成深橙色,而铜会使其变成褐色。这是由于类黄酮与槲皮素之间的转变[12]。最近,Shoji等[13]对郁金香(Tulipagesnerianacv.Murasakizuisho)花被片底部蓝色的产生和发展进行了研究,整个郁金香是紫色但底部是蓝色。分别收集了花的蓝色和紫色不同区域的原生质体,然后测定它们的类黄酮组成、液泡pH值和金属元素的含量。结果发现,不同类型的原生质体的花青素和类黄酮组成相同,pH值存在微小差别,可是蓝色原生质体Fe3+含量是紫色的25倍。如果将Fe3+添加到紫色花色素溶液中则可以转变为蓝色。前人的研究表明,一些二价金属离子螯合飞燕草色素可以产生蓝紫色花[14-16],且花色苷、类黄酮和金属离子按一定的化学计量比螯合的超分子金属复合物被称为金属花色苷,可以显著影响蓝紫色花的着色[17]。喜马拉雅的罂粟(Meconopsisgrandis)都是蓝色的,这是由于红色花青素通常和Mg复合存在,然后转变成蓝色[18]。Nissan-Levi等[19]研究了Mg元素在加强几种观赏植物花色方面的作用,结果发现,即使在高温环境下,增加Mg元素也可以使花青素含量增加,袋鼠花(Anigozanthosflavidus)出现红色的花,补血草(Limoniumsinuatum)长出蓝色苞片,丝石竹(Gypsophilaelegans)出现粉色花,而乌头(Aconitumcarmichaeli)长出蓝色花。因此,含有不同花青素的不同植物可以通过增加Mg元素增加花色(15%~70%)。目前,关于金属元素复合花色苷使花色趋于蓝化已经有了大量的报道,其中主要集中于金属元素Mg、Al、Fe,而有关Ca元素的相关报道较少。在本研究中,测得紫露草花瓣中Ca元素含量极其丰富,这可能为蓝紫色花花色形成机理的研究提供重要的理论依据。
[1] Kumi Y,Mihoko M,Tadao K.Blue flower color development by anthocyanins:From chemical structure to cell physiology[J].Natural Product Reports,2009,26:857-964.
[2] Yoshikazu T,Filippa B.Flower colour and cytochromes P450[J].Philosophical Transactions of the Royal Society Biological Sciences,2013,368:1-14.
[3] Yoshida K,Kondo T,Okazaki Y,etal.Cause of blue petal colour[J].Nature,1995,373:291.
[4] Shibata K,Shibata Y,Kashiwagi I.Studies on anthocyanins:Color variation in anthocyanins[J].Journal of the American Chemical Society,1919,41:208-220.
[5] 白新祥.菊花花色形成的表型分析[D].北京:北京林业大学,2007.
[6] Di Stilio V S,Martin C,Schulfer A F,etal.An ortholog of MIXTA-like 2 controls epidermal cell shape in flowers ofThalictrum[J].New Phytologist,2009,183(3):718-728.
[7] Miller R,Owens S J,Rørslett B.Plants and colour:Flowers and pollination[J].Optics & Laser Technology,2011,43:282-294.
[8] Voss D H.Relating colorimeter measurement of plant color to the Royal Horticultural Society Colour Chart[J].Hortscience,1992,27:1256-1260.
[9] Tueher A O,Maciarello M J,Tueker S S.A survey of color charts for biological description[J].International Association for Plant Taxonomy,1991,40:201-214.
[10] Quintana A,Albrechtova J,Griesbach R J,etal.Anatomical and biochemical studies of anthocyanidins in flowers ofAnagallismonelliL.(Primulaceae) hybrids[J].Scientia Horticulturae,2007,112:413-421.
[11] Martin C,Lara-Palermo S,Nichols J,etal.Evolution of flower development:From phenotypes to genes[A].In:Chou C H.Abstract for Botany & Plant Biology 2007 Joint Congress[C].Chicago:California State University Press,2007:229-239.
[12] Cannon J,Cannon M.Dye Plants and Dyeing[M].London:The Herbert Press,1994.
[13] Shoji K,Miki N,Nakajima N,etal.Perianth bottom-specific blue color development in tulip cv.Murasakizuisho requires ferric ions[J].Plant & Cell Physiology,2007,48:243-251.
[14] Goto T,Kondo T.Structure and molecular stacking of anthocyanins-flower color variation[J].Angewandte Chemical International Edition,1991,30:17-33.
[15] Takeda K,Hayashi K.Reconstruction of commelinin from its components,awobanin,flavocommelin and magnesium[J].Proceedings of the Japan Academy,1977,53:1-5.
[16] Kondo T,Yoshida K,Nakagawa A,etal.Structural basis of blue-colour development in flower petals fromCommelinacommunis[J].Nature,1992,358:515-518.
[17] 杨少勇,安银玲,樊国盛,等.蓝色花植物花色素的着色机理[J].北京林业大学学报,2003,25(5):68-76.
[18] Kumi S,Kitahara D I,etal.Ferric ions involved in the flower color development of the himalayan blue poppyMeconopsisgrandis[J].Phytochemistry,2006,7:992-998.
[19] Nissan-Levi A,Ovadia R,Foreer I,etal.Increased anthocyanin accumulation in ornamental plants due to magnesium treatment[J].Journal of Horticultural Science and Biotechnology,2007.82:481-487.

