固定化酶化学发光法测定食品中的淀粉含量
舒友琴 徐 军
(河南牧业经济学院质量检测与管理系,郑州 450011)
食品中淀粉测定的国标方法为酶水解法和酸水解法[1]。酶水解法即在淀粉酶的作用下,使淀粉水解为麦芽糖和低分子糊精,再进一步酸水解,使淀粉全部转化为葡萄糖,然后按测定还原糖的方法测定生成的葡萄糖,再折算成淀粉的含量。方法繁琐费时,而且淀粉酶不能重复使用,造成酶试剂的浪费。
酶固定化技术是20世纪60年代发展起来的一项新技术,可提高酶的催化效率、降低使用成本,呈现贮存稳定性高、分离回收容易、可多次重复使用等一系列优点[2-3]。固定化酶所使用的载体有高分子载体、无机载体、复合载体以及新型载体等[4-7]。分子筛作为酶的新型载体材料,已广泛应用于各种酶的固定化[8-9]。MCM-41介孔分子筛是一种孔径介于2.0~50 nm之间的分子筛,由于其具有规整的介孔孔道、独特的液晶自组织合成机理、组分的多样可变性及极高的比表面积,以及良好的热稳定性,故在固定化酶方面有着特有的优势,但目前的研究多集中于固定化条件及固定化酶的性能研究[10-11],而鲜见用于分析测定的报道。
本研究以MCM-41介孔分子筛作为载体固定了α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶,制备了固定化的酶柱,并结合流动注射化学发光体系,建立了快速测定食品中淀粉含量的新方法,并对8种不同的样品进行了测定,结果令人满意。
1 材料与方法
1.1 材料与试剂
供试样品:市售,包括2个含脂肪较多的样品即火腿肠和饼干;5个含脂肪较少的样品即馒头、鸡蛋挂面、小麦粉、玉米面和豆浆;1个淀粉类样品即凉皮。
α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶(生物试剂):北京奥博星生物技术有限责任公司;可溶性淀粉标准品(分析纯):北京红星化工厂;鲁米诺(Luminol,3-氨基邻苯二甲酰肼,又名发光氨)(分析纯)、十六烷基三甲基溴化铵(CTAB)(分析纯):北京化学试剂厂;正硅酸乙酯(TEOS)(分析纯):天津市科密欧化学试剂开发中心;K3[Fe(CN)6]及其他有关试剂均为分析纯。
1.2 主要仪器设备
IFIS-C型智能流动注射进样器、GD-1型微光测量仪:西安瑞科电子设备有限公司;R-60型Rikadenki记录仪:日本株式会社东海理化电机制作所;HJ-5数显恒温多功能搅拌器:金坛市荣华仪器制造有限公司;HZS-H型水浴振荡器:哈尔滨市东明医疗仪器厂;DZF-6051真空恒温干燥箱:深圳市鼎鑫宜实验设备有限公司;TU-1810紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.3 酶柱反应及发光测定原理
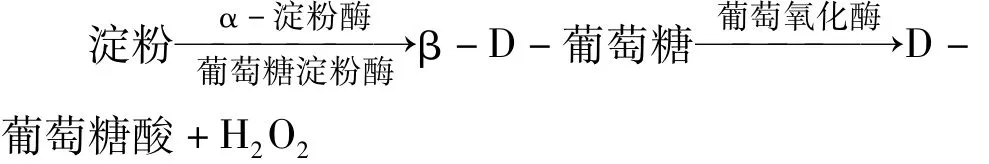
反应生成的 H2O2与 Luminol在 K3[Fe(CN)6]的催化下产生化学发光,发光强度与生成的H2O2的量成正比,即与样液中淀粉的含量成正比,从而求出样品中的淀粉含量。发光分析的流路系统如图1所示。

图1 流动注射化学发光分析流路图
1.4 固定化酶柱的制备
1.4.1 MCM-41介孔分子筛的制备
MCM-41的合成参照刘雷等[12]和张波等[13]的文献进行。取蒸馏水150 mL,依次加CTAB 4.4 g,NaOH 0.8 g,搅拌15 min后逐滴加入TEOS15.5 mL,继续搅拌2 h。110℃ 晶化24 h,冷却、过滤、洗涤。50℃干燥过夜后,于马弗炉中540℃灼烧6 h,所得粉末即为MCM-41介孔分子筛材料。
1.4.2 酶的固定化
称取α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶各0.20 g,分别溶于的100 mL pH 5.5的磷酸氢二钠-柠檬酸缓冲溶液中,充分搅拌后静置2 h以上,所得上清液即为各酶的酶液。
称取0.2 g MCM-41介孔分子筛载体3份,分别放入3只带塞的离心管中,各加入上述3种酶的酶液3.0 mL,置于转速150 r/min、20℃ 的恒温振荡器中10 h,离心分离,用缓冲溶液洗涤固体,再离心分离、洗涤,如此反复直至上清液中检测不到酶活为止。所得固体即为固定化酶,室温真空干燥后,于4℃下冰箱保存。
1.4.3 酶柱的制备
取一定量的α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶的固定化酶固体,分别压碎混匀后,依次装入8 mm×120 mm的塑料管内(每种约占1/3),两端用玻璃棉封住。即制成固定化的酶柱,不用时保存于4℃的冰箱中。固定化时间、给酶量、溶液pH都会对酶的固定化率产生影响[14]。通过多次试验,本研究采用的固定化条件为固定化时间10 h、每种酶给酶量30 mg/g、溶液pH 5.5。试验测得3种酶的固定化率分别为66%、68%和72%。
1.5 固定化酶的活性
固定化后的α-淀粉酶和葡萄糖淀粉酶的活性采用消色法测定[15],葡萄糖氧化酶的活性采用4-氨基安替吡啉、苯酚和辣根过氧化物酶(HRP)体系测定[16]。
本试验的α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶的酶活单位分别指在40℃、pH 6条件下,每小时水解1 g淀粉所需的固定化酶量、每小时水解可溶性淀粉产生1 mg葡萄糖所需的固定化酶量和每分钟产生1μmol葡萄糖酸和H2O2所需的固定化酶量。
淀粉的固定化酶化学发光法测定的基础是3种酶的催化反应,温度、酸度对酶的催化活性均有影响,多次测定的结果表明,在50~60℃、pH 4.5~5.5的条件下,体系有最大的发光强度。
1.6 样品的预处理
1.6.1 含脂肪较多的样品
称取试样1~5 g(视样品含淀粉量而定,通过调节称样量和定容体积,把样液浓度调节在10~150 mg/L的线性测定范围内),置于铺有滤纸的漏斗内,先用50 mL乙醚分5次洗涤以除去脂肪,再用100 mL85%乙醇分5次洗涤以除去可溶性糖类。用50 mL水将残渣移至250 mL烧杯中。将烧杯置沸水浴中加热15 min,以使淀粉糊化溶解,冷却后移入1 000 mL容量瓶中,调节溶液的pH 5.0,定容。用快速滤纸过滤,得滤液备用。
1.6.2 含脂肪较少的样品
可省去除脂肪的操作,其余步骤同1.6.1。
1.6.3 淀粉类样品
称样后可直接糊化,其余步骤同1.6.1。
1.7 化学发光试验方法
按图1所示,将各流通管分别插入相应的试剂溶液中,打开蠕动泵,待信号稳定后,记录发光强度。以体系的发光强度和空白发光强度之差定量。本测定采用的 Luminol浓度为1×10-3mol/L,K3[Fe(CN)6]浓度为2.5×10-2mol/L,二者流速均为10 r/min。
2 结果和讨论
2.1 影响酶柱工作性能的因素
2.1.1 柱温的影响
在Luminol溶液的pH 9.0,淀粉溶液的pH 5.0、流速为2 r/min的条件下,按化学发光试验方法分别测定酶柱在 20、30、40、50、60、和 70℃时,由 100 mg/L淀粉标液所产生的发光强度,结果如图2。

图2 柱温对发光强度的影响
由图2可见,当酶柱温度保持在50~60℃时,体系有最大的发光强度。选用的酶柱使用温度为55℃。
2.1.2 淀粉溶液酸度的影响
在Luminol溶液的pH 9.0,淀粉溶液的流速为2 r/min,酶柱温度保持在55℃的条件下,按化学发光试验方法分别测定由100 mg/L淀粉标液在pH为4.0、4.5、5.0、5.5、6.0、6.5和 7.0时所产生的发光强度,结果如图3。
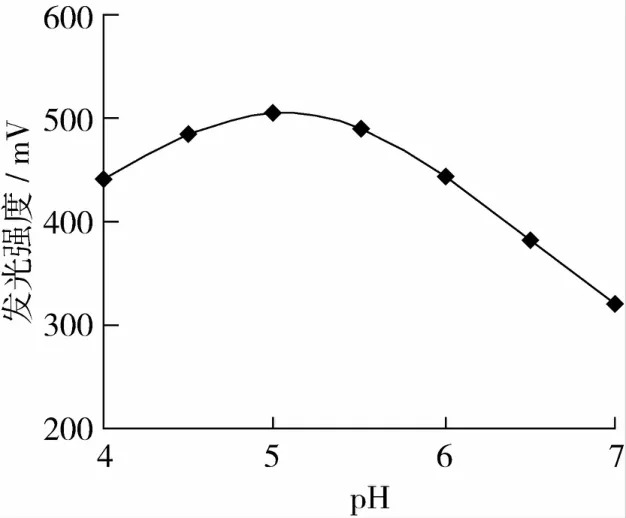
图3 pH对发光强度的影响
由图3可见,淀粉溶液的酸度在pH 4.5~5.5时,体系的发光强度最大。选用淀粉溶液的酸度为pH=5.0。所以,在处理样品和配制标液时,应调节淀粉溶液的酸度在pH=5.0。
2.1.3 淀粉溶液流速的影响
在流动注射化学发光测定中,由于淀粉溶液是在流经酶柱时被酶催化发生反应,流速的快慢会对淀粉的转化率产生一定的影响。在Luminol溶液的pH 9.0,淀粉溶液pH 5.0,酶柱温度保持在55℃的条件下,按化学发光试验方法分别测定由100 mg/L淀粉标液在流速 2、4、6、8、10 r/min时所产生的发光强度,结果如图4。

图4 流速对发光强度的影响
由图4可见,体系的发光强度随淀粉溶液流速的增大而降低。流速越低,体系的发光强度越大。而体系的发光强度越大,测定的灵敏度就越高。考虑到蠕动泵流速的均匀性及分析速度,选用淀粉溶液的流速为 2 r/min。
2.2 Luminol溶液酸度的选择
在淀粉溶液pH 5.0、流速为2 r/min,酶柱温度保持在55℃的条件下,按化学发光试验方法分别测定100 mg/L淀粉标液在 Luminol溶液 pH 8.0、9.0、10.0、11.0、12.0时体系的发光强度,如图 5所示。

图5 Luminol溶液pH对发光强度的影响
图5表明,在Luminol溶液的pH 9.0左右时,体系的发光强度最大。选定Luminol溶液的pH 9.0。
2.3 标准曲线、线性范围和检出限
在Luminol溶液 pH 9.0,淀粉溶液 pH 5.0、流速为2 r/min,酶柱温度保持在55℃的条件下,按化学发光试验方法分别测定由 1、10、30、60、100、150 mg/L淀粉标液所产生的发光强度,绘制标准曲线,如图6。可见,淀粉溶液在1~150 mg/L的浓度范围内,体系发光强度与浓度呈良好的线性关系,相关系数为0.999 8。对50 mg/L淀粉标液进行10次测定的RSD为2.1%,由对10 mg/L淀粉标液的测定结果,求得测定的检测限为0.3 mg/L(信噪比 S/N=3)。

图6 淀粉的标准工作曲线
2.4 加标回收率试验
取5种样品,经预处理后按最佳试验条件进行加标回收试验,结果见表1。
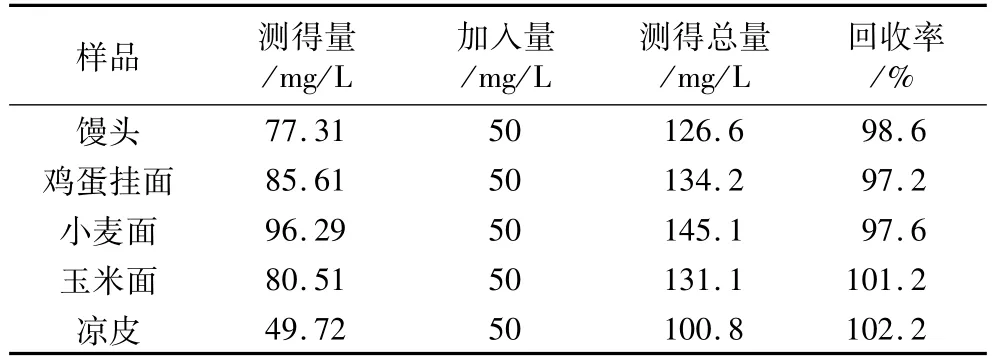
表1 加标回收率试验结果(n=5)
2.5 样品测定和对比试验
为了进一步了解方法的准确度,试验分别用本法和国标方法(酶水解法)对8个样品进行了对比测定,结果见表2。将测定结果用t检验法进行统计分析,t<t0.05.7,说明两方法的测定结果无显著性差异。

表2 样品测定和对比试验结果
2.6 酶柱的使用寿命
酶柱的使用寿命取决于酶从固定柱中流出的速度,因为这种流出将导致分析信号的减弱。本试验在室温条件下,考察了酶柱活性随时间的变化情况。结果显示,1个月内至少使用了300次的酶柱所产生的发光强度与新酶柱所产生的发光强度没有明显的减弱,40天内至少使用了350次的酶柱所产生的发光强度仍保持新酶柱所产生的发光强度的77%。说明在室温条件下,固定化酶柱有较好的使用稳定性。
3 结论
作为生物酶固定化载体,MCM-41介孔分子筛有独特优势。本试验利用MCM-41介孔分子筛将α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶固定化,制成复合酶柱,将此酶柱用于流动注射化学发光分析体系,可用于淀粉含量的快速测定。酶柱的最佳使用条件为:柱温55℃,淀粉溶液的pH 5.0、流速2 r/min。淀粉测定的线性范围为1~150 mg/L,相关系数0.999 8,检出限为0.3 mg/L,回收率为为97.2~102.2%,10次测定的RSD为2.1%。
方法具有多种优点:样品前处理简单,操作简便,节省酶试剂,准确度高,重现性好,测定速度快,单次测定能在1 min内完成。对8个样品的测定结果与国标方法的测定结果无显著性差异。为淀粉含量的测定提供了一种良好的新方法。
参考文献
[1]中华人民共和国卫生部.食品卫生检验方法 理化部分(一)[M].北京:中国标准出版社,2004
[2]袁中一.固定化酶[M].北京:化学工业出版社,1996
[3]曹玉华,杨慧萍,杨卫民,等.应用双固定化酶制备大豆肽的研究[J].中国粮油学报,2003,18(5):40-43
[4]陈霞,刘潇,赵光辉,等.智能型高分子载体的设计与制备及其固定化酶的研究进展.材料导报,2010,24(12):130-134
[5]张巍巍.生物碳纤维的酶固定化研究[D].北京:北京化工大学,2010
[6]Han Lei,Wang Wei.The prepration and catalytically active characterlzation 0f papain immobilized on magnetic comppsite micmspheres.Enzyme and Microbia1 Technology,2004,35(1):15-18
[7]周桓,张秋禹,金凤.新型固定化酶载体的合成及其功能.化工进展,2009,28(3):462-467
[8]Song X J,Wang J.Study on immobilization of acylase I on Y-type molecular sieve[J].Journal of Chemical Engineering of Chinese Universities,2004,18(5):617-620
[9]刘平,邢国文,李宣文,等.四种蛋白水解酶在不同分子筛上的吸附固定.物理化学学报,2010,26(4):1113-1118
[10]张君,吴秀文,马鸿文.不同孔径MCM-41介孔分子筛的合成及吸附性能研究[J].材料导报,2006,5(20):216-218
[11]赵炳超.介孔分子筛固定化酶的研究[D].北京:北京化工大学,2005
[12]刘雷,张高勇,董晋湘.模板剂对全硅 MCM-41介孔分子筛结构的影响 [J].物理化学学报,2004,20(1):65-69
[13]张波,慎炼,周春晖,等.全硅MCM-41中孔分子筛的合成[J].高校化学工程学报,2001,15(1):29-34
[14]王亮亮,刘雪松,宋伟明,等.α-淀粉酶在 MCM-41介孔分子筛上的固定化研究[J].日用化学工业,2012,42(3):196-200
[15]袁道强,黄建华.生物化学实验和技术[M].北京:中国轻工业出版社,2006
[16]熊振平,李载平,李致勋,等.酶工程[M].北京:化学工业出版社,1993.

