南极衣藻谷胱甘肽-S-转移酶基因的表达及其对大肠杆菌低温耐受性的增强作用
彭跃跃丁 燏,王金慧简纪常,鲁义善,刘 莹
(1. 广东海洋大学水产学院, 湛江 524025; 2. 广东省水产经济动物病原生物学及流行病学重点实验室, 湛江 524025; 3. 广东省教育厅水产经济动物病害控制重点实验室, 湛江 524025)
南极衣藻谷胱甘肽-S-转移酶基因的表达及其对大肠杆菌低温耐受性的增强作用
彭跃跃1,2丁 燏1,2,3王金慧1,2简纪常1,2,3鲁义善1,2,3刘 莹1,2
(1. 广东海洋大学水产学院, 湛江 524025; 2. 广东省水产经济动物病原生物学及流行病学重点实验室, 湛江 524025; 3. 广东省教育厅水产经济动物病害控制重点实验室, 湛江 524025)
谷胱甘肽-S-转移酶(Glutathione-S-transferase, GST, EC2.5.1.18)是生物体内一种重要的抗氧化酶, 为阐明GST在南极衣藻(Chlamydomonas sp. ICE-L)中的具体地位, 采用实时荧光定量PCR对不同温度下南极衣藻的GST基因的表达进行了分析; 并构建了原核表达载体pET28a(+)-GST, 转化至大肠杆菌BL21(DE3)中进行诱导表达, 通过平板培养法探讨了重组菌E. coli BL21(pET28a(+)-GST)对低温胁迫的耐受性。结果显示, GST在0℃时表达量最高, 最高可达对照组的两倍多; pET28a(+)-GST重组表达载体在E. coli BL21中实现了高效表达, 且主要以包涵体形式存在, 经HisTrap HP柱分离纯化获得高纯度的GST融合蛋白, 并通过SDS-PAGE及Western blot分析得以验证; 对低温胁迫实验发现南极衣藻GST蛋白的表达可以提高重组菌E. coli BL21对低温的耐受性, 说明GST基因对南极衣藻适应南极低温环境具有重要作用。
南极衣藻; 谷胱甘肽-S-转移酶; 表达; 低温
谷胱甘肽-S-转移酶(GST: EC2.5.1.18)是一种多功能酶, 广泛存在于各种动物、植物及微生物中, 分子量主要介于23—29 kD之间。根据其基因组织结构和序列的相似性, GSTs分为6类: phi、tau、lambda、theta和zeta及脱氢抗坏血酸还原酶(DHARs)[1], 前3类是植物所特有, 主要在植物的初级代谢和次级代谢、胁迫耐受和细胞信号转导中起作用[2], 其中在各种胁迫中主要通过清除因胁迫产生的过氧化物(过氧化氢、过氧酸盐)等物质起作用[3]。已有的研究表明, GST的过量表达可以增强芦苇(Phragmites australis)对Cd2+的耐受性, 并具有阻止细胞凋亡的作用[4]; 在拟南芥(Arabidopsis)中GST在多种胁迫(如伤害[5]、乙烯利[6]、生长素[7]、过氧化氢(H2O2)和水杨酸[8])应答中均起着重要的作用; 梨形环棱螺肝脏和鳃的GST酶活性受一定浓度Cu2+的诱导作用[9]。 GST对植物适应低温环境也有一定的作用, 橡胶树(Hevea brasiliensis)GST基因的表达明显受低温的调控[10]; 冷胁迫能够在转录和翻译水平上引起甘薯(Ipomoea batats. L)GST的响应, 协助保护组织免受伤害[11]; 生长于寒冷环境中野生马铃薯(Solanum commersonii)GST基因的表达量比低温敏感马铃薯高[12]; 云杉卷叶蛾(Choristoneura fumiferana)GST基因在转基因拟南芥中的表达可以增强拟南芥对低温的耐受性[13]; GST基因的过量表达可以促进转基因水稻在低温中的发芽和生长[14]。南极衣藻(Chlamydomonas sp. ICE-L)是生活在南极海冰表面、内部和底部一类微型单胞藻类, 严寒是南极环境一个最基本的特征。前期研究发现南极衣藻谷胱甘肽相关酶对其适应南极严寒环境具有一定的作用[15], 在蛋白水平上南极衣藻GST的活性与温度密切相关[16]。本研究旨在进一步从分子水平上分析南极衣藻GST基因表达与温度的关系, 同时构建了pET- 28a(+)-GST重组表达载体, 从原核水平上检测南极衣藻GST基因的表达能否提高宿主菌E. coli BL21对低温的耐受性, 为后续关于GST在抗低温及其他抗逆研究中的应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
RNA提取试剂TRIZOL®Reagent购自Invitrogen公司, dNTPs、ExTaq酶、rTaq酶及Reverse Transcriptase M-MLV(Rnase H-)均购自TaKaRa公司, TransStartTMGreen qPCR SuperMix购自北京全式金公司, 异丙基-β-D-硫代吡喃半乳糖苷(IPTG)购自上海生工生物技术有限公司, 鼠抗His·tag单抗、辣根过氧化物酶标记的山羊抗鼠IgG及DAB显色试剂盒均购自武汉博士德生物工程有限公司, NC膜购于PALL公司。
本实验对象南极衣藻(Chlamydomonas sp. ICE-L)由国家海洋局第一海洋研究所海洋生物活性物质重点实验室提供。E. coli BL21(DH5α)、pET-28a(+)质粒由广东海洋大水产学院广东省水产经济动物病原生物学及流行病学重点实验室保存。
1.2 GST在不同温度下的定量分析
采用Provasoli培养基培养南极衣藻, 温度为4—8℃, 光强为1300—1900 lx, 光照周期为12h∶12h, 不充气, 每天摇3—4次。将藻培养液分别置于0℃、8℃、14℃培养, 各温度组均设3个平行, 并在0、6、12、24、36、48、72h分别收集藻体。按TRIZOL®Reagent试剂的操作程序稍加改动提取总RNA, 经DNase I消化后用Reverse Transcriptase M-MLV (Rnase H−)和oligodT18按照M-MLV说明书合成cDNA一链。以β-action为内参[17], 进行荧光定量PCR扩增。取2 μL上述稀释20倍后的cDNA一链作为模板, 反应体系25 μL包括: 2×TransStart Green qPCR SuperMix 12.5 μL和10 mmol/L的上下引物各1 μL以及8.5 μL ddH2O, PCR反应程序为: 94℃预变性5min, 94℃ 20s, 58℃ 20s, 72℃ 20s,进行40个循环, 最后72℃延伸30s。应用iQTM5 Optical System Software, 采用2−ΔΔCt法进行目标基因的荧光定量分析, 应用SPSS 17.0软件对获得的实验数据进行统计学分析, **表示与同期对照组相比差异极显著(P<0.01), *表示与同期对照组相比差异显著(0.01< P<0.05)。
1.3 pE T-28a(+)-GST原核表达载体的构建、表达以及条件的优化
根据本实验室在GenBank所提交的南极衣藻GST基因序列(登录号: HQ444265)设计特异引物对其开放阅读框(ORF)进行扩增。F1: 5′-CGCGGATCC ATGCGAGCTGCTCTGCGT-3′(BamH I), R1: 5′-ACGC GTCGAC CTACGTAGCCCTTGATGCCA-3′(Sal I), 在上、下游引物分别引入BamH I和Sal I酶切位点。以cDNA一链为模板进行PCR(94℃ 5min, 94℃ 30s, 60℃ 30s, 72℃ 1min, 72℃ 5min)扩增, PCR产物和空质粒pET-28a(+)分别用BamH I、Sal I酶切, 并回收目的片段和线性化载体, T4DNA连接酶16℃连接过夜, 构建的表达载体pET-28a(+)-GST转化至BL21(DE3)中。阳性克隆经酶切鉴定后送上海生工测序验证。
将含有pET-28a(+)-GST的BL21接种于含50 μg/mL卡那霉素(Kan+)的LB培养液中, 37℃振荡培养过夜, 将此培养物按1∶50的体积比添加到LB(Kan+)中, 分别在18℃、28℃、37℃培养至A6000.4—0.6, 加入IPTG至终浓度为1 mmol/L, 诱导4h后, 取菌液10 mL, 10000 r/min离心1min, 加入500 μL 1×PBS(KH2PO40.2 g, Na2HPO4·12H2O 2.9 g, NaCl 8.0 g, KCl 0.2 g, pH 7.4)重悬沉淀后冰浴超声波破碎,离心收集上清和沉淀, 沉淀用1×PBS重悬浮, 分别吸取20 μL上清和重悬浮沉淀加入2×上样缓冲液,煮沸5min, 进行12% SDS-PAGE电泳分析。对IPTG浓度的优化, 37℃下培养重组菌至A6000.4—0.6时加入IPTG至终浓度分别为0、0.2、0.4、0.6、0.8、1.0、1.2 mmoL/L进行诱导4h; 对于时间的优化, 添加同浓度的IPTG诱导0、1、2、3、4、5、6h后分别取样分别进行12%SDS-PAGE电泳分析。
1.4 pE T-28a(+)-GST表达蛋白的纯化以及western blot鉴定
按最佳诱导条件大量诱导(100 mL)重组表达蛋白, 离心收集菌体, 1×PBS重悬菌体, 超声破碎, 工作时间8s, 间隔9s, 30min。离心收集沉淀, 分别用Washing buffer (Triton-100 0.5%, Tris-HCl 50 mmol/L pH 8.0, NaCl 300 mmol/L, EDTA 10 mmol/L, DTT 10 mmol/L)洗涤两次、Resuspension buffer (Tris-HCl 50 mmol/L pH 8.0, NaCl 100 mmol/L, EDTA 10 mmol/L, DTT 10mmol/L)洗涤一次, 离心收集沉淀用8 mol/L尿素过夜溶解沉淀。离心收集上清用HisTrap HP 1 mL进行纯化。纯化蛋白经SDS-PAGE电泳后, 然后进行蛋白质电转移, 将凝胶上的蛋白转印至硝酸纤维素膜上(转移条件100V, 150min), 转移完毕膜用5%脱脂奶粉Tris缓冲盐-吐温溶液(TTBS)室温封闭过夜; 次日用TTBS缓冲液洗涤3次后用鼠抗His·tag单抗37℃孵育1h; 再用TTBS洗膜3次, 再用辣根过氧化物酶标记山羊抗小鼠IgG37℃孵育1h;再用TTBS洗膜3次, 用DAB显色至目的条带清晰后立即以ddH2O终止反应。
1.5 重组菌BL21(pET-28a(+)-GST)的耐低温分析
将重组菌E. coli BL21(pET-28a(+)-GST)接种于LB(Kan+)液体培养基中培养, 当A600为0.4—0.6时,加入IPTG至终浓度为0.2 mmol/L, 150 r/min诱导培养6h。取上述培养物于无菌试管中, 稀释105后各取100 μL涂于LB(Kan+)平板。4℃分别处理0、1、2、3、4、5、6d后, 置于37℃继续培养过夜并统计菌落数, 同时以BL21 [pET-28a(+)]菌株作为对照。每个处理均设置3个重复, 结果用统计软件SPSS(17.0)进行分析, **表示与同期对照组相比差异极显著(P<0.01), *表示与同期对照组相比差异显著(0.01 2.1 南极衣藻GST的定量表达 实时荧光定量PCR结果显示, 在3个温度GST均有表达(图1), 且在对照温度8℃时各个取样时间GST的表达量相当; 0℃时, 第6h表达量低于初始水平, 第12h迅速恢复并继续上升, 在处理36h时表达量达到最大, 为正常水平的两倍多。其中在12h、24h时表达量显著高于对照(P<0.05), 36h时表达量极显著高于对照(P<0.01); 14℃时, GST的表达量均低于对照组, 且随着时间的推移有一个缓慢下降的趋势, 72h时的表达量约只有对照组的四分之一。 图1 南极衣藻GST在不同温度下的表达Fig. 1 The Real-time PCR analysis of the expression level of Chlamydomonas sp. ICE-L GST at different temperature 图2 重组表达载体pET-28a(+)-GST的酶切鉴定Fig. 2 Restriction analysis of recombinant expression plasmid pET-28a(+)-GST 2.2 pE T-28a(+)-GST原核表达载体的构建 南极衣藻GST开放阅读框PCR产物经测序证明GST-ORF扩增成功。重组表达载体(pET-28a (+)-GST)经BamH I、Sal I双酶切, 呈现目的条带和载体片段大小(图2), 且测序结果共同证明重组表达载体构建成功。诱导表达实验结果(图3)显示, pET-28a (+)-GST重组表达载体在18℃、28℃、37℃均能表达, 并在37℃诱导时表达量最大, 表达蛋白主要以包涵体形式存在;在最佳诱导温度37℃时,目的蛋白的表达量受IPTG浓度影响较小, 但是无IPTG诱导目的蛋白不表达; 在一定时间内, 经相同IPTG浓度诱导目的蛋白的表达量随时间的增加而增加, 在4h时达到最大。 图3 重组表达载体pET-28a(+)-GST表达的优化Fig. 3 The optimization of pET-28a(+)-GST expression 2.3 pE T-28a(+)- GST表达蛋白的纯化及Western blot鉴定 表达载体经0.2 mmol/L IPTG、37℃诱导4h获得足量的表达产物, 经前期处理后采用HisTrap HP层析柱分离纯化, SDS-PAGE电泳显示得到的蛋白分子量约为26 kD(图4B); Western blot检测,在26 kD左右也有明显条带(图4A),证明表达的蛋白为南极衣藻谷胱甘肽硫转移酶蛋白。 图4 pET-28a(+)-GST融合蛋白的SDSPAGE分析(B)和Western blot分析(A)Fig. 4 pET-28a(+)-GST purification product analysis of fusion protein by SDSPAGE (B) and Western blot analysis (A) M. protein marker 1, 2. GST expressed protein 2.4 重组菌BL21(pET-28a(+)-GST)的低温耐受性分析 重组菌在LB板(Kan+)上经4℃处理不同时间后的生长结果(图5)表明, 重组菌BL21(pET-28a(+)-GST)的存活率普遍高于对照菌BL21(pET-28a(+))。且在4天内, 重组菌的存活率显著高于对照组(P<0.05), 说明重组菌的耐低温能力得到增强; 而在第5、第6天时重组菌BL21(pET-28a(+)-GST)和对照菌BL21(pET-28a(+))存活率比较接近, 对低温的耐受性没有显著性的差异(P>0.05)。 图5 GST重组表达后宿主菌E. coli的耐低温性分析Fig. 5 Protective effect of recombinant pET-28a(+)-GST on BL21 cell viability subjected to 4℃ treatment 南极是地球上最冷的地区, 水温常年在0℃左右, 低温被认为是南极生物生存的一个最大挑战。在低温等环境中, 植物通常会产生一系列的氧化反应产生活性氧, 导致氧化胁迫, 对细胞造成很强的破坏性。GST作为生物体内的主要的抗氧化酶之一,可以催化谷胱甘肽与过氧化物质发生反应, 及时消除因严寒所产生的氧化胁迫, 将其转化为无害或低毒物质, 从而协助保护生物体免受损害[18]。研究枸橘对低温胁迫响应基因时, 发现4℃时的GST酶活性是25℃时的1.5倍[19]; 丁燏等[16]在蛋白水平上研究了温度对南极衣藻中谷胱甘肽相关酶活性的影响,发现低温(0℃、−10℃)时GST的活性明显高于对照组; Seppänen, et al.[12]研究了生长于寒冷环境中野生马铃薯中GST基因的特性与表达发现, 该物种GST在寒冷环境中的表达量明显增强, 说明寒冷能促进该物种GST基因的表达。本文根据南极衣藻在实验室的最佳培养温度为4—8℃, 应用实时荧光定量PCR检测了南极衣藻经0℃与14℃处理后GST基因的表达情况(8℃为对照), 发现低温时GST表达量最高, 最高时可达到对照组的2倍多、高温组的5倍多(图1), 在丁燏等[16]对南极衣藻经不同温度处理后, 提取GST蛋白测其活性研究中发现: 低温处理后GST酶活性较高, 最高可达到对照组的4倍; 说明低温时GST酶的活性升高可能与GST的表达量的增加有关。从而本研究结果从基因表达水平进一步证实了丁燏等的研究结果, 证实低温能诱导南极衣藻GST的表达以抵抗严寒环境所产生的氧化胁迫,从而帮助其有效地适应低温环境。本文的结果也与其他植物的研究一致[12,19], 可见GST在生物适应低温环境中具有普遍的作用。 为了进一步验证南极衣藻适应南极严寒环境时GST所起的作用, 我们利用大肠杆菌表达体系具有培养周期短、成本低、高效表达和带有His·tag易于纯化等的优点[20], 构建了pET-28a(+)-GST表达载体(图2)。由于IPTG浓度对pET-28a(+)-GST蛋白的诱导表达影响不明显, 根据IPTG浓度过高会抑制细菌生长的原则, 确定重组质粒最佳表达条件: 0.2 mmol/L IPTG、37℃诱导4h。表达条件的优化为后续获得大量GST蛋白以进行更深入的研究打下了基础。 在南极衣藻GST的表达对E. coli BL21低温耐受性增强实验中, 由于表达产物主要以包涵体形式存在, 研究发现在原核表达产物中包涵体的形成主要是由于蛋白的表达量高、合成速度太快, 致使蛋白没有足够的时间进行正确的折叠, 过多的蛋白间的非特异性结合, 蛋白质无法达到足够的溶解度所形成, 而低表达时很少形成包涵体[21]。为了让目的蛋白GST在E. coli BL21内缓慢表达以减少包涵体的形成, 我们采取了降低转速、延长诱导时间等措施。耐低温实验结果显示, 在低温条件下, 含有重组表达质粒的E. coli BL21的存活率在一定时间内比对照菌高, 说明南极衣藻GST在大肠杆菌E. coli BL21中的表达在一定时间内可以提高大肠杆菌的耐低温能力。该结果与本研究荧光定量PCR结果及前人关于南极衣藻GST相关研究结果一致, 进一步验证了南极衣藻GST基因的表达对其适应南极低温环境起到了一定的积极作用。 近年来, 植物的抗逆性研究逐渐成为一个热点,本研究结果证明了南极衣藻GST在其抗寒方面具有重要的作用, 这为了解南极衣藻对南极寒冷环境的适应提供了重要的理论依据, 也为植物抗逆基因工程应用中提供了重要的资料。 [1] Wagner U, Edwards R, Dixon D P, et al. Probing the diversity of the Arabidopsis glutathione-S-transferase gene family [J]. Plant Molecular Biology, 2002, 49(5): 515—532 [2] Gong H B, Hu W W, Jiao Y X, et al. Molecular characterization of a Phi-class mustard (Brassica juncea) glutathione-S-transferase gene in Arabidopsis thaliana by 5’-deletion analysis of its promoter [J]. Plant Cell Reports, 2005, 24(7): 439—447 [3] Dixon D P, Cummins L, Cole D J, et al. Glutathione-mediated detoxification systems in plants [J]. Current Opinion in Plant Biology, 1998, 1(3): 258—266 [4] Zhang J, Shu W S. Mechanisms of heavy metal cadmium tolerance in plants [J]. Journal of Plant Physiology and Molecular Biology, 2006, 32(1): 1—8 [5] Vollenweider S, Weber H, Stolz S, et al. Fatty acid ketodienes and fatty acid ketotrienes: Michael addition acceptors that accumulate in wounded and diseased Arabidopsis leaves [J]. The Plant Journal, 2000, 24(4): 467—476 [6] Zhou J M, Goldsbrough P B. An Arabidopsis gene with homology to glutathione S-transferases is regulated by ethylene [J]. Plant Molecular Biology, 1993, 22(3): 517—523 [7] Chen W Q, Singh K B. The auxin hydrogen peroxide and salicylic acid induced expression of the Arabidopsis GST6 promoter is mediated in part by an ocs element [J]. The Plant Journal, 1999, 19(6): 667—677 [8] Chen W Q, Chao G, Singh K B. The promoter of a H2O2-inducible, Arabidopsis glutathione S-transferase gene contains closely linked OBF- and OBP1-binding sites [J]. The Plant Journal, 1996, 10(6): 955—966 [9] Zhang Q S, Hou J J, Liu X J, et al. Effects of copper on antioxidant enzymes activities and metallothionein concentration of Bellamya purificata [J]. Acta Hydrobiologica Sinica, 2009, 33(4): 717—725 [张清顺, 侯建军, 刘香江, 等. 铜对梨形环棱螺抗氧化酶活性和金属硫蛋白含量的影响.水生生物学报, 2009, 33(4): 717—725] [10] Fan Y J, Lin F P, An Z W, et al. Cloning and expression analysis of a glutathione-S-transferase gene in the latex of Hevea brasiliensis (para rubber tree) [J]. Scientia Agricultura Sinica, 2011, 44(20): 4150—4158 [范玉洁, 林飞鹏, 安泽伟, 等. 一个橡胶树谷胱甘肽-S-转移酶基因的克隆和表达特性分析. 中国农业科学, 2011, 44(20): 4150—4158] [11] Liu X, He W B, Zhang Z Y. Stress-responsive expression analysis of glutathione-S-transferase gene of Ipomoea batatas (L.) Lam [J]. Hereditas, 2009, 31(8): 859—864 [刘珣,何文博, 张正义. 甘薯谷胱甘肽-S-转移酶基因在胁迫条件下的表达分析. 遗传, 2009, 31(8): 859—864] [12] Seppänen M M, Cardi T, Borg Hyökki M, et al. Characterization and expression of cold induced glutathione S-transferase in freezing tolerant Solanum commersonii, sensitive S. tuberosum and their interspecific somatic hybrids [J]. Plant Science, 2000, 153(2): 125—133 [13] Huang C, Guo T, Zheng S C. Increased cold tolerance in Arabidopsis thaliana transformed with Choristoneura fumiferana glutathione S-transferase gene [J]. Biologia Plantarum, 2009, 53(1): 183—187 [14] Takesawa T, Ito M, Kanzaki, et al. Over-expression of glutathione S-transferase in transgenic rice enhances germination and growth at low temperature [J]. Molecular Breeding, 2002, 9(2): 93—101 [15] Ding Y, Miao J L, Wang Q F, et al. Purification and characterization of a psychrophilic glutathione reductase from Antarctic ice microalgae Chlamydomonas sp. Strain ICE-L [J]. Polar Biology, 2007, 31(1): 23—30 [16] Ding Y, Miao J L, Wang Q F, et al. Influence of temperature on glutathione level and glutathione-related enzyme activities of Antarctic ice microalgae chlamydomonas sp. ICE-L [J]. Chinese Journal of Polar Science, 2007, 18(2): 161—167 [17] Ding Y, Liu Y, Jian J C, et al. Molecular cloning and expression analysis of glutathione reductase gene in Chlamydomonas sp. ICE-L from Antarctica [J]. Mar. Genomics, 2012, 3(5): 59—64 [18] Livak K J, Schmittgen T D. Analysis of relative gene expression data using realtime quantitative PCR and the 2−ΔΔCtmethod [J]. Methods, 2001, 25(4): 402—408 [19] Zhang Y, Hu J, Guo C H, et al. The molecular biology research of glutathione-S-tranferases (GSTs) in plants [J].Natural Sciences Journal of Harbin Normal University, 2007, 23(4): 76—79 [张岩, 胡军, 郭长虹, 等. 植物谷胱甘肽-S-转移酶的分子生物学研究进展. 哈尔滨师范大学自然科学学报, 2007, 23(4): 76—79] [20] Peng T, Zhu Q J, Fan P P, et al. Identification and characterization of low temperature stress responsive genes in Poncirus trifoliata by suppression subtractive hybridization [J]. Gene, doi:10.1016/j.gene.2011, 10, 025 [21] Baneyx F. Recombinant protein expression in Escherichia coli [J]. Current Opinion of Biotechnology, 1999, 10(5): 441—446 [22] Fang M, Huang H L. Advances in vitro refolding of inclusion body proteins [J].Chinese Journal of Biotechnology, 2001, 17(6): 608—612 [方敏, 黄华粱. 包涵体蛋白体外复性的研究进展. 生物工程学报, 2001, 17(6): 608—612] INCREASED ESCHERICHIA COLI TOLERANCE TO LOW TEMPERATURE BY EXPRESSION OF GLUTATHIONE-S-TRANSFERASE GENE FROM THE CHLAMYDOMONAS SP. ICE-L PENG Yue-Yue1,2, DING Yu1,2,3, WANG Jin-Hui1,2, JIAN Ji-Chang1,2,3, LU Yi-Shan1,2,3and LIU Ying1,2 Glutathione-S-transferase (GST, EC2.5.1.18) is the key antioxidant enzyme that catalyzes the conjugation of glutathione to several electrophilic substrates in living beings. Chlamydomonas sp. ICE-L is a rare ice algae living in the Antarctica where cold conditions and strong ultraviolet radiation are present all year round. In order to find out the role that GST in Chlamydomonas sp. ICE-L plays in acclimatizing to freezing polar environment, the expression of GST gene in Chlamydomonas sp. ICE-L was analyzed using real-time PCR under different temperatures. To evaluate the amount of template RNA in each real-time PCR reaction, gene fragments of β-actin was also amplified. The results showed that the Chlamydomonas sp. ICE-L GST gene could be expressed under all experimental temperatures. In the control group, as the temperature was 8℃, the accumulation of GST mRNA was maintained at identical level during 72h. At 0℃, GST mRNA accumulation decreased in the first 6h, which was followed by an increase and peaked at 36h (P<0.01) about more than twice of that in the control group, in the rest time the GST mRNA accumulation recovered to the level of control. At 14℃, the accumulation of GST mRNA was lower than the control group and slowly decreased during the entire experimental period and reached a quarter of the level in the control group at 72h. In addition, the pET-28a(+)-GST prokaryocyte expression vector was constructed and then transformed into E. coli BL21(DE3) to express the GST protein. The optimal expression conditions of pET-28a(+)-GST in E. coli BL21 included by 0.2 mmol/L concentration of IPTG, 37℃ and induction for 4h, and the product was mainly in the form of inclusion body. Using the HisTrap HP Columns, the expression product was separated and purified. Then the product was analyzed and confirmed by SDS-PAGE and Western blot, both results showed that the expression products with the molecular weight of 26 kD in the E. coli BL21(DE3) was the GST protein encoded by the GST gene from Chlamydomonas sp. ICE-L. At last, the E. coli BL21 containing the recombination plasmid (pET-28a(+)-GST) was treated with low temperature before growing on the agarose plate. As the recombination plasmid expressed mainly in the form of non-active aggregated monomers in E. coli BL21 induced with IPTG, we slowed the revolving speed and extended the induction time to express the GST protein with enzyme activation. The results of recombination plasmid treated with low temperature showed that the survival level of E. coli BL21 containing recombination plasmid (pET-28a(+)-GST) was higher than that of E. coli BL21 without this recombination plasmid in the first 4 days and reached the normal level at the 5thand 6thdays. Our results revealed that Chlamydomonas sp. ICE-L GST expressed in E. coli BL21 could improve the tolerance of E. coli to cold conditions, suggesting that GST may play an important role in the defense against freeze in the Chlamydomonas sp. ICE-L in Antarctica. These results provided valuable information on further investigation of the molecular mechanism of Chlamydomonas sp. ICE-L GST gene. Chlamydomonas sp. ICE-L; Glutathione-S-transferase; Expression; Low temperature Q786 A 1000-3207(2013)01-0016-06 10.7541/2013.16 2011-12-27; 2012-11-11 国家自然科学基金项目(40876102); 广东省自然科学基金项目(S2011010005885)资助 彭跃跃(1985—), 男, 湖南人; 硕士研究生; 研究方向为海洋微生物学与病害防治。E-mail: pengyueyue8579@163.com 丁燏(1971—), 博士, 教授; 主要研究方向为海洋微生物学与病害防治。E-mail: dingy@gdou.edu.cn2 结果


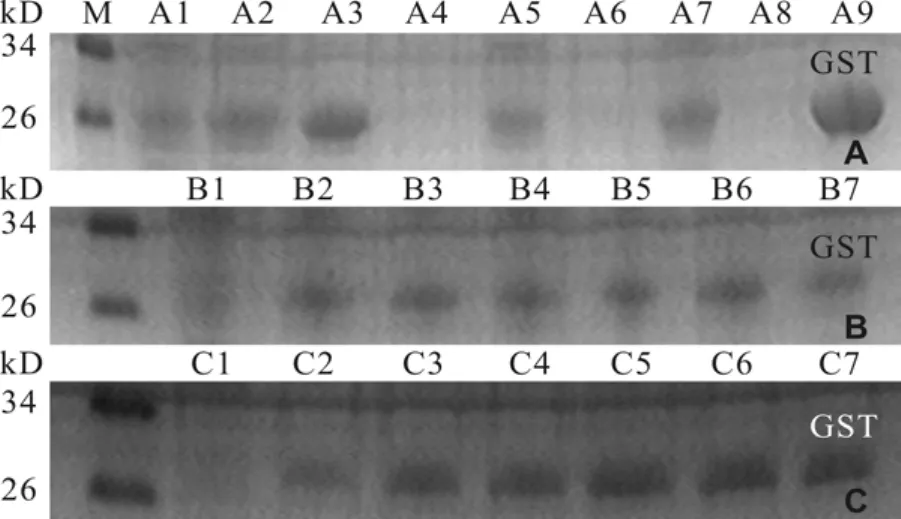
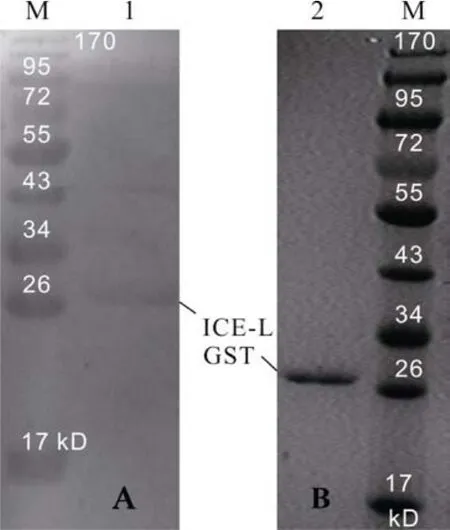

3 讨论
(1. Fisheries College, Guangdong Ocean University, Zhanjiang 524025, China; 2. Guangdong Provincial Key Lab of Pathogenic Biology and Epidemiology for Aquatic Economic Animals, Zhanjiang 524025, China; 3. Guangdong Key Laboratory of Control for Disease of Aquatic Economic Animals, Zhanjiang 524025, China)

