棉花枯萎病菌产角质酶的连续诱导
冉琴琴,张效宁,张文坤,张学俊,2*
(1.贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550003;2.贵州大学 化学与化学工程学院,贵州 贵阳 550003)
角质酶(Cutinase,EC3.1.1.74)是一种多功能酶,具有属于α/β水解酶折叠的共同结构的蛋白质[1],是丝氨酸水解酶家族中较小的成员[2],可以降解角质产生脂肪酸[3],也可以水解甘油三酯等化合物[4]。角质酶能够水解短链或长链酯类,角质酶除了能参与水解反应,也能参与酯化反应[5],能够催化酸与醇的酯化、脂肪酸盐与醇的转酯化等反应,所以角质酶在生物催化[6]、农业化学品工业[7]、农产品深加工[8]、护理用品行业[9]、生物降解及废水处理[10]、纺织工业[11]等方面有着广泛的应用,重要的是其还可以用作酯转换制备生物柴油。现在,对产角质酶的菌株的研究引起了广大科学工作者广泛的兴趣,研究主要有产酶菌株筛选、角质酶菌株的诱导和诱变过程表达、发酵条件优化、角质酶结构和酶特性、基因重组改良过表达等方面的内容[12]。
人们是在研究植物病菌治病机理时发现角质酶的,角质层生长在植物表面对植物组织起到保护作用,当致病菌在入侵植物时,必须分泌出的角质酶降解角质层,破坏角质层后方可侵入到植物内部利用植物组织营养进一步繁殖。在自然界中,角质酶的主要来源有2个方面:微生物和花粉[13]。目前,国内外众多学者对角质酶的研究,主要集中在真菌角质酶和细菌角质酶。
角质酶是诱导酶,只有在角质存在条件下激活真菌内的角质酶基因,诱导其转录表达角质酶。DAVIES KA等[14]的研究指出,未经过角质诱导的真菌,其基因转录表达的角质酶量非常少,但加入角质时会诱导真菌的角质酶基因,使角质酶转录量大大增加。另一方面,分子生物学的方法也可以提高真菌产对角质酶的过表达,张芙华等[15]报道的重组Bacillus subtilisWSHB06-07菌株的角质酶产量可达168.8U/mL。诱导法和分子生物学方法相比之下,分子生物学方法投资高很多、周期长、风险大,而诱导法同样可获得高表达角质酶的菌株,方法更为简便直接,低成本高效率。
本实验以植物病菌为对象,采用诱导法获得高产角质酶,因为该类病菌的繁殖必须借助于角质酶。棉花枯萎病菌(Fusarium oxysporum)是常见的产角质酶的优良菌株,在未添加角质诱导时产酶量可以达到7.932U/mL,比一般的真菌产酶量高。该菌种可从棉花或其生长的土壤中分离是一种专化性较强、寄主范围较窄的病菌。本研究在对该菌株进行生长和发酵产角质酶的环境条件研究的基础上,进行了添加角质对该菌产酶能力的提高以及连续激活真菌的角质酶基因,诱导其转录表达的研究。研究表明,诱导作用可以显著地提高角质酶的产量,产酶量可比无诱导时提高至4倍。
1 材料与方法
1.1 菌种与试剂
棉花枯萎病菌(Fusarium oxysporum):天津农学院植保研究室提供。
对硝基苯丁酸酯(p-nitrophenyl butyrate,PNB)购自美国Sigma公司;NaNO3、K2HPO4、MgSO4、KCl、FeSO4·7H2O、琼脂、葡萄糖等试剂均为国产分析纯。
1.2 培养基
种子培养基:PDA培养基,将土豆洗净去皮,再称取200g马铃薯并切成小块,加1000mL蒸馏水煮烂,用8层纱布过滤,补足水分至1000mL,加热,加入17g琼脂,继续加热搅拌混匀,待琼脂溶解完后,加入20g葡萄糖,搅拌均匀,分装试管或者锥形瓶,加塞、包扎,121℃灭菌20min左右后取出试管摆斜面或者摇匀,冷却后贮存备用。
土豆汁:200g土豆,在沸水中浸煮20min,过滤,滤液置于冰箱中,备用。
发酵基础培养基[16]:葡萄糖1.0g/L,NaNO30.6g/L,K2HPO40.6g/L,MgSO40.2g/L,KCl 0.2g/L,FeSO4·7H2O 0.1g/L,角质0.1%。
矿物质培养基:NaNO30.6g/L,K2HPO40.6g/L,MgSO40.2g/L,KCl 0.2g/L,FeSO4·7H2O 0.1g/L。
1.3 角质的制备
采用蕃茄角质为诱导角质。蕃茄表面有韧性更强的角质,且容易大量获得。蕃茄角质的制备:将蕃茄于沸水中煮5min,骤冷分离取皮,并将皮于草酸缓冲液(草酸4g/L、草酸铵16g/L,pH3.8)中煮沸1.5h,用蒸馏水洗净皮上粘性物质。于50℃干燥箱中烘干至质量恒定,磨碎备用。
1.4 培养方法
种子培养:将储于冰箱中的菌种接入斜面种子培养基上,在30℃培养48h,然后接种于装有100mL液体PDA的250mL锥形瓶中,30℃、160r/min摇床培养36h。
发酵培养:将发酵培养基分装于数个250mL锥形瓶中,每瓶装100mL。取培养36h的种子培养液2mL,加入其中,30℃、160r/min摇床培养。培养完成后将发酵液用12层纱布过滤,滤液再于4℃条件下5500r/min离心30min,上清即为粗酶液,用于酶活测定。
1.5 酶活测定
酶活测定[14]:以对硝基苯丁酸酯(PNB)为底物测定酶的活力。反应体系为1.8mL,包括200μL的粗酶液、200μL 0.4%的Tritonx-100、1380μL 50mmol/L磷酸盐缓冲液(pH 7.0)和20μL 1.76%的PNB溶液。于37℃反应10min后,在波长405nm处测定吸光度值。酶活定义:在反应条件下,将每毫升酶液每分钟产生1μg的对硝基苯酚定义为1个酶活单位,U/mL。酶活计算公式:
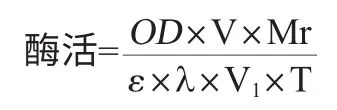
式中:OD为吸光值;V为反应体系的体积,1.8mL;Mr为产物对硝基苯酚的分子量,139.11g/mol;ε为摩尔消光系数,6830L/(mol·cm);λ为比色皿的光程,0.5cm;V1为酶液体积,200μL;T为反应时间10min。
1.6 连续诱导驯化实验方法
连续诱导操作工艺流程:
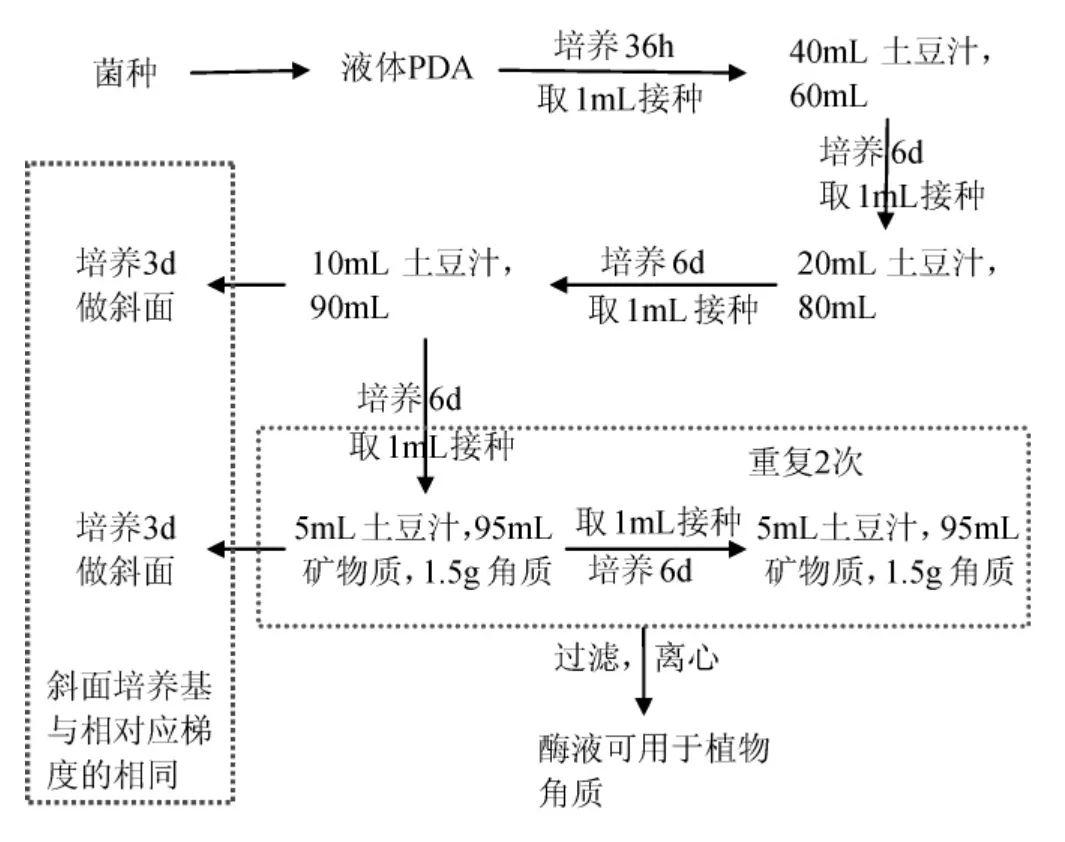
逐渐降低培养基中土豆汁的含量,逐渐提高角质的含量,形成培养基中碳源角质与土豆汁之间的含量比值变化的梯度环境。使得棉花枯萎病菌(F.oxysporum)在该环境条件下,被迫分泌产生更多的角质酶以适应新的生长环境。这样可以使得真菌的角质酶基因一直处于亢奋的激活状态,角质酶基因的转录量维持在逐步升高的水平,角质酶的产量也就随之逐步升高。
发酵培养基中土豆汁的添加量分别为40mL、20mL、10mL、5mL,矿物质溶液的添加量分别是60mL、80mL、90mL、95mL,而角质的添加量分别为0.5g、0.8g、1.0g、1.5g。将棉花枯萎病菌接种于第一梯度培养基中,培养6d后,接入下一梯度培养基中,依次作相同处理。
2 结果与讨论
2.1 菌种接种种龄的确定
为了确定最佳接种时间,按照1.4所述的种子培养方法,分别培养12h、24h、36h、48h、60h、72h,培养液以5000r/min离心30min,倾去上清液,加入蒸馏水100mL,再离心。重复3次。倾去上清液,烘干至质量恒定,称质量,得细胞干质量与时间的关系见图1。
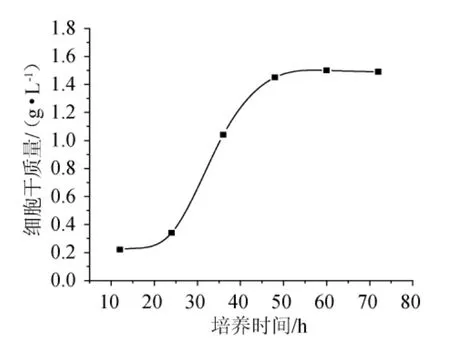
图1 时间对菌体生长的影响Fig.1 Effect of time on bacteria growth
由图1可知,显示了72h内菌体生长的变化情况,由生物量变化可知,菌体培养至25h~50h时处于对数生长期,对数生长期时菌体以一个恒定的最大的比生长速度生长,细胞数量呈指数递增,生长繁殖旺盛因此对数期可以获得健壮且数量众多的发酵种子。本实验选择菌体培养36h的处于对数生长期的菌体接种。
2.2 发酵温度及培养基初始pH值的确定
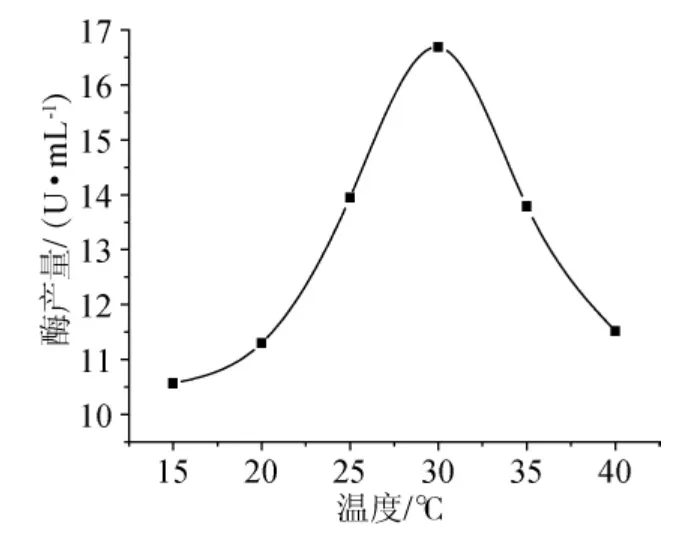
图2 培养温度对产角质酶的影响Fig.2 Effect of temperature on producting cutinase
为了考察温度对菌株产角质酶的影响,以基础培养基为营养,分别于15℃、20℃、25℃、30℃、35℃、40℃等温度条件下发酵培养,培养6d后测酶活,结果见图2。从图2可以发现,30℃发酵培养时可以获得最高的角质酶酶活,说明此温度条件下棉花枯萎病菌表达的角质酶量达到最大。因此,可该菌确定产角质酶酶的最适温度为30℃。
菌株和酶的活性和其活性状态都与环境的pH值有着密切的关系,培养基的pH值是影响微生物菌种生长和生产的一个重要的环境因素。在研究中将基础培养基的初始pH值分别调至6.5、7.0、7.5、8.0、8.5、9.0、9.5进行发酵培养,培养6d后测酶活,结果见图3。

图3 初始pH值对产角质酶的影响Fig.3 Effect initial pH value on cutin enzyme production
图3确定了该菌产角质酶的最佳初始pH值,表明在pH 6.5~8.5范围内,随着pH值升高,酶活也逐渐升高,pH值>8.5以后,随pH值的升高酶活力降低,所以pH 8.5是该菌产酶最佳酸碱度。
2.3 培养时间及角质对酶的产生的影响
将斜面的菌种活化,接入装有100mL发酵培养基的250mL锥形瓶中培养至对数期,再按2%接种量接入发酵培养基中,30℃、160r/min摇床振荡培养,分别在1d、2d、3d、4d、5d、6d、7d、8d取样、过滤、离心、测酶活,且每个样品做3个平行样。以不加角质样作为对照,结果见图4。
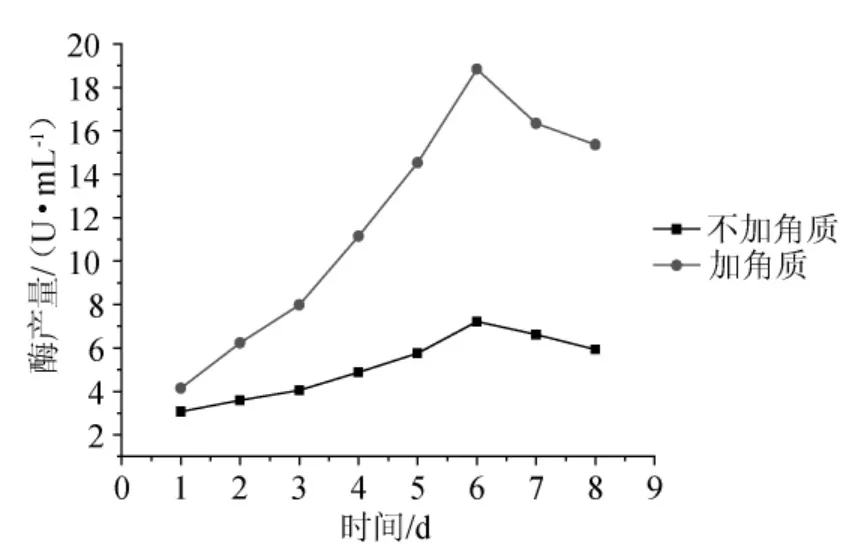
图4 培养时间及角质对产酶的影响Fig.4 Effect of training time and cutin on enzyme production
图4表明,棉花枯萎病菌经发酵培养,角质酶的活性在第6d时达到最高,之后随着发酵时间的增加活性逐渐降低,因此可确定产酶最佳时间为6d。从图4还可以看出,在培养基中添加0.2%的蕃茄角质后,菌种产角质酶的量明显有所提高,比未添加角质时提高了3倍,产酶量最高达到29.46U/mL,比未诱导时提高至4倍。因为其产酶量提高4倍的情况还不够稳定,因此本文选择了产酶量提高的平均水平,即19.06U/mL,比未添加时提高3倍。这充分说明角质酶是诱导酶,微量的角质就对菌种产角质酶起到了明显的诱导作用,利用角质诱导棉花枯萎病菌(F.oxysporum)产角质酶,这也与角质酶是一种诱导酶的结论是相符的,也说明诱导法是简便可行的有效方法。这充分说明角质酶是诱导酶,微量的角质就对菌种产角质酶起到了明显的诱导作用。
2.4 连续诱导
菌种的驯化是通过人工措施使微生物逐步适应某一环境,而定向选育微生物的方法,驯化获得具有较高耐受力及活动能力的菌株。目前报道较多的例子是用于废水处理中的微生物,通过驯化得到对某种污染物具有较高降解能力和耐受力的高效菌株。
酶的合成受到基因表达的调控,也就是说,生物在生长发育过程中,基因表达可按一定时间程序发生改变,而且随着内外环境的变化而加以调控,这就是基因表达的时序调节和适应调节,基因表达的调节可以在不同水平(包括转录前、转录和转录后)或在翻译的水平(包括翻译和翻译后)[17]。当在培养基中加入诱导物,诱导物能够激活其基因的转录表达,合成有关的信使核糖核酸(mRNA),并翻译成诱导酶。
按照操作流程,每一梯度发酵后,培养液以5000r/min转速离心30min,倾去上清液,再加入蒸馏水100mL,再离心。重复3次。倾去上清,烘干至质量恒定,称质量,结果见图5~图7。

图5 菌种在各梯度下生长情况Fig.5 Bacteria growth in the gradient
在研究中设计了一个梯度环境,此环境的培养基中碳源角质与土豆汁之间的含量对应变化。逐渐降低培养基中土豆汁的含量,并逐渐提高角质的含量,使得较易被棉花枯萎病菌(F.oxysporum)利用的碳源土豆汁的含量不断减少,而角质含量逐渐增加,使棉花枯萎病菌需要分泌产生更多的角质酶来适应新的环境。在这过程中如果枯萎病菌能利用角质作为碳源,这将更有利于角质酶的表达。梯度环境可以使得棉花枯萎病菌(F.oxysporum)的角质酶基因一直处于激活状态,角质酶基因的转录量随着环境中角质含量的增加而逐步升高,角质酶的产量也会维持在一个逐步升高的水平上。
从图6可以看出,随着培养基中土豆汁含量的减少,菌体细胞干质量随之减少,说明土豆汁与棉花枯萎病菌(F.oxysporum)生长量有着密切相关的关系,也说明了棉花枯萎病菌不能像利用土豆汁那样利用角质进行菌体的生长繁殖,角质还不能完全替代土豆汁作为碳源。但从结果(图7)可以看出,培养基中产的角质酶并没有随真菌生物量的减少而降低,反而有明显的增加。说明了连续的诱导可以提高棉花枯萎病菌(Fusarium oxysporum)产酶的能力。加入角质连续诱导后,角质酶的产量有了明显的提高,一般情况可以提高3倍,最高可以达到29.46U/mL,比未诱导时产酶能力提高至4倍。
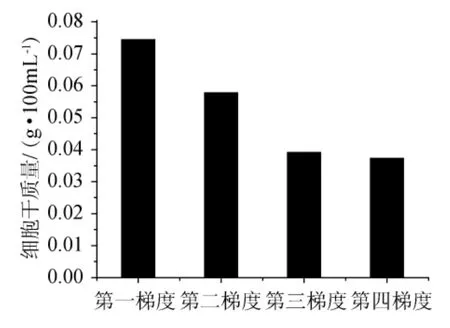
图6 土豆汁含量对菌体干质量的影响Fig.6 Effect of potato juice content on dry cell weight
由图6、图7可知,当营养相对丰富时,真菌的生物量能够得到一定的积累,经过角质诱导后,产角质酶的量就会大大的提高;角质酶是一种诱导酶,角质能够激活角质酶基因的转录表达,不断降低其他易被利用的碳源含量并同时提高角质在其中的含量,使得棉花枯萎病菌始终处于产酶较高的水平。
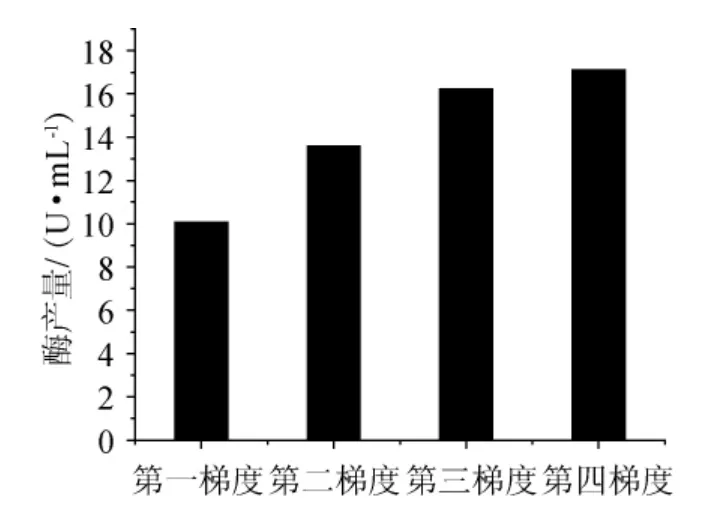
图7 真菌生物量对酶活的影响Fig.7 Effect of fungal biomass on the enzyme activity
在发酵产酶过程中,为了提高酶的产量,除了选育优良的产酶细胞,保证发酵工艺条件并根据需要和变化情况进行及时调节控制以外,还可以采取某些行之有效的措施如添加诱导物、控制阻遏物浓度、添加表面活性剂或其他产酶促进剂等[18]。
对于诱导发酵生产,在发酵培养基中添加适量诱导物,使产酶量显著提高。诱导物一般可分为3类:酶的作用底物、酶的催化反应产物、酶的底物类似物。根据文献报道,角质酶是一种诱导酶,其诱导物是角质酶的作用底物角质。本实验也证实了这一点,相对于无角质存在的发酵过程,添加角质后的产酶量得以显著的提高。对照图6、图7,可以得出这样的结论,角质酶活性的提高并不是因为棉花枯萎病菌繁殖量的提高,而是角质加入量的增加(图6、图7中的第四梯度)提高了菌株对角质酶的表达。
3 结论
角质酶的基因在受到角质的诱导作用下被激活,会表达产生更多的角质酶。本实验采用连续诱导法培养菌株,控制培养基中的土豆汁与角质的含量,使得菌株一直处于一个有角质存在的环境中。而且土豆汁的含量越来越少,角质越来越多,这就说明角质酶活的增加不是菌株生物量的增加带来的,而是角质诱导的作用使菌株的角质酶表达能力提高了。在这样的环境下角质酶基因的表达会因角质的存在保持在一个较高的水平上,从而达到保持菌种产角质酶能力的一个较高水平。
角质酶的应用十分广泛,其在食品工业、化工工业及印染工业等许多领域都有应用。近几年还发现,角质酶可用于化纤面料的表面修饰及棉散纤维前处理[11]。但没有大规模的工业生产角质酶,因此提高角质酶产量的研究具有广泛的理论与实践意义。
[1]HOLMQUIST M.Alpha/Beta-hydrolase fold enzymes:structures,functions and mechanisms[J].Curr Protein Pept Sc,2000,1(2):209-235.
[2]EGMOND MR,De VLIEG J.Fusarium solani pisi cutinase[J].Biochimie,2000,82:1015-1021.
[3]KOLATTUKUDY PE,PURDY RE,MAITI IB.Cutinases from fungi and pollen[M].//BORG STRÖM B.,BROCKMAN H.(eds.)Lipases.Amsterdam:Elsevier,1984,66:71-504.
[4]MURPHY CA,CAMERON JA,HUANG SJ,et al.Fusarium polycaprolactone depolymerase is cutinase[J].Appl Environ Microb,1996,62(2):456-460.
[5]MARTINEZ C,P De GEUS,LAUWERWYS M,et al.Fusarium solani cutinaseis a lipolytic enzyme with a catalytic serine accessible to solvent[J].Nature,1992,356:615-618.
[6]TADAYUKI S[P].J P pat,08092023,1996-09-04.
[7]KIM YH,AHN JY,MOON SH,et al.Biodegradation and detoxification of organophosphate insecticide malathion byFusarium oxysporumf.sp.pisi cutinase[J].Chemosphere,2005,60:1349-1355.
[8]FETT WF,GÉRARD HC,MOREAU RA.Cutinase production byStreptomycesspp[J].Curr Microbiol,1992,25(3):165-171.
[9]JOHAN S.Laundry detergent and/or fabric care compositions comprising a modified transferase[P].US Patent:1999057254,1999.
[10]SHIMAO M.Biodegradation of plastics[J].Curr Opin Biotech,2001,12(3):242-247.
[11]郭 森.重组大肠杆菌产角质酶-CBM[D].无锡:江南大学硕士论文,2012.
[12]查理德N,斯特兰特.彭友良译.植物病理学导论[M].北京:化学工业出版社,2007.
[13]张守亮,陈 坚.角质酶产生菌Thermobifida fuscaWSH03-11 诱变及高产突变株发酵条件优化[J].化工进展,2006,25(5):533-537.
[14]DAVIES KA,DE LORONO I,FOSTER SJ,et al.Evidence for a role of cutinase in pathogenicity ofPyrenopeziza brassicaeon brassicas[J].Physiol Mol Plant P,2000,57(2):63-75.
[15]张芙华,陈 晟,张东旭,等.pH 两阶段控制策略发酵生产重组角质酶[J].中国生物工程杂志,2008,28(5):59-64.
[16]SHERYL F,GOTE J,RAJNI HK,Purification of recombinant cutinase by extraction in an aqueous two-phase system facilitated by a fatty acid substrate[J].Biotechnol Bioeng,73(6):465-475.
[17]杨志敏,蒋立科.生物化学[M].北京:高等教育出版社,2005.
[18]刑淑婕,夏新奎.酶工程[M].北京:高等教育出版社,2008.

