AT2R基因在体可调控表达对大鼠血管损伤后MMP-2表达的影响
景 涛, 刘建平, 苗 莉, 冯 健, 冉擘力, 王海东, 何国祥*
AT2R基因在体可调控表达对大鼠血管损伤后MMP-2表达的影响
景 涛1, 刘建平1, 苗 莉1, 冯 健2, 冉擘力1, 王海东3, 何国祥1*
(第三军医大学西南医院:1心内科,3胸心外科, 重庆 400038;2泸州医学院附属医院心内科, 泸州 646000)
研究间充质干细胞(MSCs)移植实现血管紧张素Ⅱ2型受体(AT2R)基因在体可调控表达对大鼠颈动脉损伤后新生内膜中基质金属蛋白酶2(MMP-2)表达的影响。采用常规分子生物学方法连续两个回合转染体外培养的MSCs,获得受到强力霉素(Dox)调控的低背景、高诱导表达AT2R基因的双重稳定MSCs系;建立大鼠颈动脉球囊损伤动物模型,将双重稳定MSCs系种植于动脉损伤局部,通过尾静脉注射Dox,分别于术后14、28d行病理切片,采用免疫印迹、免疫组化法及RT-PCR等技术检测AT2R基因在新生内膜中的表达及其对MMP-2表达的影响。成功建立了低背景、高诱导表达AT2R基因的双重稳定MSCs系。该MSCs系受到Dox给予/去除的紧密调控,诱导后48h即可使AT2R显著表达,在Dox干预72h后AT2R表达进一步增强;这种表达的可诱导性至少在8周内维持稳定。免疫印迹、免疫组化及RT-PCR检测显示:球囊损伤大鼠血管后14d及28d,Dox组新生内膜中AT2R的表达显著高于对照组、MSC组、MSC转染组(<0.01);同时,Dox组新生内膜中MMP-2阳性染色较对照组、MSC组和MSC转染组显著减弱(<0.01)。血管损伤局部导入双重稳定MSCs系后AT2R表达受到Dox的良好调控。Dox诱导AT2R表达后,新生内膜中MMP-2表达减少,可能是MSCs细胞移植实现AT2R基因在体可调控表达有效抑制新生内膜增生的机制之一。
血管紧张素Ⅱ2型受体; 可调控表达; 间充质干细胞; 新生内膜增生; 基质金属蛋白酶
血管内皮损伤后中层血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的迁移、过度增殖及细胞外基质(extracellular matrix,ECM)合成增加是血管成形术后再狭窄发生的基本病理生理基础,因此,有效抑制VSMCs的迁移、增殖及ECM增加是预防再狭窄发生的研究焦点[1]。有研究显示[2-4],血管损伤后,骨髓中的间充质干细胞(mesenchymal stem cells,MSCs)黏附于损伤的血管局部,并进一步分化为VSMCs和内皮细胞,这些骨髓前体细胞来源的VSMCs与血管中膜迁移而来的VSMCs一起,共同参与血管损伤后再狭窄的形成。同时,近来研究发现AngⅡ的2型受体(AT2R)对细胞的增殖、迁移具有负性影响,通过局部导入使其表达增强可以明显减轻新生内膜的面积[5]。因此,PCI术后,促使损伤血管局部表达AT2R增高并发挥功能活性,将为再狭窄的防治开辟新途径。
VSMCs迁移时,一方面分泌大量ECM,一方面又产生基质金属蛋白酶(matrix metalloproteinases,MMPs)使ECM不断降解,因此血管再狭窄的过程也是基质重建的过程[6]。本实验室的前期系列研究结果表明[7],体外培养的双重稳定表达AT2R基因的VSMCs在Dox的干预下,AT2R基因表达增高的同时,抑制了VSMCs的增生,而且ECM成分发生了相应地变化,推测AT2R基因可能通过对ECM形成的影响,减轻血管损伤后新生内膜形成过程中的结构重塑,减低再狭窄的发生。那么在体情况下,导入转染了外源可调控AT2R基因的MSCs对血管中新生内膜形成及ECM的影响,尚缺乏有关的研究。因此,本实验观测转染了外源可调控AT2R基因的MSCs导入后在Dox干预下,MMP-2表达在转录和翻译水平受到的影响,进一步完善我们实验室对AT2R在体可调控表达的研究。
1 材料与方法
1.1 大鼠MSCs的分离及培养
SD大鼠,雄性,体质量80~100g,由第三军医大学实验动物中心提供。3%戊巴比妥过量麻醉处死后,无菌条件下分离双侧股骨及胫骨,剪去骨端,置于无菌培养皿内,用无血清DMED培养液反复冲洗骨髓腔,全骨髓离心(1000r/min,10min),将全骨髓离心沉淀物加入淋巴细胞分离液后离心(1500r/min,20min),小心吸取中间单个核细胞层界面,加入DMEM全培养基,置于37℃,5%CO2培养箱内。
1.2 建立Dox-on双重稳定表达AT2R基因MSCs细胞系[7]
1.2.1 大鼠AT2R基因Dox诱导表达系统的构建 采用同源重组方法将AT2R目的基因片段克隆于含TetO重复序列的表达载体pUHD10-3中,从而建立由调控质粒pUHD 17-1hyg、哺乳动物表达质粒pUHD 10-3/AT2R、荧光报告质粒pUHC 13-3以及提供新霉素筛选抗性的简单质粒pSV2neo四种成分组成的受Dox调控的哺乳动物表达系统(Dox-on系统)。
1.2.2 脂质体转染 按照脂质体转染试剂盒的说明,连续两个回合转染MSCs,通过抗生素压力筛选出抗性克隆。采用荧光素酶表达瞬时转染法检测不同细胞克隆荧光素酶活性改变(相对荧光单位s-1,RLU s-1);应用RT-PCR法分别检测Dox给予前后AT2R mRNA的表达情况,根据各个细胞克隆受Dox调控表达的程度,筛选出低背景、高诱导表达AT2R目的基因克隆作为双重稳定MSCs细胞系并进行扩增培养。
1.2.3 Dox-on双重稳定MSCs细胞系AT2R蛋白表达检测 实验分对照组(未转染组)、转染后1周未经Dox干预组、转染后经Dox 1mg/L干预48h组、干预72h组,同时观测至转染后8周。应用Western blotting检测Dox诱导下AT2R蛋白表达情况。一抗为兔抗人AT2R多克隆抗体(1∶500,美国Santa Cruz公司),凝胶扫描成像系统进行分析,蛋白表达量用与内参GAPDH的吸光度比值表示。
1.3 大鼠颈动脉球囊损伤模型的建立及MSCs移植
实验分5组:正常组(未进行球囊扩张)、对照组(球囊扩张后未导入MSCs组)、MSC组(球囊扩张后导入未转染AT2R的常规培养MSCs)、MSC转染组(球囊扩张后导入转染AT2R的MSCs,未给予Dox)、Dox组(球囊扩张后导入转染AT2R的MSCs,并给予Dox)。取雄性SD大鼠(体质量380~450g),巴比妥钠麻醉后夹闭左颈总动脉近心端及颈内动脉,结扎颈外动脉远端;向球囊损伤的左颈总动脉节段内注入MSCs悬液50μl(1×104/ml),对照组注入PBS。留置30min后,结扎颈外动脉,恢复颈总动脉至颈内动脉血流。Dox组于手术后当天开始至处死前一天每天尾静脉注射Dox(100μg/kg)。分别于术后14、28d(各时相点每组12只大鼠)分离颈总动脉,取损伤血管段及对侧正常血管段保存待检。
1.4 各组血管AT2R的表达检测
采用兔抗人AT2R多克隆抗体(1∶100,美国Santa Cruz公司)免疫印迹及免疫荧光检测AT2R的蛋白在血管表达。Image pro plus6.0图像分析系统半定量分析。
1.5 新生内膜增生的检测
各组血管HE染色,在光镜下观察血管内膜增生情况,以内弹力膜为界限区分内膜和中膜,利用Image pro plus6.0计算机图像分析系统测量内膜面积和中膜面积,并计算内膜/中膜面积比(I/M)。
1.6 新生内膜中MMP-2表达检测
RT-PCR方法检测血管中MMP-2 mRNA的表达:MMP-2引物(307bp),退火温度55℃,正义 5-TCA ACG GTC GGG AAT ACA-3;反义5¢-CCC ACA GTG GAC ATA GCG-3¢。GAPDH引物(452 bp),正义:5¢-ACC ACA GTC CAT GCC ATC AC-3¢,反义:5¢-TCC ACC ACC CTG TTG CTG TA-3¢。PCR扩增产物1.2%琼脂糖凝胶常规电泳,结果行凝胶扫描留存,并行图像分析,mRNA表达量用Intensity(INT)表示。免疫组化法方法同上。其中鼠抗MMP-2单克隆抗体(为1∶100稀释)美国LAB VISION公司。Image pro plus6.0图像分析系统半定量分析。
1.7 统计学处理
2 结 果
2.1 双重稳定MSCs细胞系中AT2R蛋白表达
免疫印迹法检测结果表明,未转染对照组无AT2R蛋白的表达,转染组中未经Dox干预的细胞未见到明显的AT2R蛋白表达,转染后经Dox(1mg/L)干预48h后可见AT2R蛋白被显著诱导表达;这种表达在Dox干预后72h进一步增强(图1);并且这种表达的可诱导性至少在8周内维持稳定(资料未显示)。
2.2 损伤血管段细胞移植后AT2R的表达情况分析
实验动物数量分析实验选用SD大鼠120只(每组12只),无脱失,均进入结果分析。免疫组织化学结果显示,未行球囊内皮剥脱的右颈总动脉未见AT2R蛋白表达,在损伤后14d时,对照组在动脉壁的内膜、中膜及外膜有少量AT2R表达(OD值:47.62±12.11),MSC组(52.22±9.08)、MSC转染组(50.76±10.42)及对照组3组间比较,AT2R的表达差异无统计学意义(=1.149,>0.05),而Dox组新生内膜中AT2R的表达显著高于其他手术组(88.20±21.39,=51.277,<0.01);损伤后28d时各组血管壁中AT2R的表达较14d时均有所降低(OD值分别为37.12±9.50、38.78±5.76、41.50±9.98),Dox组AT2R蛋白表达(85.67±19.88)仍显著高于其它手术组(<0.01)。

图1 双重稳定表达AT2R基因MSCs细胞系中AT2R蛋白表达
Figure 1 AT2R protein expression in double-stable MSCs lines (=10)
A: 未转染组; B: 转染后1周未经Dox干预组; C: 转染后1周经Dox 1mg/L干预48h组; D: 转染后1周经Dox 1mg/L干预72h组。与转染后1周未经Dox干预组比较,P<0.05; 与转染后1周经Dox 1mg/L干预48h组比较,#<0.05
2.3 双重稳定表达AT2R基因MSCs移植对血管损伤局部MMP-2mRNA表达的影响
实验结果显示,在正常组血管壁中,存在很弱的MMP-2 mRNA基础表达,在球囊损伤后14d时,对照组、MSC组和MSC转染组的MMP-2 mRNA表达量显著增加,与正常组比较差异有统计学意义(<0.01),3组间MMP-2m RNA表达量比较,差异无统计学意义(=1.319,>0.05);Dox组MMP-2m RNA表达量亦较正常组增加(<0.01),但表达水平显著低于对照组、MSC组和MSC转染组(=207.859,<0.05)。在球囊损伤后28d时,对照组、MSC组和MSC转染组的MMP-2 mRNA表达水平降低,但仍维持较高的表达量,3组间比较,差异无统计学意义(=0.423,>0.05);Dox组MMP-2 mRNA表达水平明显降低,显著低于对照组、MSC组和MSC转染组(=43.494,<0.01;图2)。

图2 各组血管MMP-2 mRNA表达的比较
Figure 2 MMP-2 mRNA expression in the carotid artery
与对照组、MSC组和MSC转染组,*<0.05,**<0.01; 与正常组比较,##<0.01
2.4 双重稳定表达AT2R基因MSCs移植对血管损伤局部MMP-2 蛋白表达的影响
对MMP-2蛋白表达结果分析显示,在正常组血管壁的中膜及外膜层可见存在于胞浆内的MMP-2棕黄色阳性着色,其染色强度很弱,在胞浆内散在分布;在球囊损伤后14d时,对照组、MSC组和MSC转染组的MMP-2阳性染色显著增强,主要于新生内膜区出现较强阳性表达,3组间比较差异无统计学意义(=0.815,>0.05),三组均同时伴随明显的血管新生内膜增生,造成明显的管腔狭窄,三组间新生内膜/中膜面积比(I/M)差异无统计学意义(1.43±0.21,=0.235,>0.05)。Dox组MMP-2在新生内膜中的阳性表达与前三组相比显著减弱(=47.995,<0.01),同时新生内膜增生程度较其它各损伤组明显减轻(I/M:0.81±0.11,=72.417,<0.01)。在球囊损伤后28d时,对照组、MSC组和MSC转染组的新生内膜区仍有较强的MMP-2阳性染色,与14d相比阳性强度减弱,三组间比较差异无统计学意义(=0. 369,>0.05);Dox组MMP-2在新生内膜中的阳性表达较14d时有明显降低,与前3组相比显著减弱(=19.687,<0.01;图3,表1)。上述结果与MMP-2 mRNA检测结果呈相同趋势。
3 讨 论
ECM是细胞生存的微环境,在人体的发育、细胞的分化与移行、信号转导等生理过程和炎症损伤修复等病理过程中具有重要功能和作用。既往研究发现,血管损伤修复过程中,ECM与VSMCs之间存在着复杂的相互作用,ECM不仅是将VSMCs黏附在一起的连接物和支持物,而且对于VSMCs表型的转变、迁移、增殖和凋亡都具有重要的影响[8]。
在正常动脉壁中ECM的合成与分解处于相对平衡,基质成分相对稳定。当血管内皮经受各种原因的损伤时,VSMCs由收缩型转变为合成型,合成ECM的能力大大增加,同时降解ECM酶类的分泌也增加。因此,ECM的合成和降解达成一种新的动态平衡,即ECM重塑。伴随着这种ECM重塑,血管壁细胞的生物学行为、血管壁的形态和功能均会发生改变[9]。
研究认为细胞周围的ECM的迅速降解是VSMCs迁移与增殖初期的关键步骤之一,其中MMPs是一种特异性降解ECM各成分的内源性锌依赖性酶家族,被认为是最重要的一类基质降解酶类[10],对ECM有广泛的降解作用。胶原是ECM的主要成分,血管壁细胞间胶原以I/Ⅲ型为主,Ⅳ型胶原参与基底膜的形成。MMP2是Ⅳ型胶原酶(明胶酶)的主要成员,其主要降解底物为Ⅳ、V和Ⅷ型胶原。在再狭窄病变中大量平滑肌细胞失去了收缩功能,以自分泌、旁分泌方式分泌大量MMPs,降解细胞外基质。平滑肌细胞分泌的MMP-2、MMP-9可有效降解基底膜,为细胞迁移清扫道路[11]。动物实验研究结果表明,用球囊导管对血管内膜进行剥脱后第4~5d即有MMP-2表达增加,至7~14d左右达到峰值,并在较高水平上维持3~4周;应用MMP抑制剂可减少胶原的合成与降解,并使VSMCs从中膜向内膜的迁移减少90%以上,因此认为MMP-2对血管损伤后的重塑具有重要的影响[12]。本实验室在前期研究中发现,AngⅡ可以使培养的VSMCs的MMP-2表达显著升高,认为MMP-2参与了由AngⅡ刺激产生的VSMCs迁移过程,采用Dox干预使该双重稳定VSMCs表达AT2R蛋白后,AngⅡ刺激所引起的MMP-2表达升高得到显著抑制。在本实验中,我们进一步于在体的研究中发现,球囊损伤血管内皮后14d时MMP-2的表达出现显著增高,并且表达主要位于新生内膜区,被破坏了内弹力板附近的向内膜区迁移增生的VSMCs亦可见明显表达;术后28d时MMP-2仍维持较高的表达。Dox组AT2R蛋白表达明显增加,同时发现MMP-2在弹力板附近的向内膜区迁移增生的VSMCs中可见较少量表达,而新生内膜区表达显著降低。MSC组与MSC转染组血管中MMP-2的表达水平与对照组无明显差异。通过以上的研究结果推测认为,血管内皮损伤后修复过程中,在多种细胞因子的作用下,胶原的合成与降解都加快,由于MMP-2的高表达,可促进损伤修复早期胶原降解加速,进而促进了VSMCs的迁移与早期增殖;可调控的AT2R基因激活后抑制MMP-2表达,降低了胶原在损伤早期的降解,使胶原的合成与降解之间达到早期平衡,从而可减弱血管内皮损伤后VSMCs的迁移、增生,进而可能减轻新生内膜形成过程中的结构重塑,降低再狭窄的发生率。
表1 各组血管中MMP-2蛋白表达图像分析结果
注: 与正常组比较,<0.01; 与对照组、MSC组及MSC转染组比较,##<0.01
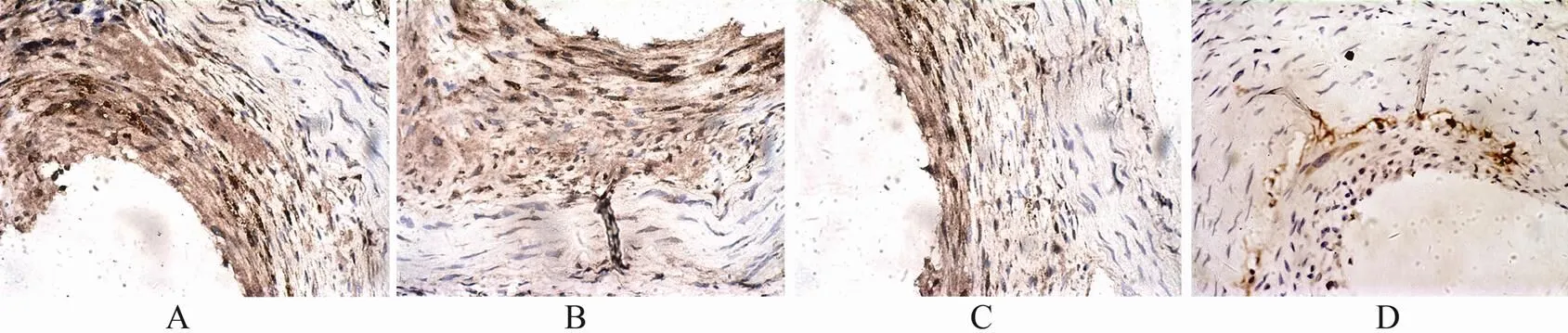
图3 颈动脉MMP-2表达的免疫组化检测
Figure 3 Immunohistochemisty of MMP-2 expression in arterial walls (染色方法×400)
A: 对照组; B: MSC组; C: MSC转染组; D: Dox组
上述研究结果提示,双重稳定表达AT2R基因的MSCs导入损伤血管后,在Dox的调控下上调AT2R基因的表达,并且通过调节损伤血管修复过程中ECM的表达,可能是AT2R介导抑制新生内膜过度增生的机制之一。
[1] Xu S, Shriver AS, Jagadeesha DK,. Increased expression of Nox1 in neointimal smooth muscle cells promotes activation of matrix metalloproteinase-9[J]. J Vasc Res, 2012, 49(3): 242-248.
[2] Teruko S, Hiroshi S, Yoshitaka I. Bone marrow cells contribute to neointimal formation after stent implantation in swine[J]. Int J Cardiol, 2007, 121(1): 44-52.
[3] Orlandi A, Bennett M. Progenitor cell-derived smooth muscle cells in vascular disease[J]. Biochem Pharmacol, 2010, 79(12): 1706-1713.
[4] Daniel JM, Bielenberg W, Stieger P,. Time-course analysis on the differentiation of bone marrow-derived progenitor cells into smooth muscle cells during neointima formation[J]. Arterioscler Thromb Vasc Biol, 2010, 30(10): 1890-1896.
[5] Lemarié CA, Schiffrin EL. The angiotensin II type 2 receptor in cardiovascular disease[J]. J Renin Angiotensin Aldosterone Syst, 2010, 11(1): 19-31.
[6] Newby AC. Matrix metalloproteinases regulate migration, proliferation, and death of vascular smooth muscle cells by degrading matrix and non-matrix substrates[J]. Cardiovasc Res, 2006, 69(3): 614-624.
[7] Jing T, Wang H, Srivenugopal KS,. Conditional expression of type 2 angiotensin II receptor in rat vascular smooth muscle cells reveals the interplay of angiotensin system in matrix metalloproteinase 2 expression and vascular remodeling[J]. Int J Mol Med, 2009, 24(1): 103-110.
[8] Goel SA, Guo LW, Liu B,. Mechanisms of post-intervention arterial remodelling[J]. Cardiovasc Res, 2012, 96(3): 363-371.
[9] Backes A, Seay U, Sedding DG,. Inhibition of matrix deposition: a new strategy for prevention of restenosis after balloon angioplasty[J]. J Cardiovasc Pharmacol, 2010, 55(2): 213-218.
[10] Newby AC. Matrix metalloproteinase inhibition therapy for vascular diseases[J]. Vasc Pharmacol, 2012, 56(5-6): 232-244.
[11] Katsaros KM, Kastl SP, Zorn G,. Increased restenosis rate after implantation of drug-eluting stents in patients with elevated serum activity of matrix metalloproteinase-2 and -9[J]. JACC Cardiovasc Interv, 2010, 3(1): 90-97.
[12] Newby AC. Dual role of matrix metalloproteinases (matrixins) in intimal thickening and atherosclerotic plaque rupture[J]. Physiol Rev, 2005, 85(1): 1-31.
(编辑: 王雪萍)
Effect of regulatable expression of AT2R on MMP-2 expression in neointima after vascular injury in rats
JING Tao1, LIU Jianping1, MIAO Li1, Feng Jian2, RAN Boli1, WANG Haidong3, HE Guoxiang1*
(1Department of Cardiology,3Department of Cardiothoracic Surgery, Southwest Hospital, Third Military Medical University, Chongqing 400038, China;2Department of Cardiology, Affiliated Hospital, Luzhou Medical College, Luzhou 646000, China)
To evaluate the role of regulatable expression of AT2R geneon the expression of matrix metalloproteinase 2 (MMP-2) in the neointima after vascular injury in rats by deoxycycline (Dox)-on mesenchymal stem cells (MSCs) transplantation.Two successive rounds of transfection of cultured MSCs were performed with conventional molecular biological methods. MSCs with low background expression and high Dox-induced expression of AT2R gene were deemed double-stable MSCs. Rat models of balloon-induced carotid injury were established. Double-stable MSCs were then transplanted into the site of carotid injury, and Dox was injectedvena caudalis into rats. Pathological study was carried out at 14d and 28d after cell transplantation. AT2R gene expression in the neointima and its effect on the mRNA and protein expression of MMP-2 were analyzed by immunohistochemistry, immunoblotting and RT-PCR.Double stable MSCs line with low background expression and high Dox induced expression of AT2R gene was established successfully. Significant AT2R expression was observed after 48h of induction and further increased after 72h and remained stable over 8 weeks. Immunohistochemistry, immunoblotting and RT-PCR indicated that AT2R expression in the neointima was significantly upregulated in Dox group than in control group, MSC group and MSC transfection group (<0.01), but the expression of MMP-2 was significantly decreased in Dox group than in other groups (<0.01).AT2R expression at the site of carotid injury after transfection of our double-stable MSCs were well controlled by Dox. After Dox induces the high expression of AT2R, the expression of MMP-2 in neointima is decreased, which may be one of the mechanisms of regulating AT2R expression in injured vessels to prevent vascular restenosis.
AT2R; regulatable expression; mesenchymal stem cell; neointimal hyperplasia; matrix metalloproteinase
(No. 30400180)
R543.3
A
10.3724/SP.J.1264.2013.00055
2012-12-19;
2013-01-28
国家自然科学基金(No.30400180)
何国祥, Tel: 023-68754118, E-mail: yyxnk@yahoo.com.cn

