门脉癌栓兔模型的超声及CT影像表现
周明强刘长珠刘斯润罗超元王俊芳宁映霞
(1 广州医学院第一附属医院,广东 广州 510000;2 暨南大学附属第一医院,广东 广州 510000)
门脉癌栓兔模型的超声及CT影像表现
周明强1刘长珠2刘斯润2罗超元2王俊芳2宁映霞1
(1 广州医学院第一附属医院,广东 广州 510000;2 暨南大学附属第一医院,广东 广州 510000)
目的分析兔门脉VX2细胞株肿瘤模型的影像学表现,探讨超声及CT检查在监测门静脉癌栓中的价值。方法VX2肿瘤细胞株接种于兔大腿形成稳定的种植瘤,将瘤块接种于20只新西兰大白兔肝脏门静脉内,采用剖腹门脉穿刺及门脉切开两种方法建立门静脉癌栓模型,用超声及CT观察肿瘤的形成情况。结果超声显示肿瘤成活率90%(18/20),瘤株接种后12~15d可探及门脉癌栓,接种21~23d可显示瘤体血流情况。CT平扫瘤体呈低密度或等密度灶,增强扫描动脉期呈不均匀强化。结论超声可及时显示门脉癌栓形成情况,CT扫描能准确判断癌栓形成情况,综合影像学检测手段能够及时准确评价门脉癌栓动物模型的瘤灶生长情况,可为进一步的门脉癌栓治疗试验研究提供有用信息。
门静脉癌栓;兔模型;超声;CT
近几十年来肝癌的发病人数呈明显增加趋势,全世界每年约100万新发肝癌患者,但只有不到30%新发肝癌患者可行手术切除[1],约16%~59%患者确诊肝癌时已伴门脉癌栓(portal vein tumor thrombus,PVTT)[2],显微镜检门脉微小癌栓更是高达90.2%[3],这是肝癌切除及肝移植术后复发的主要原因,也是影响肝癌预后的主要因素[4]。目前PVTT临床上尚无有效的治疗方法,建立的理想的PVTT动物模型可为早期诊断、探索治疗方法以及疗效观察提供实验学基础。本文在摸索不同方法建立兔PVTT实验模型的基础上,进一步探讨兔PVTT实验模型彩超及CT检查的影像特点以及评价各自影像学监测价值。
1 资料与方法
1.1 模型的建立
①实验动物:纯种新西兰大白兔21只(广东省医学实验动物中心购得),雌雄不限,体质量2.5~3.2kg,3~4个月大小。②肿瘤细胞株:本实验采用VX2鳞状细胞癌,荷瘤兔由华西医科大学提供。③瘤株的传代:将从荷瘤兔上取下的VX2瘤块用眼科剪剪碎成瘤粒悬液,用注射器取1mL悬液注射于一只兔大腿内侧做好传代。④接种用瘤块的制备:将接种兔饲养2周左右采用速眠新肌内注射(0.2mL/kg)麻醉,无菌操作下剪取肿瘤中层鱼肉样组织,用眼科剪切成0.5mm3的瘤粒及1~2 mm3稍大瘤块,将组织置于生理盐水(50mL含庆大霉素2万U)中备用。⑤兔门脉接种:20只新西兰大白兔术前12h禁食不禁水,称重,选用氯胺酮为动物麻醉剂,按1mL/kg剂量计算,等量生理盐水稀释后,以总量的1/2从兔耳缘静脉推注,观察兔的反应及呼吸情况,余下部分可分次肌内注射或侧腹部做皮丘,控制好麻醉的深度和时间。将兔仰卧在手术台上固定,采取两种方法门脉接种,第一种方法门脉注射接种法:在上腹部备皮、消毒,在上腹正中剑突下作一长约3cm左右的切口打开腹腔暴露肝,找到门静脉主干将备好的肿瘤液注入门静脉。拔针后即用消毒干纱布按压穿刺处待血止住,逐层缝合关闭腹腔。第二种方法门脉切开接种法,由外科医师操作,将门脉主干两端用血管夹夹住,阻断门脉血流后,用注射器抽尽阻断部分血液,往内注射等量盐水,术野干净后切开门脉,迅速将2~3粒稍大的瘤块放入门脉内,用羊肠线缝合血管,松开血管夹,逐层缝合关闭腹腔。术后肌注青霉素20万U/d,连续3d。
1.2 超声观察方法
本次研究采用GE Logic-9彩超检查仪,探头频率6~9MHz,每天监测兔肝脏、门静脉内有无异常回声团及其数目、大小,同时观察肿瘤血供情况及肝外转移灶以及腹水情况。
1.3 CT观察方法
采用GE Highspeed FX/i螺旋CT机,对比剂为3mL欧乃派克+2mL生理盐水,0.3mL/s,在超声检查到门脉低回声团后行CT扫描,如若未扫到确定的癌栓,一周后行第2次CT扫描,观察VX2瘤细胞在兔门静脉内的生长情况,以、可能的肝内转移情况及腹水情况。
1.4 病理性检查
接种5周后处死实验兔,取兔门脉癌栓标本进行病理检查。
2 结 果
2.1 两种方法接种的成功率
门脉注射接种法:接种10只,成功9只,一只实验兔未出现门脉癌栓,成功率90%,癌栓出现时间18天左右。
门脉切开接种法:接种10只,成功9只,一只实验兔手术后第二天即出现腹水死亡,成功率90%,癌栓出现时间12d左右。
2.2 影像表现
超声表现:第一种方法瘤株接种18d左右,彩超在9只兔门静脉内可探查到低回声团块,瘤株局限于门静脉管腔分支内,数目1~2个,直径2~3mm,CDFI显示为门静脉管腔内血流充盈缺损。接种21~23d,团块数量增加到3~4个,直径增大为5~7mm,CDFI显示为门静脉增宽,管腔内充盈缺损、血流消失、血流束变细(如图1、图2)。接种4周后,门脉内肿瘤组织增大,直径为6~10mm,团块多为充满型,门静脉近端及主干内有明显癌栓形成,肝内可见转移灶,未见肝外转移,腹腔可探及游离液性暗区。第二种方法瘤株接种12d左右,彩超在9只兔门静脉主干内可探查到低回声团块,直径3~5mm,CDFI显示为门静脉管腔内血流充盈缺损。接种21~23d,团块直径增大为7~11mm,CDFI显示为门静脉增宽,管腔内充盈缺损、血流消失、血流束变细,门脉团块可显示动脉血流信息。接种4周后,门脉内肿瘤组织增大,直径为8~15mm,团块多为充满型,肝内可见转移灶,未见肝外转移,腹腔可探及游离液性暗区。
CT表现:超声检查发现门脉团块后行CT平扫,门脉内可见结节样低密度灶或等密度灶,直径3~16mm,动态增强扫描显示门脉期瘤灶呈低密度灶,动脉期瘤灶不均匀强化。
2.3 病理
镜下:癌细胞核大异型,核仁大,分裂相多(如图3)。

图1 超声显示门脉内低回声团
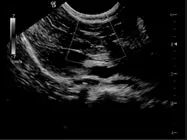
图2 彩超显示 门脉内血流充盈缺损

图3 兔门脉癌栓(HE染色×40)
3 讨 论
3.1 门脉癌栓动物模型的选择及兔模型的建立
移植性肝癌动物模型的制作多采用开腹后直接将VX2肿瘤块或VX2悬浮液移植于实验动物的肝实质内[5]。而要形成转移性门静脉癌栓其成瘤率很低,即使发生门静脉癌栓,由于肝内外多发转移,动物存活率低,不利于开展针对癌栓治疗的进一步研究。本实验选择门脉内直接种植,由于有门脉壁的阻挡,在成癌栓之前肝内转移机率小,其癌栓形成稳定可靠,伴随病理生理表现与人门脉癌栓相似,可作为肝肿瘤影像诊断、抗癌药物药代学、肿瘤治疗学的研究模型[6]。
作者在本实验中采用了门脉注射法及门脉切开法两种接种方法,其成功率均为90%,两者没显著差异性。但门脉注射法癌栓多形成于小的门脉分支内,主干内形成少,且形成时间较晚,分析原因可能是由于小的瘤粒门脉注射时,瘤粒在主干停留少,易停留在下一级分支或分叉附近,所以主干内形成少,主干内癌栓主要靠逆行扩散才能形成,周期也要长,故形成时间较晚。第二种方法采用门脉切开直接将稍大瘤块放置于门脉主干内,瘤块位于主干原位生长,瘤块较大,不易被门脉内血流带走到远处,生长速度较快,位置固定,故易在主干内形成癌栓。有关门脉内癌栓接种方法有多种,国内万智勇曾报道可采用B超引导下经皮门静脉穿刺种植法制备兔门静脉癌栓模型[7],作者采用彩超引导经皮门静脉穿刺实践了两例,未能取得满意效果,本人认为B超引导不如彩超好,且成功率不易控制,可能与兔门脉太细(正常兔门脉主干内径约3mm)、所用穿刺针及术者的穿刺技术水平有关。采用剖腹门脉虽然创伤要大,但是受影响因素少,易于掌握,只要术后控制好并发症即可取得满意的成功率。
3.2 门脉癌栓兔模型的超声和CT影像学观察
在处死模型兔做病理检查前,影像学检查是发现癌栓的唯一且有效的方法,在随后的癌栓治疗试验中,影像学检查也担任着疗效评估的角色。
超声,彩超可以显示门脉血流信息。本试验中由于兔门脉内癌栓为实性组织,声阻抗与兔肝组织相似,故超声表现为门脉无回声管腔内的低回声团块,彩超下由于癌栓的占位效应,相应部位门脉管腔狭小,对血流形成阻挡,故表现为血流的充盈缺损,血流束变细。由于试验兔种植后门脉出现癌栓的时间长短不一,生长的快慢也不一,需要反复观察监测,而超声具有实时、便利、快捷,且检查时兔无须做麻醉的优点,正好可用来反复观察,是监测试验癌栓模型兔的首选检查手段。
CT可在门脉横断面上显示出癌栓为低密度灶,增强扫描由于癌栓由动脉供血,故显示为动脉期强化,凭此刻准确判断门脉内癌栓的有无,对癌栓具有确诊的作用,另外CT分辨力较超声高,可以显示超声不能发现的较小的门脉癌栓,CT检查的缺点是但检查前须对兔实行麻醉,不易重复检查。
总之,兔门脉癌栓模型稳定、种植成活率高、与人肝癌合并门脉癌栓相似,超声及CT检查能够及时准确评价门脉癌栓模型的瘤灶生长情况,可为进一步的门脉癌栓治疗试验研究提供有用信息。
[1] Olthoff KM. Surgical option for hepatocellular carcinoma: resection and transplantation[J]. Liver Transpl Surg 1998,4(56 Suppl1):98-104.
[2] Treut PL, Hardwigsen J, Ananian P, et al. Resection of hepatocellular carcinoma with tumor thrombus in the major vasculature. A European case-control series[J]. J Gastrointe Surg 2006,10(6):855-862.
[3] 程树群,吴孟超.肝癌门静脉癌栓临床研究进展和展望[J].中国微创外科杂志,2007,7(1):6-7.
[4] Shah S, Tan J, Mcgilrray I, et al. Accuracy of staging as a predictor for recurrence after liver transplantation for hepatocellular carcinoma[J] . Transpl,2006,81(12):1633-1639.
[5] Du WH, Yang WX, Wang X,et al. Vascularity of hepatic VX2 tumors of rabbits: assessment with conventional power Doppler US and contrast enhanced harmonic power Doppler US [J]. World J Gastroenterol,2003,9(2):258-261.
[6] 牛焕章,滕皋军,邓钢,等.兔VX2肝癌模型的影像学表现和栓塞技术的实验研究[J].中国医学影像技术,2006,22(6):797-800.
[7] 万智勇,冯敢生,余宏建.兔移植性肝癌伴门静脉癌栓模型的制作[J].临床放射学杂志,2003,6(22):517-520.
R445
B
1671-8194(2013)16-0110-03
广东省卫生厅基金(编号:2008359)

