李斯特属细菌特征挥发性代谢物的鉴定分析
陈 雪,倪 鹏,喻勇新,潘迎捷,赵 勇,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.南通出入境检验检疫局,江苏 南通 226018)
2010年的食品安全问题中,由食源性致病菌引起的事件数和中毒人数分别占总数的36.82%和62.10%[1]。最近,在美国暴发李斯特属细菌(Listeria spp.)感染疫情,截至2011年10月2日,致17人死亡,84人染病。因此,对食源性致病菌的检测己迫在眉睫。微生物气味指纹技术作为一种快速、简便和无损的方法,在微生物的分类、鉴别和检测上的研究逐渐兴起。微生物在生长过程中利用了环境中的营养物质,在酶的作用下产生了挥发性代谢产物,由于个体不同,其代谢方式和途径也不尽相同,所释放的挥发性代谢产物的时间、数量、种类也有差别,这些差别构建了微生物的气味化学条码。此条码可以潜在的被用来作为微生物鉴定与检测的依据[2-3]。
近年来越来越多的研究者报道了基于气味指纹技术在微生物检测中的应用,但是系统的分析挥发性代谢产物鲜有报道。在国外,有学者对一些细菌所产生的类似马铃薯气味进行了研究[4];结合神经网络分析大肠杆菌的挥发性代谢产物[5];用手提式电子鼻系统识别了牛肉中培养的沙门氏菌[6];建立了一种快速预测包装的新鲜蔬菜中食源性致病菌的含量的方法[7]。比起细菌更早的是用于对真菌的研究[8-10]。在国内,气味指纹技术在微生物检测上的应用相对较少,仅用于分析一些细菌的代谢产物及特定物质的含量[11-14]。本实验室对气味指纹技术的研究以及在微生物检测上的应用具有一定的实验基础。实验人员通过电子鼻技术成功区分3种细菌(蜡样芽孢杆菌、单增李斯特菌、缓慢葡萄球菌)[15],且进一步对单增李斯特菌培养不同时间后的挥发性代谢产物进行了分析,发现该菌在生长8h后产生特有的挥发性物质[16];还对一株分离自南美白对虾的副溶血性弧菌与3株分离自猪肉中的假单胞菌进行研究。结果显示副溶血性弧菌经纯培养后,产生了明显区别于空白纯培养液的挥发性代谢产物;3株假单胞菌的挥发性代谢产物之间存在着差异,并列出相对应的特有物质[17-18]。以上结果均能证实气味化学条码可以被用来鉴定与检测微生物。
本实验采用气相色谱-质谱联用技术与电子鼻技术对5种常见李斯特属细菌的挥发性代谢产物进行了定性及相对定量的分析研究,得到5株细菌特有的气味化学条码,辅以电子鼻验证其区分结果。实验结果有望为今后微生物气味指纹库的建立提供数据支持,从而建立一种快速、简便、无损的食源性致病菌新型检测系统。
1 材料与方法
1.1 材料与仪器
脑心浸液肉汤(BHI,每升培养基中含有牛脑200.0g、牛心浸出汁250.0g、蛋白胨10.0g、葡萄糖2.0g、NaCl 5.0g、琼脂20.0g) 英国Oxoid公司;固相微萃取装置、萃取头(50/30μm DVB/CAR/PDMS) 美国Supelco公司。
GCMS-QP2010 Ultra气相色谱/质谱联用仪 日本岛津公司;Fox-4000 Sensory Array Fingerprint电子鼻(E-nose) 法国Alpha MOS公司。
1.2 样品处理
实验菌株如表1所示。
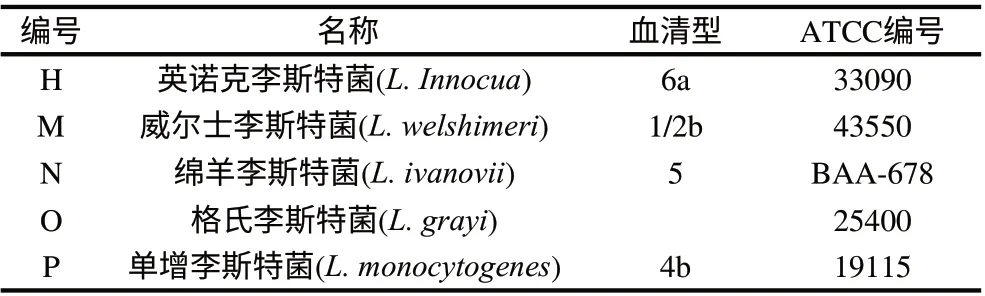
表1 实验菌株Table 1 Five species of Listeria
检测样品制备:将斜面保藏的菌种接种到8mL BHI液体培养基中,于37℃、180r/min的条件下摇床培养(种子液)备用。
GC-MS检测:取稀释一定梯度的1.5mL种子液于装有13.5mL液体培养基的40mL顶空样品瓶中,置于37℃、180r/min的条件下摇床培养8h,用于GC-MS检测,每组样品3个平行。
电子鼻检测:取20μL的种子液于装有2mL液体培养基的10mL顶空样品瓶中,置于37℃、180r/min条件下摇床培养8h,用于电子鼻检测,每组样品5个平行。
1.3 检测方法
1.3.1 固相微萃取进样
将培养后的样品瓶于37℃水浴振荡,用固相微萃取纤维头萃取35min后,纤维头插入进样口解吸5min进样。
1.3.2 色谱质谱条件
色谱柱:Rxi-5 Sil MS(30m×0.25mm,0.25μm);SPL进样口温度:250℃;不分流进样,进样时间:1min;柱温程序:30℃保持3min,以5℃/min升至160℃,再以13℃/min升至250℃;柱流量:1.0mL/min恒线速度方式;接口温度:280℃;离子源温度:230℃;采集方式:扫描m/z 30~400。
1.3.3 电子鼻条件
顶空样品进样(由进样器自动完成):加热箱温度37℃,振荡速度500r/min,每个样品加热600s;分析条件:以合成的干燥空气为载气,流速150mL/min,注射体积2.5mL,注射针温度47℃,注射针总体积2.5mL,注射速度2.5mL/s,获取时间120s,延滞时间600s[15-16]。
1.4 数据处理方法
利用Origin软件作图,并运用PAST软件中主成分分析法(PCA)与聚类分析法。
2 结果与分析
2.1 样品总挥发性代谢产物
5株菌的挥发性代谢物总离子流色谱图如图1所示。
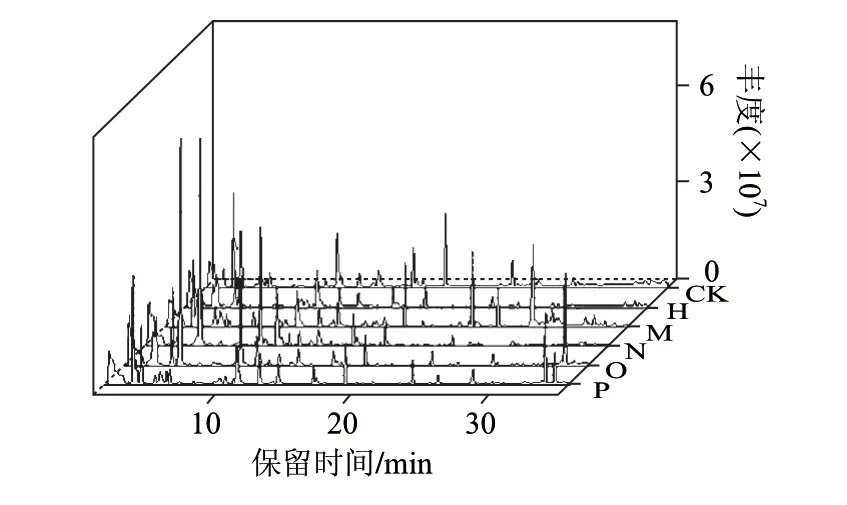
图 1 5种李斯特属菌挥发性代谢产物的总离子流图Fig.1 Total ion chromatograms of volatile compounds from five Listeria spp.
由图1可见,5种李斯特属细菌在原始色谱图上具有差异。通过计算其皮尔森系数(Pearson correlation coefficient)的绝对值,进一步比较5种菌的相关性,其绝对值越大表明相关性越强,结果见表2。除了格氏李斯特菌和绵羊李斯特菌的相关系数为0.810以外,其他菌株之间的相关系数均小于0.7,可见5株李斯特属细菌的色谱图存在着明显的差异。其中,格氏李斯特菌和威尔士李斯特菌之间的相关系数为0.373,两者的差异最为显著。
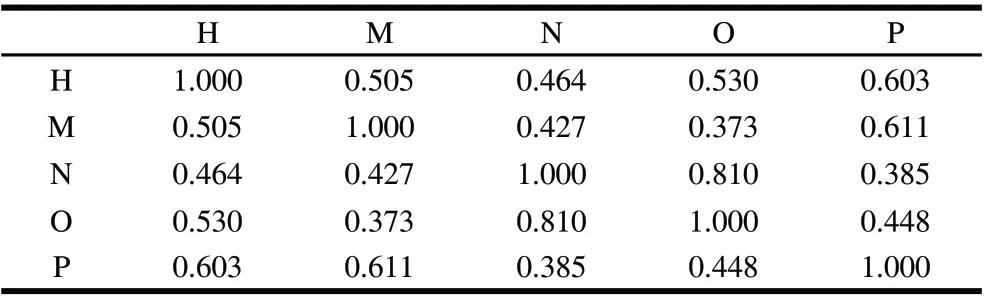
表2 5种李斯特属菌挥发性代谢产物的总离子流图相关系数表Table 2 Correlation coefficients for total ion chromatograms of volatile compounds from five Listeria spp.
实验中GC-MS检测的每个样品均有3个平行检测对象,通过计算平行色谱图的皮尔森系数绝对值,进一步评价试验结果的稳定性,所得平均皮尔森系数绝对值见表3。由表3可知,5个样品的平行色谱图彼此之间的相关性很高,均在0.890~0.946之间,即相似程度较高。由此可以推断由GC-MS测得的气味指纹重现性较好,具有形成区分、鉴定李斯特菌的气味条码的潜在能力。

表3 5种李斯特属细菌挥发性代谢产物的总离子流图平均相关系数表Table 3 Pearson coefficients for total ion chromatograms of volatile compounds from five Listeria spp.
通过质谱数据库检索,确定其化学组成。共得到115种物质,并应用峰面积归一化法测定了它们的相对含量,其结果见表4。挥发性成分:空白培养基检测出48种物质,英诺克李斯特菌检测出59种物质,威尔士李斯特菌检测出53种物质,绵羊李斯特菌检测出52种物质,格氏李斯特菌检测出52种物质,单增李斯特菌检测出67种物质。5株李斯特属菌培养后的挥发性代谢产物具有一定的差异。
2.2 样品间共有物质
在对6个样品的检测中,共得到的挥发性物质有11种。分别为2,3-丁二酮、2-丁酮、异戊醛、羟基丙酮、甲苯、2,5-二甲基吡嗪、甲氧基苯基肟、苯甲醛、2-羟基萘、十四烷、正二十烷。其中除去异戊醛、苯甲醛、十四烷、正二十烷4种物质较空白培养基的含量有增有减外,其他共有物质的含量均有增加。
在5种菌培养液的检测中,相对于空白培养基新产生的共有物质有6种。分别为乙醇、丙酮、3-羟基-2-丁酮、乙酸丁酯、3-甲硫基丙醛、6-丁基壬烷。
2.3 样品特有挥发性代谢产物
从生物分类学角度上比较,5株李斯特菌它们的遗传信息存在一定的差异,而这种差异可能使不同细菌对培养基分解能力出现差别,代谢途径不同从而造成其代谢产物不同。
在检测结果中也得到了每种菌培养后所独有的物质。英诺克李斯特菌特有物质:二硫化碳、D-樟脑、2,6-二叔丁基-4-甲基苯酚;威尔士李斯特菌特有物质:3,4-二甲基己烷、5-甲基癸烷、异十三醇、丁基壬烷、4-甲基十四烷、2-异丙基-5-甲基-2-庚醇、3-甲基十七烷、5-甲基-6-丙基壬烷;绵羊李斯特菌特有物质:反-2-庚烯-1-醇、1,3-二氢异苯并呋喃、苯乙醇、左旋樟脑;格氏李斯特菌特有物质:氯氟乙酰胺;单增李斯特菌特有物质:二甲基硫、3-甲基-2-(3-甲基-2-丁烯基)呋喃、3-甲硫基丙醇、3,9-二甲基癸烷、2-丙基-1-庚醇、10-甲基十九烷、9-己基十五烷。以这些物质成分的保留时间及相对含量为特征,形成5种常见李斯特菌特有的气味化学条码具有潜在可能性。
2.4 样品中主要成分及含量
在空白培养基中,挥发性成分中相对含量较高的10个化合物占所有化合物总含量的62.1%。分别是:氨基脲、乙酰肼、异戊醛、2,2,3,4-四甲基丁烷、二甲基二硫、2,3,3-三甲基戊烷、2,5-二甲基吡嗪、2-乙基吡嗪、苯甲醛、3-乙基-2,5-甲基吡嗪。
英诺克李斯特菌挥发性成分中相对含量较高的10个化合物占所有化合物总含量的55.88%。分别是:氨基脲、异丁醛、异戊醛、2-甲基丁醛、二甲基二硫、2,5-二甲基吡嗪、苯甲醛、乙醇、丙酮、3-羟基-2-丁酮。
威尔士李斯特菌挥发性成分中相对含量较高的8个化合物占所有化合物总含量的44.97%。分别是:异戊醛、二甲基二硫、2,5-二甲基吡嗪、苯甲醛、3,8-二甲基癸烷、正二十烷、6-丁基壬烷、2,3,4-三甲基戊烷。
绵羊李斯特菌挥发性成分中相对含量较高的10个化合物占所有化合物总含量的71.17%。分别是:异戊醛、醋酸、2,5-二甲基吡嗪、苯甲醛、3-乙基-2,5-甲基吡嗪、甲硫醇、乙醇、乙酸异戊酯、奥肼、异戊醇。
格氏李斯特菌挥发性成分中相对含量较高的10个化合物占所有化合物总含量的73.72%。分别是:异丁醛、异戊醛、2,5-二甲基吡嗪、苯甲醛、乙醇、乙酸异戊酯、奥肼、异戊醇、2-甲基丁醇、氯氟乙酰胺。
单增李斯特菌挥发性成分中相对含量较高的9个化合物占所有化合物总含量的50.3%。分别是:异戊醛、2-甲基丁醛、2,5-二甲基吡嗪、苯甲醛、乙醇、丙酮、DL-丙氨酰-L-丙氨酸、甲酸异丁酯、二甲基二硫。
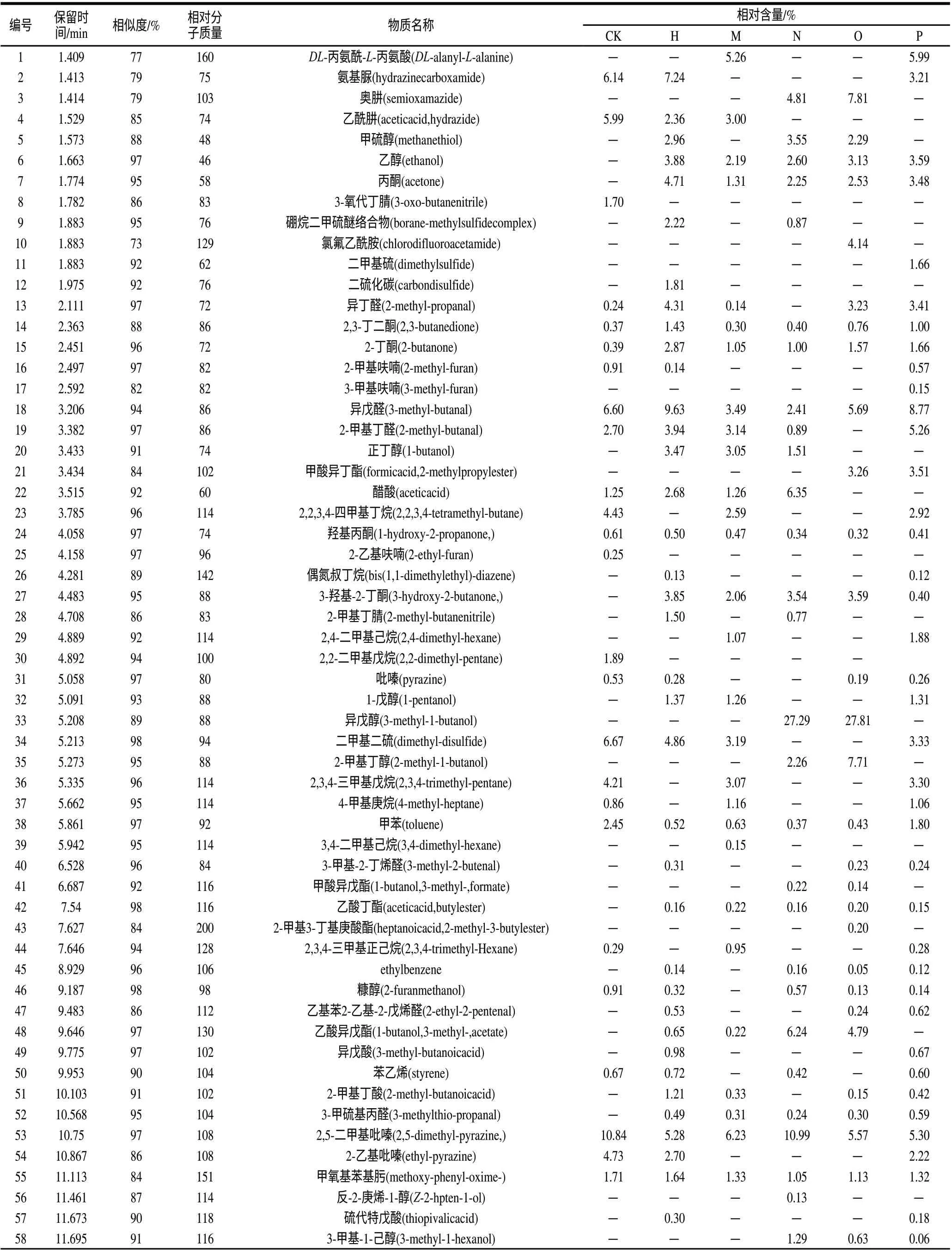
表4 5种李斯特属菌挥发性代谢产物的化学组成Table 4 Chemical compositions of volatile compounds of five Listeria spp.

续表4
2.5 电子鼻检测
通过电子鼻对样品气味的整体指纹信息进行统计学分析。电子鼻检测原始数据的主成分分析结果见图2。
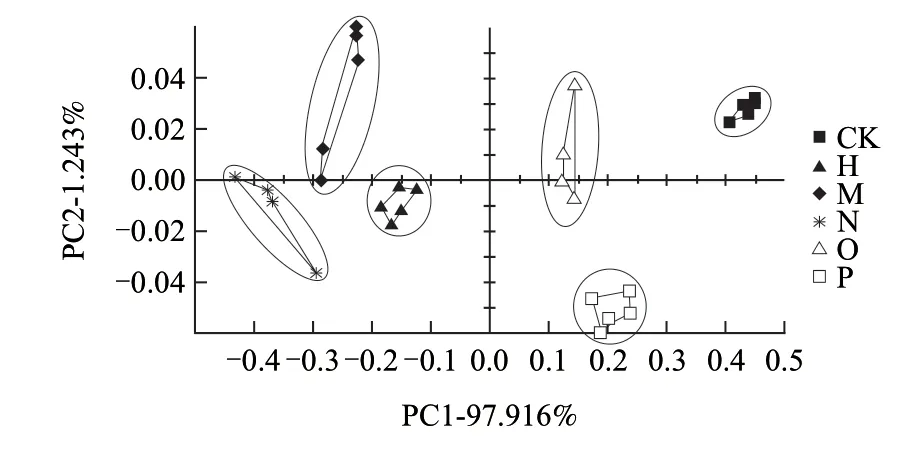
图 2 电子鼻检测结果Fig.2 Results of electronic nose detection
从图2可知,由于不同气体样本的物质组成不同,从而得到传感器不同的感应信号。通过仪器模式识别系统对样品气味的整体指纹信息进行统计学分析,电子鼻能够较好的区分5种李斯特菌,同时也说明了5种菌的挥发性代谢产物存在一定差异。图中5个平行能够聚集在一起,表明电子鼻具有较好的重复性。各组样品的整体气味之间存在差异,由于差异程度不同,样品之间又具有相似性。5种菌培养物的气味都能够与空白培养基(CK)的气味区分开,英诺克李斯特菌、威尔士李斯特菌的气味与绵羊李斯特菌的气味相近,区别于格氏李斯特菌、单增李斯特菌的气味。结果显示基于电子鼻的气味指纹技术能够很好的将5种李斯特菌区分。
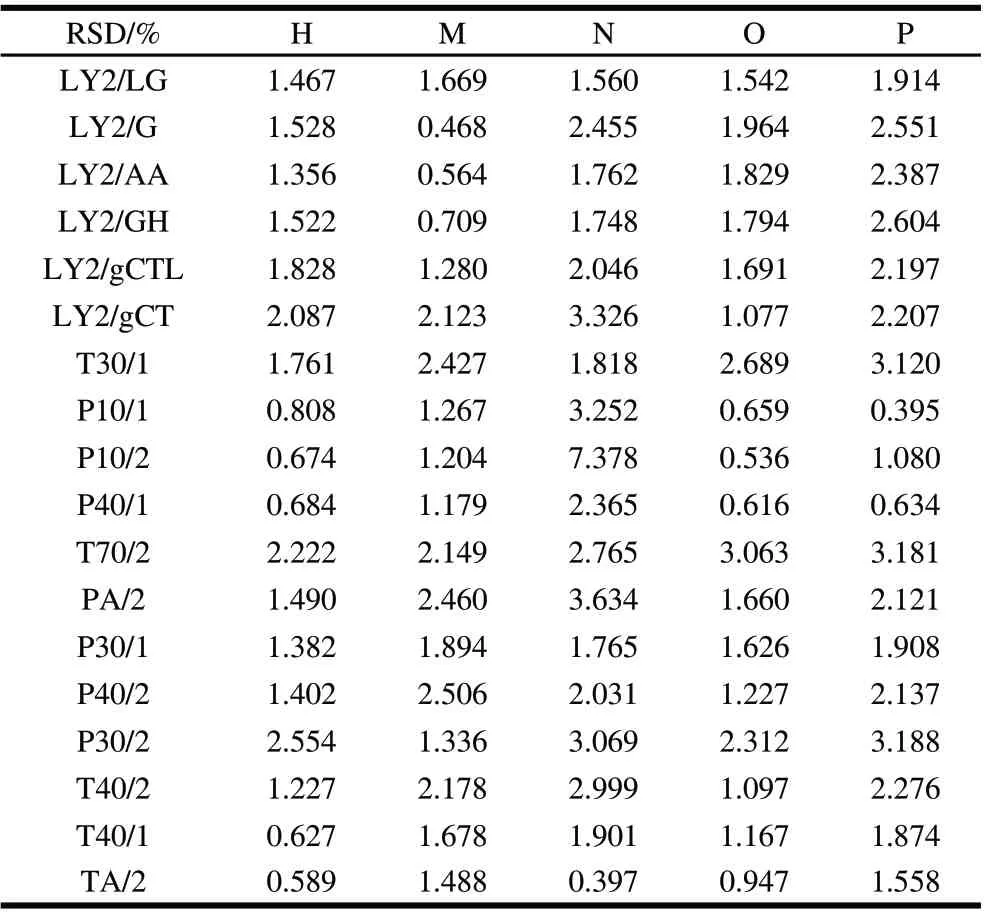
表5 电子鼻5次重复检测值的相对标准偏差Table 5 Relative standard deviation from five replicates of electronic nose detection
通过分析各样品5次重复、18根传感器检测值的相对标准偏差,见表5,RSD范围在0.395%~3.634%,5种样品的平均相对标准偏差分别为2.074%、1.400%、1.588%、2.571%、1.528%,表明传感器有良好的检测重复性。
2.6 样品间气味物质聚类分析
以6个样品的共有挥发性物质和培养后5种菌新产生的共有挥发性物质的种类以及相对含量做聚类分析,是利用样品间欧氏距离的相似性对样品空间进行分类,如图3所示。
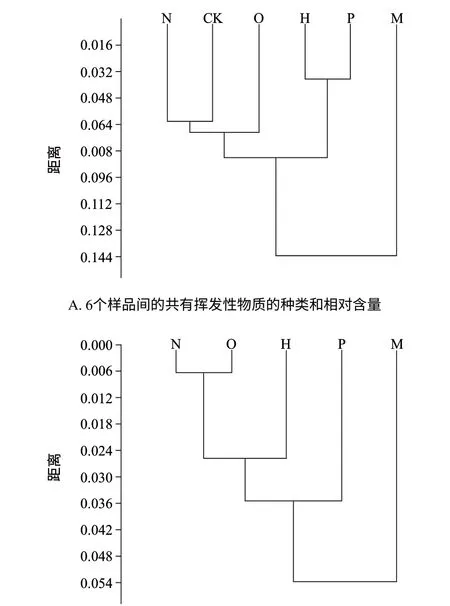
图 3 样品间的聚类图Fig.3 Cluster analysis of five Listeria spp. and relative contents of new volatile comounds common to their metabolites
从两部分图中均可得5种菌培养后的挥发性代谢产物存在差异性。在对6组样品的共有挥发性物质的种类和相对含量进行比较中(图3A),绵羊李斯特菌与格氏李斯特菌的气味相似;英诺克李斯特菌与单增李斯特菌的气味相似;而威尔士李斯特菌的气味明显区别于其他菌。在对5种菌培养后新产生的共有的挥发性物质的种类和相对含量进行比较中(图3B),绵羊李斯特菌与格氏李斯特菌的气味相似,其次是英诺克李斯特菌和单增李斯特菌;同样威尔士李斯特菌的气味明显区别于其他菌。从图3显示的欧式距离来看,根据共有挥发性物质的种类和相对含量能够更好的区分各个样品,而它们所形成的化学条码也更能体现各样品的特征。
为了比较6个样品间共有挥发性代谢产物的差异性,使用SPSS 17.0软件对数据进行方差分析。分析结果中所有P值均小于0.05。如表6所示,在对每一种挥发性化合物的比较上,样品间均有显著差异。表明以共有挥发性代谢产物形成的化学条码能够很好的体现出样品间的差异特征。说明此气味指纹有望成为区分、鉴定5种李斯特菌的化学条码。
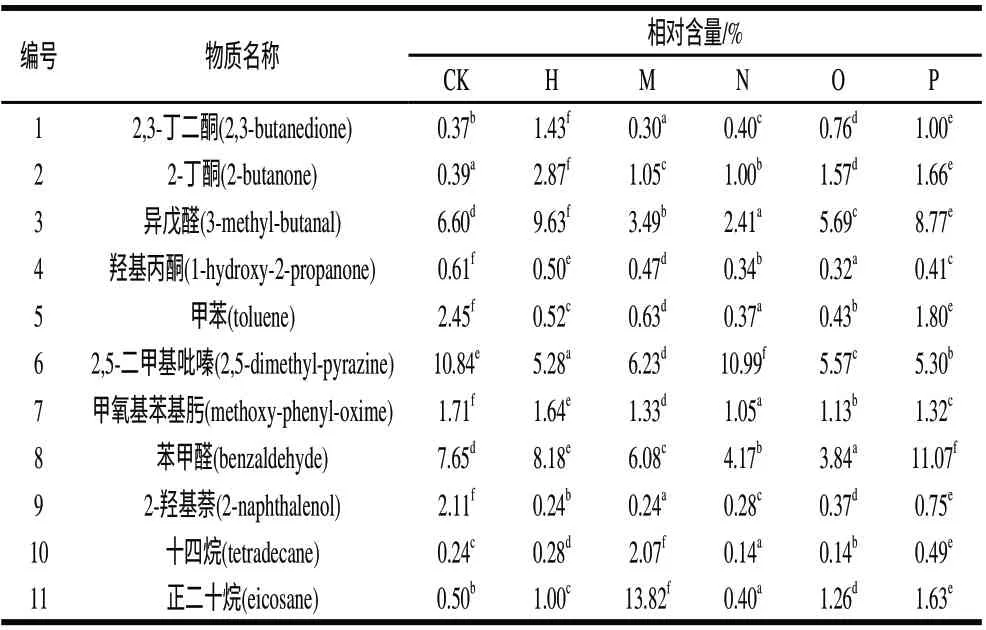
表6 5种李斯特属细菌共有挥发性代谢产物的相对含量Table 6 Contents of volatile compounds common to five Listeria spp.
3 讨 论
本研究所用的李斯特菌目前分为6个种,即单核细胞增生李斯特菌、英诺克李斯特菌、西尔李斯特菌、威尔士李斯特菌、绵羊李斯特菌和格氏李斯特菌,其中只有单增李斯特菌和绵羊李斯特菌有致病性[19]。单增李斯特菌是人蓄共患病病原菌[20],可以忍受较大范围的pH值、温度以及盐胁迫,可在4℃繁殖生长[21]。因此,加强食源性单增李斯特菌的检测及监测,势在必行。
据报道,除少数李斯特菌病爆发的案例与4a和4c血清型有关,大约有98%的李斯特菌病病例是由含1/2a,1/2b和4b这3种血清型的单增李斯特菌引起的,因此它们是引起人类疾病的主要血清型[20]。本研究得到了血清型为4b的单增李斯特菌与其他李斯特菌共有的挥发性代谢化合物及相对含量;形成的化学条码,有望用来做为单增李斯特菌鉴定的依据。且得到了其培养后特有的气味指纹化合物,形成了特有的化学条码(二甲基硫、3-甲基-2-(3-甲基-2-丁烯基)呋喃、3-甲硫基丙醇、3,9-二甲基癸烷、2-丙基-1-庚醇、10-甲基十九烷、9-己基十五烷)。还比较了样品的主要挥发性代谢物质种类与相对含量,完善了化学信息,可以为今后食源性致病微生物气味指纹库的建立提供数据支持。但是考虑到应用气味指纹技术进行鉴定、检测是一项正在探索中的研究,想要其具有实际的应用价值需要考虑到气味指纹的稳定性、重复性等。研究中得到主要信息来源于化学统计分析,并没有深入到分子层面。对拥有相同致病血清型的菌株之间的化学信息进行研究更具有意义。所以,在接下来的工作中将讨论气味指纹的稳定性与重复性,并对拥有相同病血清型的菌株进行指纹分析。
[1] Ministry of Health of The People’s Republic of China. Ministry of Health brief on the national food poisoning in 2010[EB/OL]. (2011-03-02)[2012-02-26]. http: //www. moh. gov. cn/publicfiles/business/htmLfi les/mohwsyjbgs/s8354/201103/50797. htmL.
[2] ANTHONY P F, TUMER N M. Electronic nose and disease diagnostics[J]. Nature Reviews, 2004, 2(2): 161-166.
[3] JOHAN S, JOHAN O, THOMAS B. Fungal volatiles as indicators of food and feeds spoilage[J]. Fungal Genetics and Biology, 1999, 27(2/3): 209-217.
[4] GALLOSIS A, GRIMONT P D. Pyrazines responsible for the potatolike odor produced by some serratia and cedecea strains[J]. Pyrazines Applied and Environmental Microbiology, 1985, 50(4): 1048-1051.
[5] SIRIPATRAWAN U, LINZ J E, HARTE B R. Neural network and electronic sensor array for determination of E. coli and volatile metabolites in nutrient media[J]. Analytica Chimica Acta, 2007, 581(1): 63-70.
[6] BALASUBRAMANIANn S, PANIGRAHI S, LOHUE C M, et al. Identification of Salmonella-inoculated beef using a portable electronic nose system[J]. Journal of Rapid Methods and Automation in Microbiology, 2005, 13(2): 71-95.
[7] SIRIPATRAWAN U. Self-organizing algorithm for classification of packaged fresh vegetable potentially contaminated with foodborne pathogens[J]. Sensors and Actuators B, 2008, 128(2): 435-441 .
[8] BORJESSON T, STOLLMAN U, SCHNURER J. Volatile metabolites produced by six fungal species compared with other indicators of fungal growth on cereal grains[J]. Applied and Environmental Microbiology, 1992, 58(8): 2599-2605.
[9] SCHNURER J, OLSSON J, BORJESSON T. Fungal volatiles as indicators of food and feeds spoilage[J]. Fungal Genetics and Biology, 1999, 27(2/3): 209-217.
[10] SUNESSON A L, VAES W H J, NILSSON C A. Identification of volatile metabolites from five fungal species cultivated on two media[J]. Applied and Environmental Microbiology, 1995, 61(8): 2911-2918.
[11] 乐长高, 谢宗波, 姜国芳, 等. 分析氧化硫硫杆菌培养液的挥发性成份[J]. 化学通报, 2004, 67(9): 1-3.
[12] 杨康, 岳田利, 袁亚宏, 等. 利用顶空SPME-GC-MS联用技术检测苹果汁中嗜酸耐热菌代谢产物的研究[J]. 农产品加工: 学刊, 2007, 94(3): 8-10.
[13] 吕均, 秦巧玲, 郭爱玲, 等. GC-MS 技术在鉴定食源性致病菌研究中的应用[J]. 食品科学, 2008, 29(2): 355-358.
[14] 陈列忠, 申屠旭萍, 陈建明, 等. 气相色谱/质谱法测定哈茨木霉菌代谢产物中单端孢霉烯化合物的含量[J]. 分析化学, 2007, 35(9): 1362-1364.
[15] 喻勇新, 刘源, 赵勇, 等. 基于电子鼻区分三种致病菌的研究[J]. 传感技术学报, 2010, 23(1): 10-13.
[16] 喻勇新, 孙晓红, 赵勇, 等. 应用电子鼻检测食源性致病菌的研究[J]. 化学通报, 2010, 70(2): 154 -159.
[17] 胡惠平, 刘源, 赵勇, 等. 应用电子鼻技术检测南美白对虾副溶血性弧菌试验[J]. 渔业现代化, 2009, 36(3): 41-48.
[18] 胡惠平, 潘迎捷, 赵勇, 等. 应用气味指纹技术检测猪肉假单胞菌[J]. 食品科学, 2009, 30(18): 327-332.
[19] HAIN T, STEINWG C, CHAKRABORTY T. Comparative and functional genomics of Listeria spp[J]. Journal of Biotechnology, 2006, 126(1): 37-51.
[20] LOW J C , DONACHIE W. A review of Listeria monocytogenes and listeriosis[J]. Veterinary Journal, 1997, 153(1): 9-29.
[21] CHAN Y C, WIEDMANN M. Physiology and genetics of Listeria monocytogenes survival and growth at cold temperatures[J]. Critical Reviews in Food Science and Nutrition, 2009, 49(3): 237-253.

