Oct4介导小鼠原代肝细胞去分化研究
郭恩凯,李 冰,申 晶,程 愈,郝好杰,韩庆旺,伍志强,韩为东,母义明
解放军总医院,北京 100853 1内分泌科;2基础医学所
Oct4基因是POU转录因子家族中的一员,主要表达于胚胎干细胞、生殖干细胞以及未分化胚胎癌中,也被称为Oct3、POU5F1,是诱导多能干细胞四个因子中的关键基因,被认为启动成体细胞重编程的“看门人”。在胚胎发育过程中,肝脏和胰腺具有同源性[1],和胰岛β细胞有相似的血糖反应性[2],以肝细胞作为重编程为胰岛β细胞的体细胞来源,具有潜在的应用前景。本实验通过构建含有Oct4的慢病毒表达载体,包装并浓缩病毒后感染小鼠原代肝细胞;Oct4介导肝细胞去分化,出现内胚层早期标记物(definitive endoderm marker)Sox17表达,为下一步向β细胞诱导分化奠定基础。
材料和方法
1 主要试剂 限制性核酸内切酶MluI和SalI、PrimeSTAR HS聚合酶、T4 DNA连接酶购自TaKaRa公司;普通PCR产物纯化试剂盒和小量质粒抽提试剂盒、DL2000、Taq DNA聚合酶、TOP10感受态购自天根生化科技有限公司;DMEM/F12培养基、Trizol、Knockout血清购自Invitrogen公司;反转录试剂盒购自Fermentas公司;肝细胞培养液购自ScienCell公司;William's Medium E、胶原酶Ⅳ购自Sigma公司;胎牛血清(fetal bovine serum,FBS)购自PAA公司;PEI购自Polysciences公司;PEG6000购自Merck公司;慢病毒载体pWPTGFP及质粒psPAX2 和pMD2G、小鼠胚胎干细胞cDNA、HEK293T细胞本实验室保存。
2 实验动物 C57BL/6小鼠,购于军事医学科学院实验动物中心,8~10周龄。
3 主要仪器设备 PCR仪(ABI公司);离心机(Eppendorf公司);电泳仪购(北京市六一仪器厂);凝胶成像系统1D(KodaK公司);台式恒温振荡器(江苏太仓市实验设备厂);恒温培养箱(上海市跃进医疗器械一厂);超净工作台(北京四达净化有限公司);细胞培养箱(贺利氏公司);相差显微镜(Nikon公司);荧光显微镜购自Zeiss公司。
4 小鼠肝细胞的分离和体外培养 小鼠原代肝细胞分离采用两步胶原酶灌流法[3],略加修改。用1%戊巴比妥麻醉小鼠,腹腔注射肝素抗凝后,固定并暴露肝脏,沿肝门静脉起始插入24G静脉留置针,连接20 ml注射器(装有37℃预热灌流液Ⅰ),同时剪断下腔静脉,按5ml/min缓慢推注,至流出液颜色与灌注液相同,换成灌流液Ⅱ(含有0.02%胶原酶Ⅳ)继续灌流,灌流完毕后仔细剪取肝脏并移至无菌培养皿中,灌流液Ⅱ清洗肝脏,制成肝细胞悬液,并经100μm尼龙滤网(BD公司),1 000 r/min离心5 min。用黏附培养基(包含Williams E medium,1%非必需氨基酸,10%胎牛血清)重悬肝细胞,台盼蓝染色,活细胞>90%,按6×105/孔接种在六孔板中,6~8 h后去除黏附培养基,换成肝细胞培养基。
5 Oct4慢病毒载体构建 根据NCBI发表的小鼠Oct4序列设计分别含有MluI和SalI酶切位点上、下游引物,上游引物在ATG起始密码子上游添加Kozak序列GCCACC,引物由英潍捷基(上海)贸易有限公司合成,引物序列如下:Forward:5'GAT CACGCGTGCCACCATGGCTGGACACCTGGCTTC3';Reverse:5'GATCGTCGACTCAGTTTGAATGCATGG GAGAGC3'。以小鼠ES细胞cDNA为模板进行PCR扩增。PCR反应程序为:98℃ 10 s,68℃ 2 min;循环扩增35次。扩增结束后产物进行电泳检测,胶回收后经MluI和SalI双酶切过夜,酶切后经PCR纯化试剂盒纯化去除内切酶。载体pWPT-GFP经MluI和SalI双酶切并回收载体片段,和Oct4酶切后的片段经T4 DNA连接酶16℃连接过夜,转化感受态大肠杆菌,涂氨苄抗性平板,37℃培养15 h,挑取单克隆扩增培养,抽取质粒进行酶切、测序鉴定,质粒命名为pWPT-Oct4。
6 病毒包装、浓缩及感染小鼠原代肝细胞 将pWPT-Oct4∶包装质粒(psPAX2)∶外壳质粒(pMD 2G)=4∶2∶1的比例转染293T细胞,收集48 h、72 h病毒上清液,0.45μm滤器过滤后,按2∶1的体积比添加3×病毒浓缩液(25.5% PEG6000,1.2mol/L NaCl)浓缩病毒上清液。pWPT-GFP质粒包装浓缩过程同pWPT-Oct4。梯度稀释后感染293T细胞,检测病毒滴度。按感染复数(multiplicity of infection,MOI)30感染已培养48 h的肝细胞,培养液中加入polybrene 8μg/ml,继续培养12 h后,吸去培养基,换成重编程培养基(包含DMEM/F12培养基,10%Knockout DMEM,1 mmol谷氨酰胺,1%非必需氨基酸,1%青霉素/链霉素,0.11 mmol β-巯基乙醇)。
7 RT-PCR法检测目的转录因子的表达 选取下列细胞分组:新鲜分离肝细胞(hepatocyte 0 d),二次感染Oct4慢病毒后3 d、7 d、12 d、18 d细胞(Oct4-3 d、Oct4-7 d、Oct4-12 d、Oct4-18 d), 感染GFP慢病毒18 d(GFP-18 d)和未感染同期培养18d的肝细胞(hepatocyte 18 d)。Trizol试剂提取细胞总RNA,逆转录合成cDNA并以其为模板进行PCR扩增。PCR引物参考NCBI上的mRNA序列利用Primer5软件设计(表1)。PCR扩增条件:94℃预变性4 min,94℃变性40 s,55℃退火40 s,72℃延伸40 s,30个循环。循环结束后,PCR产物经琼脂糖凝胶电泳后,在紫外灯下检测,凝胶成像系统分析。
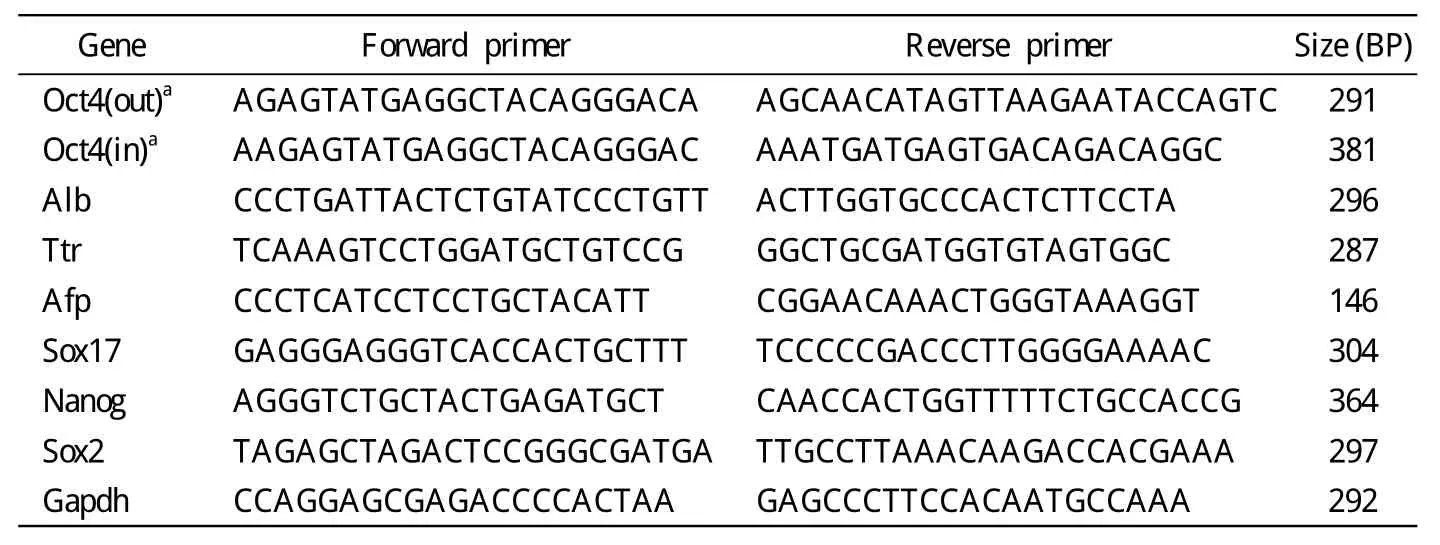
表1 RT-PCR引物信息Tab.1 Sequences of primers for RT-PCR
结 果
1 pWPT-Oct4表达载体鉴定 pWPT-Oct4质粒用MluI和SalI双酶切,1%琼脂糖凝胶电泳可见特异性Oct4(1059bp)扩增片段,与理论值相符(图1)。pWPT-Oct4表达载体经测序,构建的慢病毒载体基因序列与预期符合,证明成功构建表达载体。
2 Oct4在慢病毒感染细胞中表达 为了检测慢病毒的感染效率,采用含有绿色荧光蛋白(green fluorescent protein,GFP)的慢病毒感染肝细胞进行评测。GFP慢病毒感染肝细胞72 h后,在倒置的荧光显微镜上观察,可见绿色荧光,原代肝细胞感染效率>50%(图2)。在Oct4慢病毒感染后7 d、12 d、18 d的细胞中检测到Oct4的表达(图3)。
3 Oct4介导小鼠原代肝细胞去分化 为了检验Oct4介导小鼠原代肝细胞能否发生去分化,通过RTPCR检测了肝细胞相关转录因子的表达。Oct4慢病毒感染肝细胞后,白蛋白(Albumin,Alb)和转甲状腺素蛋白(transthyretin,Ttr)的表达逐渐下降;甲胎蛋白(alpha-fetoprotein,Afp)在新分离的肝细胞没有表达,在感染后3d检测到表达,进一步提示肝细胞去分化。
4 去分化细胞出现内胚层早期标记物的表达 为了进一步检测Oct4介导的肝细胞去分化后发育阶段的转录因子。Sox17在感染Oct4后第12 d、18 d检测到表达。而GFP-18 d和hepatocyte18d均未检测到Sox17的表达。感染Oct4后18 d后没有检测到Oct4、Sox2和Nanog的内源性表达,GFP18d组和hepatocyte18d组中也未出现Oct4、Sox2和Nanog表达。

图1 肝细胞相应转录因子的表达Fig.1 Expression of corresponding hepatocyte transcription factors
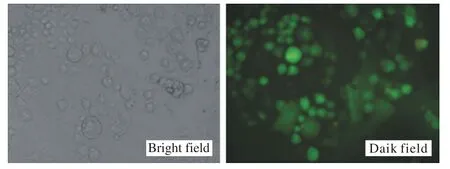
图2 慢病毒感染原代肝细胞效率Fig.2 Efficiency of lentivirus- infected primary liver cells(72 h after second infection)
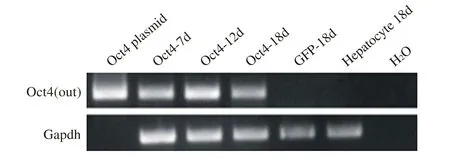
图3 外源性Oct4在细胞中表达Fig.3 Expression of exogenous Oct4 in liver cells
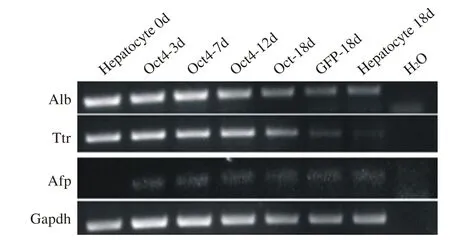
图4 肝细胞转录因子的表达Fig.4 Expression of liver cell transcription factors
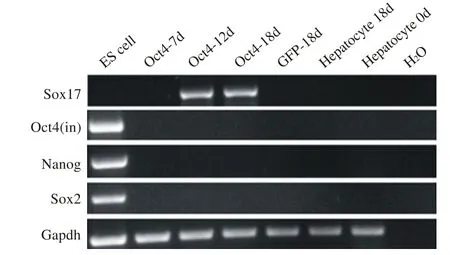
图5 检测Sox17和多能性因子的表达Fig.5 Expression of Sox17 and pluripotency factors in liver cells
讨 论
Oct4是迄今人们发现最早也是最重要的维持胚胎干细胞多潜能性和自我更新的关键基因。在鼠的体内试验中发现下调Oct4能使鼠神经干细胞分化[4],异位表达Oct4基因可以阻止鼠上皮祖细胞的分化,并且引起上皮细胞的异常增生[5]。本试验中Oct4慢病毒感染小鼠原代肝细胞,成熟的标记物Alb、Ttr表达逐渐降低,不成熟的标记物出现增强,在进一步的培养过程中,成熟的标记物和不成熟的标记物都逐渐减弱。肝细胞在体外培养的过程中会经历成熟肝细胞标记物的表达逐渐减弱,不成熟肝细胞标记物逐渐加强的去分化过程[6],但在感染Oct4慢病毒12 d后出现明确内胚层的标记物Sox17表达,而GFP-18d和hepatocyte18d组均未检测到Sox17的表达。
虽然Oct4介导小鼠成熟的肝细胞去分化,出现Sox17的表达,但是没有Oct4、Nanog及Sox2等多能性基因的内源性表达,所以Oct4介导小鼠原代肝细胞去分化没有到达多能状态。本实验研究的关键点是通过单独Oct4介导小鼠成熟的肝细胞去分化,实现内胚层早期标记物Sox17的表达。内胚层的形成是胰腺分化的一个先决条件,而Sox17作为转化生长因子β(TGF-β)超家族中的一员,在内胚层的形成过程中发挥重要作用[7-8],在体外将胚胎干细胞分化为产生胰岛素细胞的研究中,其也是分化过程中的关键转录因子[9]。
Oct4介导体细胞重编程的进一步研究,使人们对Oct4的功能有了更深入的了解。2010年,研究者利用单独Oct4介导成纤维细胞重编程,直接诱导为造血祖细胞,后者并联合小分子化合物分化为造血谱系终末细胞,为体细胞重编程提供了新路径[10]。本实验同样利用单独Oct4介导体细胞重编程,去除癌基因的整合,增加了重编程为目的细胞的安全性[11],并选择与胰岛β细胞具有相同发育起源的肝细胞作为体细胞的来源,表达内胚层早期标记物Sox17,为改变细胞谱系提供了前提,下一步实验将联合小分子化合物诱导分化功能性胰岛素产生细胞。
1 Deutsch G, Jung J, Zheng M, et al. A bipotential precursor population for pancreas and liver within the embryonic endoderm[J].Development, 2001, 128(6): 871-881.
2 Yang LJ. Liver stem cell-derived beta-cell surrogates for treatment of type 1 diabetes[J]. Autoimmun Rev, 2006, 5(6):409-413.
3 Li WC, Ralphs KL, Tosh D. Isolation and culture of adult mouse hepatocytes[J]. Methods Mol Biol, 2010, 633 :185-196.
4 Okuda T, Tagawa K, Qi ML, et al. Oct-3/4 repression accelerates differentiation of neural progenitor cells in vitro and in vivo[J].Brain Res Mol Brain Res, 2004, 132(1): 18-30.
5 Hochedlinger K, Yamada Y, Beard C, et al. Ectopic expression of Oct-4 blocks progenitor-cell differentiation and causes dysplasia in epithelial tissues[J]. Cell, 2005, 121(3): 465-477.
6 Meivar-Levy I, Sapir T, Gefen-Halevi S, et al. Pancreatic and duodenal homeobox gene 1 induces hepatic dedifferentiation by suppressing the expression of CCAAT/enhancer-binding protein beta[J]. Hepatology, 2007, 46(3): 898-905.
7 Shivdasani RA. Molecular regulation of vertebrate early endoderm development[J]. Dev Biol, 2002, 249(2): 191-203.
8 Jang YY, Sharkis SJ. Fetal to adult stem cell transition: knocking Sox17 off[J]. Cell, 2007, 130(3): 403-404.
9 D'amour KA, Bang AG, Eliazer S, et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells[J]. Nat Biotechnol, 2006, 24(11): 1392-1401.
10 Szabo E, Rampalli S, Risueño RM, et al. Direct conversion of human fibroblasts to multilineage blood progenitors[J]. Nature, 2010, 468(7323): 521-526.
11 Huangfu D, Osafune K, Maehr R, et al. Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2[J].Nat Biotechnol, 2008, 26(11):1269-1275.

