HPLC法快速定量测定硫酸长春新碱
袁 琦, 徐 玫, 赵 辉, 杨 浩
(河南大学药学院,河南开封 475004)
长春花为夹竹桃科植物长春花Catharanthus roseus的全草,迄今从中已经分离出70余种生物碱,其中对长春新碱和长春碱的应用最为广泛[1]。长春新碱是二聚吲哚类化合物,主要存在于长春花叶中,是临床常用的一种广谱抗肿瘤药,主要用于治疗急性淋巴细胞性白血病、霍奇金病和恶性淋巴瘤等[2]。
长春新碱为白色粉末,具有引湿性,遇光或热易变黄,2010年版《中国药典》(二部)用紫外分光光度法测定注射用硫酸长春新碱粉针剂[3]。目前随着各种新剂型的不断出现,其所用辅料的不断变化,可能会对紫外分光光度法定量测定造成一定的干扰。而高效液相法由于其分离效能高,灵敏度好等优点,可用于硫酸长春新碱类制剂的定量测定[4-10]。本实验研究了利用高效液相色谱法测定注射用硫酸长春新碱粉针剂的条件。
1 仪器与材料
1.1 仪器 Waters—e2695高效液相色谱仪 (Waters公司),Waters—2489可变波长紫外检测器 (Waters公司),UV—1600型紫外可见分光光度计 (北京瑞利),BP—211D电子天平 (德国Sartorius)。
1.2 试剂及样品 甲醇为色谱纯,水为二次重蒸水,其他试剂均为分析纯。粉针剂硫酸长春新碱 (广东岭南制药有限公司);硫酸长春新碱对照品 (中国药品生物制品检定所,纯度97.5%)。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液的制备 精密称取硫酸长春新碱对照品1.024 4 mg,加流动相定量稀释至5.0 mL,摇匀,作为对照品溶液,用前新鲜配制。
2.1.2 供试品溶液的制备 取硫酸长春新碱粉针剂1瓶,精密称定,加流动相1 mL溶解转入5 mL量瓶,并用流动相多次洗涤容器,洗液并入量瓶中,稀释至刻度,摇匀,既得。
2.2 色谱条件选择
2.2.1 检测波长的选择 取一定质量浓度的硫酸长春新碱标准溶液 (溶剂为流动相),以流动相作为参比,于190~340 nm波长范围内扫描。由紫外图可知,硫酸长春新碱在220 nm、240 nm和297 nm波长有三个吸收峰[11]。为了避开干扰峰的影响,本实验选择297nm作为检测波长。
2.2.2 色谱条件 以Hypersil C18(4.6 mm×250 mm,5 μm)为色谱柱,甲醇-乙腈-0.5%三乙胺水溶液 (20∶20∶60,以冰醋酸调节pH=3)为流动相,体积流量1.0 mL/min,检测波长为 297 nm,进样量 20 μL,柱温25℃。
2.2.3 系统适用性实验 分别取对照品溶液和供试品溶液,按2.2.2项下色谱条件进样,得图1。由图1可知,硫酸长春新碱能够完全分离,无相邻色谱峰干扰,峰形良好,理论塔板数按硫酸长春新碱色谱峰计算不低于5 000。
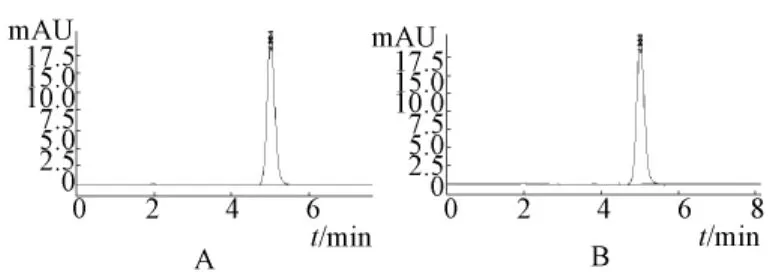
图1 硫酸长春新碱溶液的色谱图
2.3 方法考察
2.3.1 精密度 吸取对照品溶液,重复进样6次,记录峰面积,RSD为0.05%。
2.3.2 重复性 取同一批次硫酸长春新碱粉针剂 (批号090803),按2.1.2项下制备供试品溶液6份,进样,以外标法计算,硫酸长春新碱测定结果的RSD为0.08%。
2.3.3 稳定性 按2.1.2项下方法配制供试品溶液,分别于溶解后10 min、20 min、30 min、1 h、2 h、3 h、4 h、5 h、6 h进样,测定硫酸长春新碱的峰面积,其结果见表1。
由结果可知,药品在前4 h,峰面积逐渐减小,4 h后趋于平稳。说明硫酸长春新碱溶液不稳定,易发生变化。但在前30 min,峰面积变化较小,即硫酸长春新碱溶液在最初的30 min基本稳定,可用于定量测定。
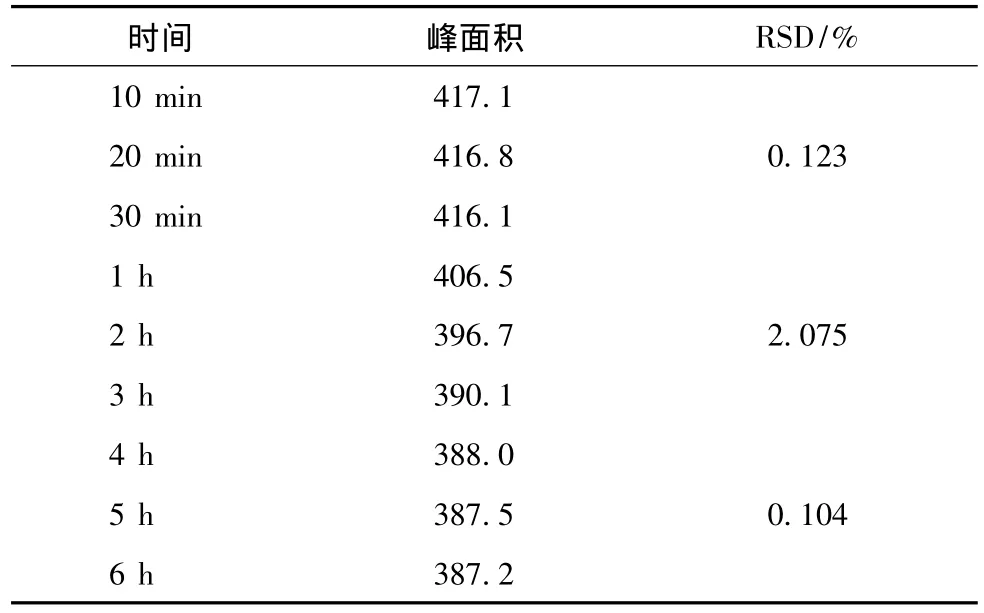
表1 药品稳定性
2.3.4 线性范围 精密称取硫酸长春新碱对照品1.994 4 mg,加甲醇定量溶解,配制成 398.88、299.16、199.44、99.72、49.86 μg/mL的溶液,各取20 μL进样。以色谱峰面积为纵坐标,以溶液中硫酸长春新碱的质量浓度为横坐标,回归方程为Y=2.300 6X+2.385 7,R2=0.998 2。结果表明,硫酸长春新碱在49.86~398.88 μg/mL范围内与峰面积呈良好线性关系。
2.3.5 加样回收率试验 取9个10 mL量瓶中,分别精密加入已知质量浓度供试品溶液4.0 mL,再分别加入3.0、4.0、5.0 mL对照品溶液,用甲醇稀释至刻度,摇匀,制备低、中、高3种质量浓度的供试品溶液,每个质量浓度制备3份样品。按样品测定项下方法测定,计算回收率,结果见表2。
实验结果表明,硫酸长春新碱的平均回收率为101.28%,RSD为0.471%,本法具有良好的回收率。
2.4 样品测定 取不同批号的硫酸长春新碱粉针剂,每批取3份,按2.1.2项下方法制得供试液,每份样品进样2次,测得的峰面积代入回归方程计算,结果见表3。
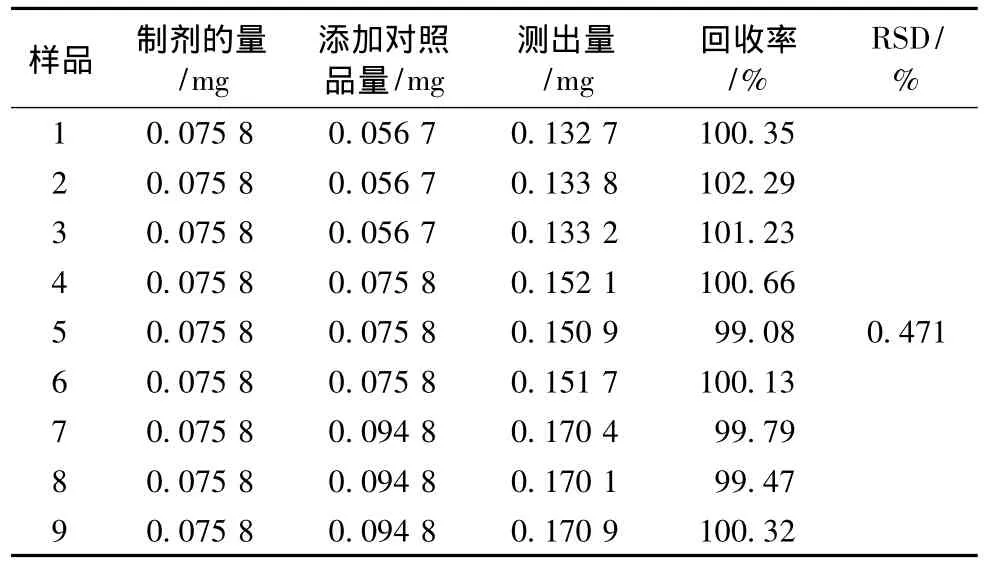
表2 样品回收率实验

表3 硫酸长春新碱粉针剂的测定结果 (n=3)
3 讨论
3.1 稳定性 图2为长春新碱的化学结构图,由图可知,长春新碱分子中具有3个酯键,在溶液中受到氢键作用,易发生解离,所以长春新碱的稳定性较差,为了测定结果的准确性,应选择较快速的测定方法,如《中国药典》采用UV法测定硫酸长春新碱粉针剂的量[3]。通过稳定性实验发现,在溶液配制最初的30 min内,峰面积随时间变化较小,随后变化逐渐增大。推断可能是由于氢键对酯键的破坏是需要一定的能量累积,所以在最初的30 min内长春新碱基本无变化。为了证实这一推断,又考察了硫酸长春新碱溶液在220 nm处的稳定性,得图3。由图3可以明显发现,在最初阶段,基本无分解产物的色谱峰,随时间延长,分解产物的色谱峰逐渐增大,与本实验的推断相符。而到4 h基本稳定时,分解产物总的峰面积与硫酸长春新碱的峰面积比为3.3%,未超出《中国药典》中规定5%的杂质最大允许量[3],说明氢键对酯键的解离作用,不影响硫酸长春新碱粉针剂的用药安全性。
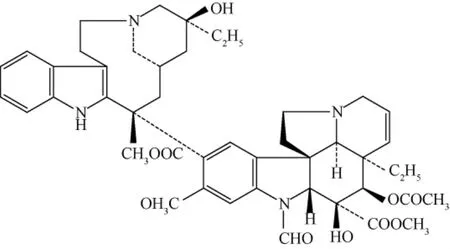
图2 长春新碱的化学结构
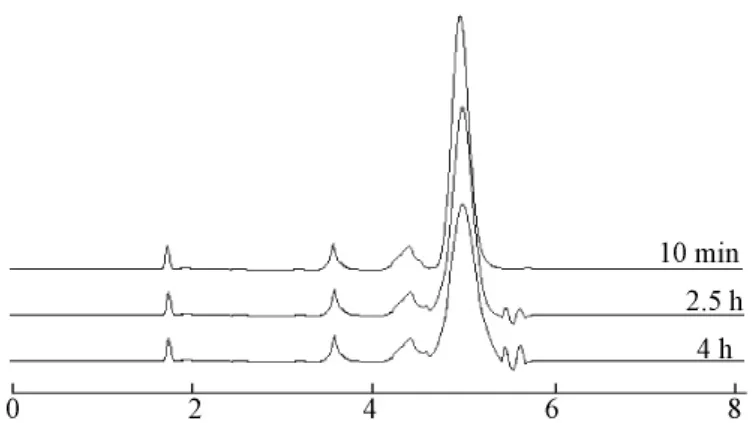
图3 硫酸长春新碱溶液在220 nm的色谱图
3.2 检测波长的选择 由硫酸长春新碱对照品的紫外吸收光谱可知,硫酸长春新碱在220 nm、240 nm和297 nm波长处有3个吸收峰,其中220 nm处吸收峰最大。分别以这3个检测波长,进样测定。发现以297 nm为检测波长,样品基本无干扰峰,说明干扰组分在297 nm无吸收,所以选择297 nm为检测波长。
3.3 流动相的选择 文献报道中利用HPLC法测定硫酸长春新碱,流动相多采用甲醇-磷酸盐系统[12-13]。由于硫酸长春新碱分子中含有4个N杂环,具有较强的碱性,易产生拖尾。在选择流动相时,分别考查了不同的流动相,以0.04 mol/L磷酸缓冲液-甲醇 (60∶40,pH=3)和0.5%三乙胺-甲醇 (60∶40,冰醋酸调pH为3)为流动相,硫酸长春新碱色谱峰均有不同程度的拖尾,故采用0.5%三乙胺-甲醇-乙腈 (60∶20∶20,冰醋酸调pH为3)为流动相。
[1]李妍妍.生物碱抗肿瘤研究进展[J].中成药,2008,30(6):907-909.
[2]卢 懿,侯世祥,等.透皮淋巴靶向长春新碱传递体[J].药学学报,2007,42(10):1097-1101.
[3]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:963-964.
[4]Gauvin A,Pinguet F,Poujol S,et al.High-performance liquid chromatographic determination of vinorelbine in human plasma and blood:application to a pharmacokinetic study[J].J Chromatogr B Biomed Sci Appl,2000,10(2):389.
[5]Robieux,Vitali V,Aita P,et al.Sensitive high performance liquid chromatographic method with fluorescence detection form easurement of vinorelbine plasma concentrations[J].J Chromatogr B Biomed Appl,1996,12(1):183.
[6]Leveque D,Jehl F.Determination of vinorelbine in biological fluids by high-performance liquid chromatography[J].J Chromatogr B Biomed Appl,1995,20(2):314.
[7]Debal V,Morjani H,Millot J M,et al.Determination of vinorelbine(navelbine)in tumour cells by high-performance liquid chromatography[J].J Chromatogr,1992,2(1):93.
[8]Van Tellingen O,Kuijpers A,Beijnen J H,et al.Bio-analysis of vinorelbine by high-performance liquid chromatographywith fluorescence detection[J].J Chromatogr,1992,17(2):328.
[9]Ragot S,Sauvage F L,Rousseau A,et al.Sensitive determination of vinorelbine and its metabolites in human serum using liquid chromatography-electrospray mass spectrometry[J].J Chromatogr B Biomed Sci Appl,2001,5(2):167.
[10]Mouchard-Delmas C,Gourdier B,Vistelle R.Determination of vinorelbine in rabbit plasma by high-performance liquid chromatography with coulometric detection[J].J Chromatogr B Biomed Appl,1995,20(2):390.
[11]袁 琦,徐 玫,等.紫外分光光度法测定硫酸长春新碱的含量[J].河南大学学报:医学版,2011,30(4):239-244.
[12]孙 勇,张其清,等.反相高效液相色谱法测定硫酸长春新碱的含量[J].中国药房,1999,10(6):274-275.
[13]赵 妍,于 彬,等.主动载药法制备硫酸长春新碱脂质体及其包封率的测定[J].中国药学杂志,2005,40(20):1559-1562.

