IRE1α重组腺病毒载体对ATDC5软骨干细胞增殖及凋亡的影响
李祥柱,张鹏,韩晓凤,李美玲,夏飞,郭风劲
IRE1α(type Ⅰ transmembrane protein kinase/endoribonuclease)是内质网上的一种跨膜蛋白,为具有激酶(kinase)和核糖核酸内切酶(RNase)活性的双功能酶。细胞处于内质网应激(endoplasmic reticulum stress,ERS)时,可诱导IRE1α的内质网腔侧结构域发生二聚化,激活胞质的蛋白激酶域,发生自身磷酸化[1],进一步激活特定位点羧基末端具有核糖核酸内切酶活性的RNase结构域,从而剪切一种重要的转录因子XBP1(X-box binding protein 1)[2]。这种非经典的mRNA剪接方式会引起一种称作未折叠蛋白反应(unfolded protein response,UPR)的转录过程,该过程可缓解内质网应激压力。有关IRE1α如何活化,以及如何调控UPR信号以确保充分的内质网应激反应目前尚未明确。为此,本研究构建了含全长IRE1α的腺病毒载体和一个缺少氨基末端和部分膜旁Linker区域的截短体,该突变体能够自我联合且在非应激条件下不能与结合免疫球蛋白(binding immunoglobulin protein,BiP)结合。本研究观察上述两个重组腺病毒载体对软骨干细胞ATDC5增殖和凋亡的影响,为进一步探讨IRE1α的生物学功能奠定基础。
1 材料与方法
1.1 主要材料 真核表达载体质粒pcDNA3.l(-)-IRE1﹑pcDNA3.l(-)-R+K由本实验室构建并保存[3],穿梭质粒pAdTrack-CMV﹑腺病毒骨架质粒pAdEasy-1﹑大肠埃希菌BJ5183株﹑软骨干细胞ADTC5由本实验中心保存。PmeⅠ﹑PacⅠ购自NEB公司;T4DNA连接酶为美国Promega公司产品;XholⅠ﹑HindⅢ内切酶及DNA回收试剂盒为大连宝生物(TaKaRa)公司产品;质粒小量提取试剂盒为Omega公司产品;脂质体为Invitrogen公司产品。引物合成由大连宝生物(TaKaRa)公司完成。
1.2 IRE1α重组腺病毒载体的构建
1.2.1 含IRE1α基因的重组穿梭质粒的构建 用XholⅠ/HindⅢ双酶切经测序鉴定构建成功的真核表达载体pcDNA3.l(-)-IRE1﹑pcDNA3.l(-)-R+K,获取IRE1α基因全长和具有RNase+Kinase两个核心结构域的截短体片段,克隆至同样经XholⅠ/HindⅢ双酶切的腺病毒载体pAdTrack-CMV中,得到重组腺病毒穿梭质粒pAdTrack-IRE1α﹑pAdTrack-R+K。
1.2.2 重组腺病毒质粒的构建 将经PmeⅠ线性化的重组穿梭质粒pAdTrack-IRE1α﹑pAdTrack-R+K分别与腺病毒骨架质粒pAdEasy-1通过电转法进行同源重组并转入BJ5183感受态大肠埃希菌,经卡那霉素筛选后挑取最小的克隆提取质粒,经琼脂糖凝胶电泳进行初筛,然后用PacⅠ酶切鉴定重组子。将鉴定正确的重组腺病毒质粒转化感受态细胞DH5α,挑取克隆扩增,大量提取质粒保存。
1.2.3 重组腺病毒颗粒的包装 用PacⅠ酶切线性化重组质粒pAd-IRE1α﹑pAd-R+K,通过Lipofectamine 2000转染HEK-293细胞。培养2d后在荧光显微镜下观察绿色荧光蛋白(GFP)的表达。继续培养7~10d后收集HEK-293细胞及上清,反复冻融裂解细胞4次,离心收集含重组腺病毒pAd-IRE1α﹑pAd-R+K的上清。取含重组腺病毒的上清,重新感染HEK-293细胞以扩增重组腺病毒。
1.2.4 重组腺病毒Ad-IRE1α﹑Ad-R+K目的基因的鉴定 取5 μ l病毒上清液,加入1 0 μ l蛋白酶K,55℃消化1h,煮沸5min,离心后取1~2μl稀释后进行PCR反应验证重组腺病毒基因组中是否含有I R E 1 α基因。上游引物5'-ATCTGGGGTGCCTGGCACAGAA-3',下游引物5'-AAGCTTTTTGAGCACATGCTTCGCTG-3'。1.2.5 ATDC5细胞最佳感染复数(MOI)的测定将收集到的病毒用GFP阳性细胞计数法进行滴度测定[4]。取病毒上清,按MOI 0﹑1﹑2﹑5﹑10﹑25分别感染ATDC5细胞,48h后荧光显微镜下观察GFP表达情况。采用GFP阳性细胞计数法粗略估计病毒上清中病毒颗粒的数量,Ad-GFP病毒滴度约为5×104U/ml,Ad-IRE1α﹑Ad-R+K病毒滴度均为1.5×104U/ml。
1.3 IRE1α重组腺病毒对ATDC5细胞增殖和凋亡的影响
1.3.1 IRE1α重组腺病毒对ATDC5细胞增殖的影响取对数生长期ATDC5细胞接种于6孔板,待细胞融合率达60%~80%时分别转染腺病毒空对照质粒pAd-GFP﹑重组腺病毒质粒pAd-IRE1α和pAd-R+K,并设立未处理的阴性对照组(NC),每个实验组设2个复孔,重复3次。一批样本24h后加入终浓度为5μg/ml的衣霉素(tunicamycin,TM)处理24h,另一批不用TM处理。收集各组细胞,用1ml预冷的70%乙醇溶液固定18~24h后,加入等体积的PI染液混合,4℃放置20~30min,尼龙膜过滤,流式细胞仪测定各组细胞周期情况(由重庆医科大学生命科学院完成)。
1.3.2 IRE1α重组腺病毒对ATDC5细胞凋亡的影响取对数生长期ATDC5细胞接种于6孔板,待细胞融合率达60%~80%时分别转染腺病毒空对照质粒pAd-GFP﹑重组腺病毒质粒pAd-IRE1α和pAd-R+K,并设立未处理的阴性对照组(NC),每个实验组设2个复孔,重复3次。24h后加入终浓度为5μg/ml的TM处理24h。收集各组细胞,PBS洗涤2次,应用流式细胞仪以Annixin PE法检测各组细胞凋亡情况(由重庆医科大学生命科学院完成)。
1.4 统计学处理 采用SPSS 10.0软件进行统计分析,数据结果以±s表示,组间比较采用多因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 IRE1α腺病毒载体的构建
2.1.1 重组腺病毒载体的鉴定 电泳结果显示,XholⅠ/HindⅢ双酶切片段数目和大小与预期相符(图1A),证实重组腺病毒穿梭质粒pAdTrack-IRE1α和pAdTrack-R+K构建成功。经Pac Ⅰ酶切后,重组腺病毒质粒pAd-IRE1α出现1条约30kb的大片段和1条约3.0kb的特征性小片段,重组腺病毒质粒pAd-R+K出现1条约30kb的大片段和1条约4.5kb的特征性小片段(图1B),表明穿梭质粒和骨架质粒同源重组成功。
2.1.2 重组腺病毒颗粒的包装 重组腺病毒质粒pAd-IRE1α﹑pAd-R+K转染HEK-293细胞后的第2天,荧光显微镜下即可观察到部分细胞呈现绿色荧光,随着时间延长,表达GFP的细胞增多,荧光加强,表明HEK-293细胞中存在病毒的包装和扩增。转染4d后细胞呈现彗星状的腺病毒病灶,6~8d后可观察到细胞病变(CPE),大部分包装细胞变圆﹑脱落(图2)。
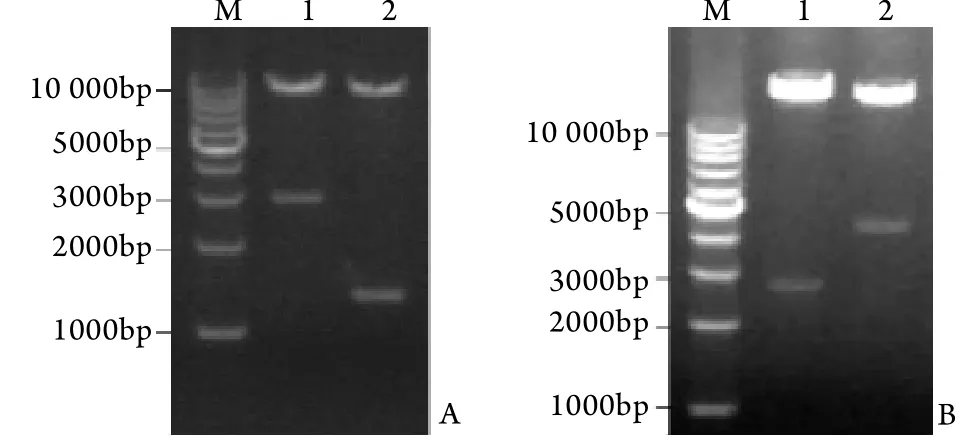
图1 重组腺病毒质粒的构建Fig.1 Construction of recombinant adenovirus vector
2.1.3 重组腺病毒的鉴定 PCR鉴定结果证实重组腺病毒Ad-IRE1α﹑Ad-R+K基因组中均含有目的基因,电泳显示为307bp的单一条带(图3),表明重组腺病毒中含有IRE1α基因。
2.1.4 ATDC5细胞MOI的测定 将收集到的病毒上清按MOI为0﹑1﹑2﹑5﹑10﹑25分别感染ATDC5细胞,48h后荧光显微镜下观察GFP的表达,结果显示ATDC5细胞的最佳MOI为15。
2.2 IRE1α重组腺病毒对ATDC5细胞增殖和凋亡的影响
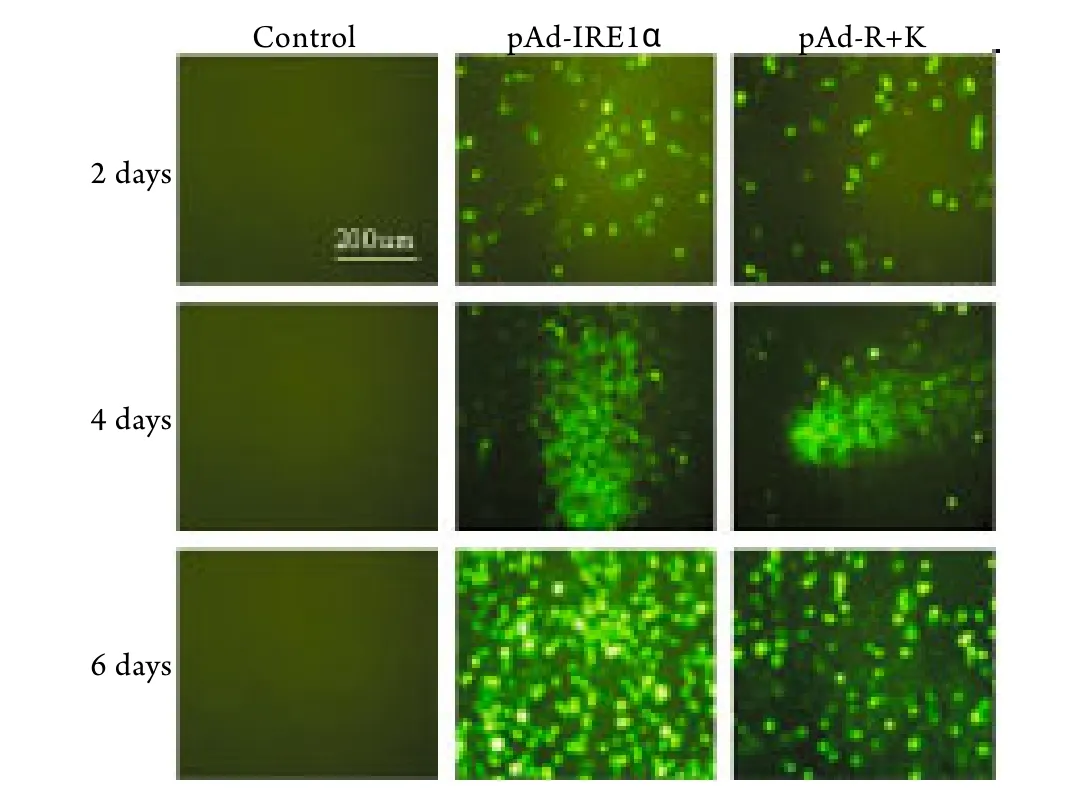
图2 重组腺病毒颗粒的包装Fig.2 Packed recombinant adenovirus particles
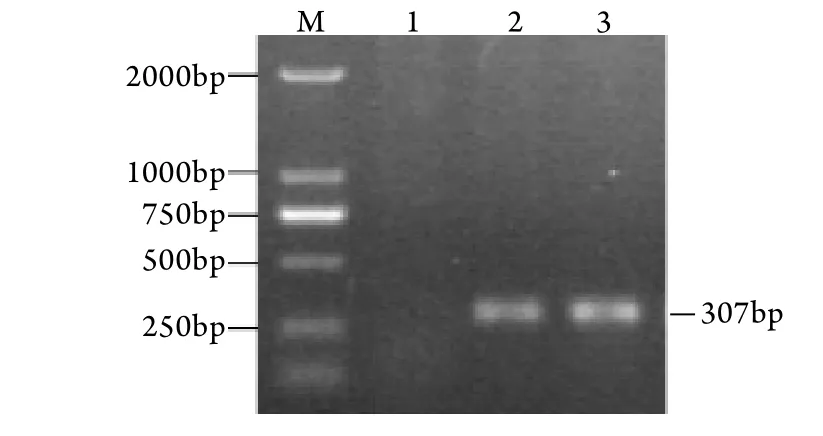
图3 重组腺病毒的PCR鉴定Fig.3 PCR products of recombinant adenovirus
2.2.1 IRE1α重组腺病毒对ATDC5细胞增殖的影响 流式细胞仪检测结果显示,在无TM处理条件下,各组细胞周期无显著差异(P>0.05),而在TM刺激诱导ERS条件下,Ad-IRE1α﹑Ad-R+K组ATDC5细胞G1期比例(分别为60.72%﹑56.40%)明显低于NC组﹑Ad-GFP对照组(分别为73.52%﹑74.95%,P<0.05),S期细胞比例(分别为27.05%﹑28.33%)明显高于NC组﹑Ad-GFP对照组(分别为12.75%﹑13.3%,P<0.05),表明在ERS状态下腺病毒Ad-IRE1α﹑Ad-R+K均可促进ATDC5细胞的增殖(图4)。
2.2.2 IRE1α重组腺病毒对ATDC5细胞凋亡的影响 流式细胞仪检测结果显示,TM刺激诱导ERS条件下,感染Ad-IRE1α﹑Ad-R+K腺病毒上清后,ATDC5细胞的凋亡率分别为53.70%﹑64.72%,明显高于NC组﹑Ad-GFP对照组(分别为26.84%﹑29.00%,P<0.05),表明Ad-IRE1α﹑Ad-R+K腺病毒上清均可促进软骨干细胞ATDC5的凋亡(图5)。
3 讨 论
ERS激活的一系列信号通路统称为UPR,UPR的三个分支IRE1﹑PERK﹑ATF6均可促进细胞存活,减少错误折叠的蛋白,如果ERS没有缓解,UPR的信号也可促进细胞凋亡。UPR各信号通路协同调控细胞生长和凋亡的机制目前还不清楚,IRE1-XBP1信号通路是目前研究最多的。在哺乳动物细胞中IRE1有两个同源体,即IRE1α和IRE1β[5-6],前者在体内广泛存在,而后者仅表达于胃肠道上皮细胞[7]。Cox等[8]研究认为IRE1在内质网未折叠蛋白积聚引起的应激条件下对细胞的生存起关键作用,有利于血管生成和肿瘤生长[9]。Lin等[10]研究发现,在持续的ERS条件下,人HEK-293细胞中IRE1蛋白的表达逐渐衰减,而人为地维持IRE1的持续表达可促进细胞增殖。
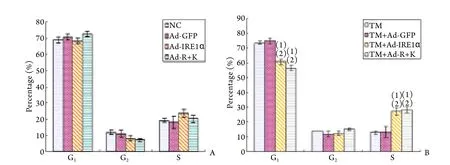
图4 有/无TM处理条件下各组ATDC5细胞周期的流式细胞仪检测结果Fig.4 FCM results of ATDC5 cell cycle distribution assay with or without TM
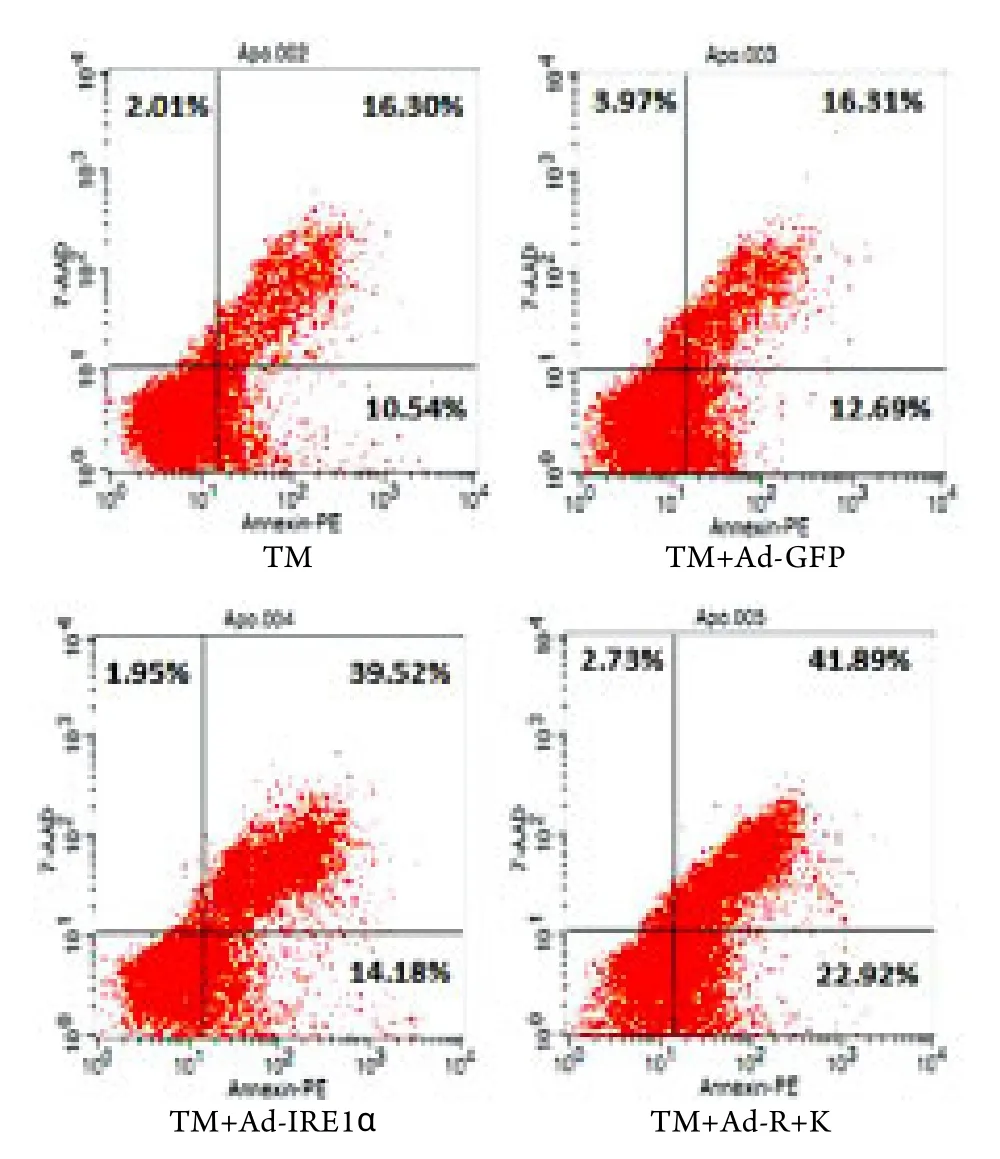
图5 流式细胞仪检测各组ATDC5细胞凋亡率Fig. 5 FCM assay on ATDC5 cell apoptosis rate
IRE1α的细胞质区域具有激酶和核糖核酸酶活性,缺失突变体分析表明这两个结构域部分重叠[11]。在正常情况下,IRE1α通过与内质网固有分子伴侣BiP相互作用维持单体状态[12-13],ERS条件下,BiP从IRE1α分离并转而与积聚的未折叠蛋白结合,使IRE1α可以通过氢键结合形成二聚体[14],二聚化又导致IRE1α蛋白胞质域激酶和核糖核酸酶活性的激活[15]。但关于IRE1α是如何活化的至今仍存在分歧。Kohno等[16]认为哺乳动物细胞中IRE1α的活化仅仅依赖于BiP从IRE1α分离,并不依赖于未折叠蛋白间的相互作用或IRE1α的其他组件。而Oikawa等[17]提出,IRE1的活化除了与BiP分离和自我联合有关外,在细胞腔侧还存在至关重要的未知变化。
本研究采用TM处理诱导ATDC5细胞进入ERS状态,通过流式细胞仪检测感染Ad-IRE1α﹑Ad-R+K腺病毒上清后的ATDC5的细胞周期,结果显示,Ad-IRE1α﹑Ad-R+K组G1期细胞比例明显低于NC组﹑Ad-GFP对照组(P<0.05),S期细胞比例明显高于NC组﹑Ad-GFP对照组(P<0.05),表明腺病毒Ad-IRE1α﹑Ad-R+K均可在ERS状态下促进ATDC5细胞从G1期进入S期,加速细胞周期的进程,从而促进细胞增殖。而在无TM处理条件下,各组细胞周期无显著差异(P>0.05),表明pAd-R+K这个核心截短体重组腺病毒虽然能够自我联合且在非应激条件下不与BiP结合,但其活化仍依赖于ERS。流式细胞仪检测显示,与Ad-GFP对照组比较,Ad-IRE1α﹑Ad-R+K细胞凋亡率均明显增加(P<0.05),提示IRE1α可有效促进软骨干细胞ATDC5的凋亡。
综上所述,本实验构建的携带人IRE1α基因的重组腺病毒载体具有转染效率高﹑易观察等优点,为下一步研究IRE1α的生物学功能调控,干细胞增殖﹑分化,以及相关调节基因表达的信号传导机制奠定了基础。
[1] Shamu CE, Walter P. Oligomerization and phosphorylation of the Ire1p kinase during intracellular signaling from the endoplasmic reticulum to the nucleus[J]. EMBO J, 1996,15(12): 3028-3039.
[2] Calfon M, Zemg H, Urano F, et al. IRE1 couples endoplasmic reticulum load to secretory capacity by processing the XBP-1 mRNA[J]. Nature, 2002, 415(6867): 92-96.
[3] Liu P, Li XZ, Guo FJ, et al. Analysis of IRE1 domain and construction of truncated IRE1 expression vector[J]. J Med Mol Biol, 2011, 8(2): 108-113. [刘平, 李祥柱, 郭风劲, 等. IRE1结构域分析及截短型载体的构建和表达[J]. 医学分子生物学杂志, 2011, 8(2): 108-113.]
[4] He TC, Zhou S, da Costa LT, et al. A simplified system for generating recombinant adenoviruses[J]. Proc Natl Acad Sci U S A, 1998, 95(5): 2509-2514.
[5] Tirasophon W, Welihinda AA, Kaufman RJ. A stress response pathway from the endoplasmic reticulum to the nucleus requires a novel bifunctional protein kinase/endoribonuclease (Ire1p) in mammalian cells[J]. Genes Dev, 1998, 12(12): 1812-1824.
[6] Wang XZ, Harding HP, Zhang Y, et al. Cloning of mammalian Ire1 reveals diversity in the ER stress responses[J]. EMBO J,1998, 17(19): 5708-5717.
[7] Bertolotti A, Wang X, Novoa I, et al. Increased sensitivity to dextran sodium sulfate colitis in IRE1beta-deficient mice[J].Clin Invest, 2001, 107(5): 585-593.
[8] Cox JS, Shamu CE, Walter P. Transcriptional induction of genes encoding endoplasmic reticulum resident proteins requires a transmembrane protein kinase[J]. Cell, 1993, 73(6): 1197-1206.[9] Drogat B, Auguste P, Nguyen T, et al. IRE1 signaling is essential for ischemia-induced vascular endothelial growth factor-A expression and contributes to angiogenesis and tumor growth in vivo[J]. Cancer Res, 2007, 67(14): 6700-6707.
[10] Lin JH, Li H, Yasumura D, et al. IRE1 signaling affects cell fate during the unfolded protein response[J]. Science, 2007,318(5852): 944-949.
[11] Zhao WJ, Zhu HF, Guo FJ, et al. Impact of endoplasmic reticulum stress on regulation and control of XBP1 promoter transcription by ATF6[J]. Med J Chin PLA, 2012, 37(4): 317-321. [赵文君, 朱慧芳, 郭风劲, 等. 内质网应激对ATF6调控XBP1启动子转录的影响[J]. 解放军医学杂志, 2012, 37(4):317-321.]
[12] Kimata Y, Oikawa D, Shimizu Y, et al. A role for BiP as an adjustor for the endoplasmic reticulum stress-sensing protein Ire1[J]. J Cell Biol, 2004, 167(3): 445-456.
[13] Oikawa D, Kimata Y, Takeuchi M, et al. An essential dimerforming subregion of the endoplasmic reticulum stress sensor Ire1[J]. Biochem J, 2005, 391(Pt 1): 135-142.
[14] Lin CY, Wong H , Schauerte JA, et al. The protein kinase/endoribonuclease IRE1alpha that signals the unfolded protein response has a luminal N-terminal ligand-independent dimerization domain[J]. J Biol Chem, 2002, 277(21): 18346-18356.
[15] Welihinda AA, Tirasophon W, Green SR, et al. Gene induction in response to unfolded protein in the endoplasmic reticulum is mediated through Ire1p kinase interaction with a transcriptional coactivator complex containing Ada5p[J]. Proc Natl Acad Sci USA, 1997, 94(9): 4289-4294.
[16] Kohno K. Stress-sensing mechanisms in the unfolded protein response: similarities and differences between yeast and mammals[J]. J Biochem, 2010, 147(1): 27-33.
[17] Oikawa D, Kimata Y, Kohno K. Self-association and BiP dissociation are not sufficient for activation of the ER stress sensor Ire1[J]. J Cell Sci, 2007, 120(Pt 9): 1681-1688.

