微射流和超声波对长期贮藏大豆分离蛋白溶解性的影响
黄利华,黎海彬,彭述辉,陈 林
(广州城市职业学院食品系,广东广州510405)
大豆除了直接食用和作为食品加工的原辅料外,还是一种重要的油料作物[1]。而豆粕则是大豆榨油后的主要剩余物,因其蛋白质含量高达40%以上,从中提取大豆分离蛋白(SPI)是豆粕高值化利用的主要途径之一。SPI因其具有较好的营养性和功能特性而在食品加工中广泛应用,蛋白质良好的溶解性是应用其功能特性的前提和基础。SPI在贮藏中其溶解性一般会下降,究其原因可能是温度、湿度等外部环境影响蛋白质与蛋白质之间关联和蛋白质分子内部亲/疏水性质,最终反映蛋白质溶解性发生的变化[2-3]。蛋白溶解性的研究较多集中在利用理化手段修饰改性蛋白,使其能够和水分子较好结合。例如Jambrak A R等利用20、40、500Hz超声对 SPI溶液处理,40Hz的溶解性最高[4],Chen L等利用双螺杆挤压 SPI,其溶解性明显提高[5],涂宗财等[6]利用超高压均质处理SPI溶液,其溶解性随压力和蛋白浓度增加而升高,杨国龙等[7]用 Alcalase酶水解 SPI溶液,增强了SPI在水溶液中的扩散性。微射流是利用高压使蛋白溶液在交互容腔内产生剪切和冲撞,从而改变分子的排列和结构[8]。超声具有波动和能量的双重属性,对于难溶性蛋白的分离制备具有较好效果[9]。目前对贮藏条件下蛋白溶解性的变化缺乏系统研究,本研究将微射流结合超声技术,提高不同贮藏期内SPI溶解性,从而有助于提升SPI功能特性,为拓展较长贮藏时间的大豆蛋白应用提供技术支持。
1 材料与方法
1.1 材料与仪器
豆粕(脱脂白豆粕片)山东日照;Mark、尿素、牛血清蛋白 Sigma;β-巯基乙醇(化学纯)、三羟甲基氨基甲烷盐酸盐、尿素、磷酸二氢钠、氢氧化钠、盐酸等 均为国产分析纯。
M-110L高压纳米微射流均质机 美国MFIC公司;JY92-2D型超声细胞粉碎机 上海新诺公司;WATERS高效液相 美国WATERS公司;F-3000紫外-可见分光光度计 日本HITACHI公司;Zetasizer Nano ZS纳米激光粒度仪 英国Malvern公司;AR-1500流变仪 美国 AR公司;Avanti J-26XP离心机 德国BECKMAN公司。
1.2 实验方法
1.2.1 大豆分离蛋白的制备和贮藏 采用常用的碱溶酸沉法制备大豆分离蛋白。粉碎脱脂豆粕,过80目筛,豆粕粉与水1∶10(w/v),用1mol/L的NaOH调pH至8.0,30℃搅拌1.5h,在搅拌过程中始终维持pH为8.0,将溶液在4℃离心(10000×g,30min),取上清液。用1mol/L HCl将上清液pH调至4.5,30℃下搅拌30min,然后在 4℃ 离心(12000 × g,10min),取沉淀。将沉淀复溶,再次离心沉淀。将沉淀按1∶5(w/v)加水复溶,调pH至7.0,在4℃水中透析24h,每4h换一次水,将透析后SPI溶液调整浓度后冷冻干燥,塑封袋密闭后于室温下置于干燥皿中贮藏。
1.2.2 微射流结合超声波处理SPI溶液 根据前期实验的结果,设置纳米微射流均质机的输出压力为17400psi,即约为120MPa,浓度为5%的 SPI溶液通过微射流均质1次。将通过微射流的SPI溶液放入超声细胞粉碎机内,操作功率500W,超声探头插入液体下面3cm,采用工作5s,间歇5s的方式,该操作方式通过不断反复的振荡,蛋白的溶解效果好于连续式振荡。
1.2.3 凝胶电泳(SDS-PAGE)分离胶浓度为12%,浓缩胶浓度为4%。样品制备:蛋白样品溶于SDS-PAGE 样品缓冲液(0.125mol/L Tris-HCl缓冲液,含 1%(w/v)SDS、2%(v/v)巯基乙醇、5%(v/v)甘油和0.025%(w/v)溴酚蓝,电泳前煮沸5min。上样量为10μL,凝胶电泳于恒流模式下进行,在浓缩胶中电流40mA,进入分离胶后增至80mA。凝胶染色液采用0.25%考马斯亮蓝(R-250)溶液,脱色采用高甲醇的醋酸溶液,甲醇/冰乙酸/去离子水按 227∶37∶236(v/v/v)。
1.2.4 溶解性测定 蛋白质的溶解度测定根据Petrucelli S等报道的方法[10],稍加改动,测量处理后溶液中的可溶性蛋白含量。称取不同贮藏时间和微射流处理的蛋白样品100mg,分散于10mL的去离子水中,室温下磁力搅拌30min,然后用1mol/L NaOH或HCl溶液调节溶液的pH到7.0,再搅拌30min后,在20℃离心(12000×g,20min)。上清液经过适度稀释后,采用福林酚法测定蛋白质含量,以牛血清白蛋白(BSA)为标准物做标准曲线。蛋白质的溶解度为上清液蛋白浓度占总蛋白浓度的百分比,每个样品重复测量3次。
1.2.5 凝胶排阻色谱 凝胶排阻色谱(SEC-HPLC)条件如下:WATERS 2487高效液相泵和1525紫外检测器组成的 WATERS高效液相系统,采用 TSK G4000SW作为分析柱,洗脱液为50mmol/L磷酸缓冲溶液(pH 7.2,50mmol/L NaCl),流速为0.8mL/min。洗脱液经滤膜后(0.45μm),再超声脱气。膜滤后的蛋白溶液(2mg/mL)上样于TSK G4000SW柱(进样量为 20μL),采用恒流洗脱。以蓝色葡聚糖(2000ku)、伴清蛋白(75ku)、醛缩酶(158ku)、铁蛋白(440ku)和甲状腺球蛋白(669ku)的洗脱时间绘制标准曲线。
1.2.6 浊度测定 将不同保藏期和经微射流结合超声处理的SPI蛋白溶液稀释至浓度为0.5%wt,溶剂分别为S1:水溶液(pH7.0);S2:pH7.0缓冲液(0.05mol/L的Tris-HCl,6mol/L 尿素和 10mmol/L 的 β- 巯基乙醇)。把上述各种SPI蛋白溶液分别在600nm测吸光度,每个样品测量3次。
1.2.7 粒度测定 加热处理前先将不同保藏期和经微射流结合超声处理的SPI蛋白溶液通过0.45μm膜过滤,然后将处理的样品稀释成浓度为0.1%,在85℃下加热10min,将样品液加入到比色皿中。常温测量是在25℃条件下进行,对比蛋白聚集粒度的变化,每个样品分别测量3次。
1.2.8 数据统计分析 采用SPSS 17.0软件和Excel 2003软件进行统计分析、数据处理和绘图。
2 结果与分析
2.1 超声处理对可溶性蛋白的影响
将浓度5%贮藏360d的SPI溶液分别通过功率为 200、350、500、650、800W 的超声处理 10min,结果如图1所示,超声处理能显著提高SPI可溶性蛋白含量,可溶性蛋白含量随超声功率的加大而逐渐增加,但在功率500W以后其增幅减弱,统计学上无显著差异(p>0.05)。

图1 超声功率对可溶性蛋白的影响Fig.1 Effect of ultrasonic power on soluble protein
将浓度5%贮藏360d的SPI溶液分别通过功率为500W 超声处理5、10、15、20、25min,结果如图2 所示,延长超声时间同样也增加可溶性蛋白含量,但在15min以后其增幅减弱,20、25min的结果已无显著差异(p>0.05)。
超声波具有能量和波动的双重性,使蛋白溶液中产生的空化、剪切和热作用,以致使蛋白质的肽链结构变得疏松,增强了与水分子结合能力,从而提高可溶性蛋白含量。超声波还可使蛋白分子产生高速振荡,改变了蛋白质的构象和结构,使亲水性氨基酸残基暴露,增强蛋白质的亲水性[11]。

图2 超声时间对可溶性蛋白的影响Fig.2 Effect of ultrasonic time on soluble protein
2.2 微射流均质对蛋白质溶解性的影响
将浓度5%贮藏360d的SPI溶液分别通过微射流压力4000、8000、12000、16000psi的微射流均质 1次和2次,结果如图3所示,可溶性蛋白含量随压力的增大而逐渐增大,而通过第2次均质后可溶性蛋白含量有所下降。微射流均质是利用高压使蛋白溶液在交互容腔内产生剪切和冲撞,从而改变分子的排列和结构,达到增加蛋白溶解性的目的[8]。微射流结合超声波处理改变了蛋白的分子结构,增加了蛋白分子与水分子的结合能力,使可溶性蛋白含量增加。第2次通过微射流均质使蛋白疏水基团更多暴露,从而减弱了蛋白与水的结合能力,降低其溶解性。
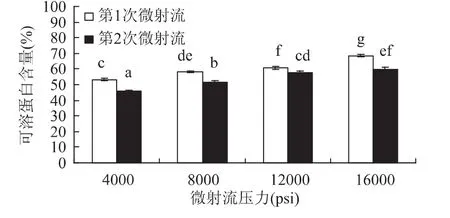
图3 微射流均质次数对可溶性蛋白的影响Fig.3 Effect of homogeneous times of microfluidization on soluble protein
2.3 微射流和超声波对SPI溶解性的影响
将4份SPI在同等条件下贮藏,分别在0、120、240、360d取出测量SPI溶液中可溶性蛋白的含量。如图4所示,在0~360d的范围内,随着贮藏时间的延长,SPI可溶性蛋白含量显著下降(p<0.05),将贮藏360d的SPI分别通过微射流和超声波处理(MF+U),蛋白分子去折叠化,也增加了蛋白分子的扩散性和亲水性,SPI的可溶性蛋白含量也从0d的59.5%±1.2%降低到360d的43.3% ±1.6%。而经过微射流和超声波处理后,SPI可溶性蛋白含量(88.1% ±1.3%)显著提高。可溶性蛋白含量的提高理论上同样促进蛋白的乳化性、持水性和持油性等功能性质的提高[12-13]。
2.4 SPI的凝胶电泳图谱
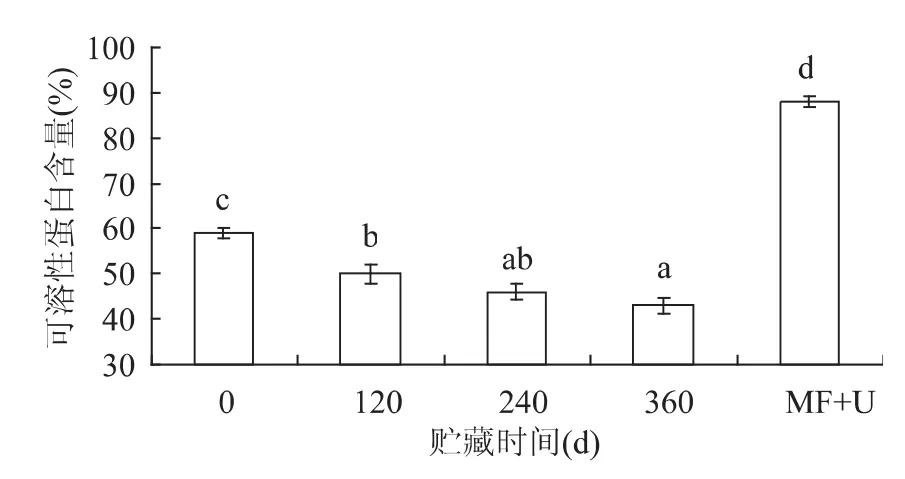
图4 不同贮藏期SPI的溶解性Fig.4 Solubility of SPI in different storage periods
图5所示贮藏期为0、120、240、360d的 SPI凝胶电泳图谱。不同贮藏期的SPI中各组分亚基发生变化,小分子量组分明显增多,常温贮藏条件下SPI理化性质逐渐发生改变,蛋白质分子去折叠,分子内部的结构发生变化。大豆球蛋白(glycinin)的疏水性碱性亚基部分(B)逐渐增多,增加了其不溶部分含量。将贮藏360d的SPI溶液通过微射流和超声波处理,在高压高剪切的环境中,其碱性亚基减少,蛋白的亲水性增强,溶解性提高。大豆球蛋白和β-伴球蛋白的亚基解离,不同亲/疏水性亚基的暴露改变了包括溶解性在内的性质[14]。
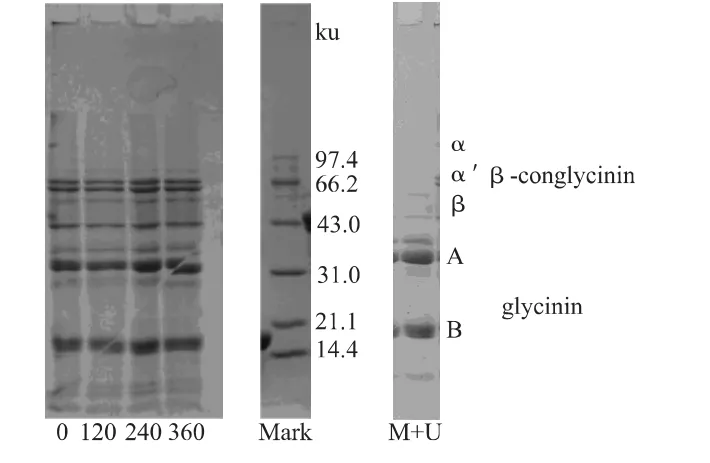
图5 SPI各组分的SDS-PAGE图Fig.5 SDS-PAGE of SPI components
2.5 SPI的凝胶色谱图
不同贮藏期的SPI和通过微射流结合超声处理蛋白的凝胶排阻色谱图如图6所示,主要的洗脱峰出现在15min以内,贮藏期为0~360d的SPI,峰形和出峰时间变化趋势近似。但是,从图中也发现主峰面积和出峰时间并没有明显的规律。可能是SPI中亚基在贮藏过程中既存在解聚,同时也存在聚合[5]。而通过微射流和超声处理的SPI溶液,其主峰峰面积减少,可能是蛋白疏水聚集减少,蛋白易发生水合作用,有利于蛋白溶解性的提高。
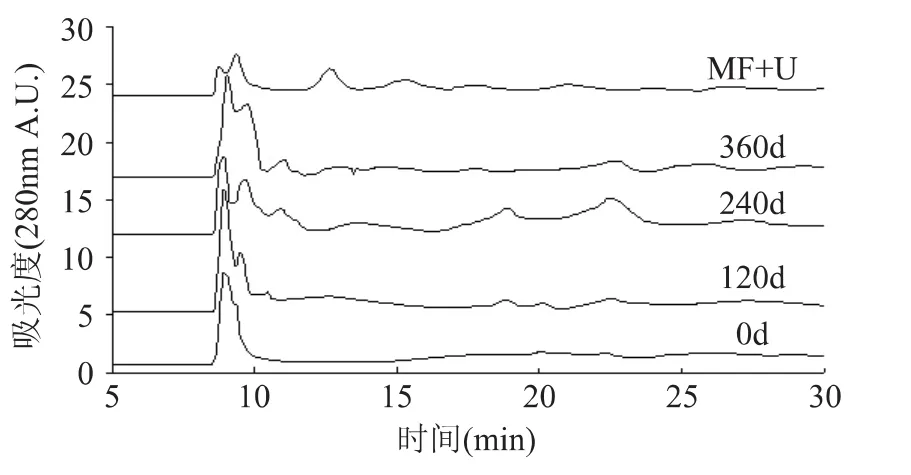
图6 不同贮藏期和处理后SEC-HPLC图谱Fig.6 SEC-HPLC of SPI in different storage periods and treatment
2.6 微射流和超声波对SPI聚集粒径影响
蛋白的粒径反映了在溶液中的扩散情况,贮藏期0~360d的SPI在85℃下加热10min蛋白聚集程度的粒度分布情况如图7所示,溶液中的蛋白聚集粒径随贮藏时间延长,聚集的粒径也增大。在360d贮藏后,SPI的热聚集甚至出现了双峰粒径(255nm)。而通过微射流和超声处理的SPI其粒径最小(21nm),其分布范围也更加集中,显著改变了贮藏360d SPI粒径的双峰模式。这一结果与微射流处理蛋白粒径变化趋势相一致[15]。
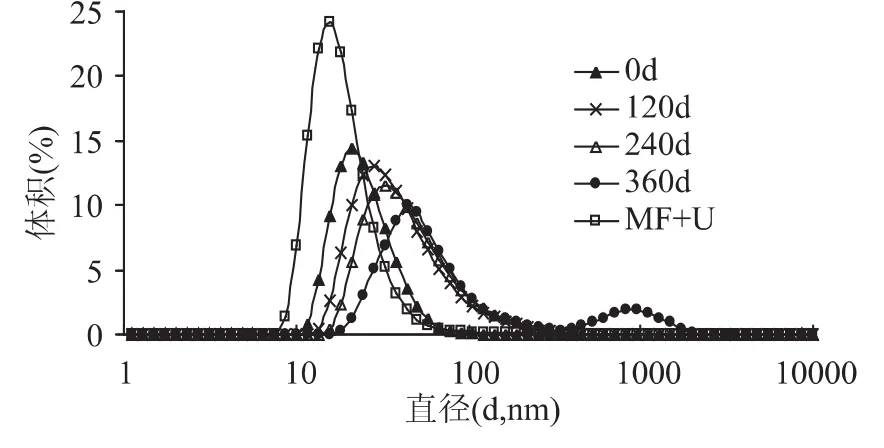
图7 不同贮藏期和处理后SPI聚集的粒度Fig.7 Aggregation size of SPI in different storage periods and treatment
2.7 微射流和超声波对SPI聚集浊度影响
图8显示了在600nm波长下不同SPI溶液中的浊度分析,反映了不同处理条件下蛋白悬浮液的透光率。S1溶液为水溶液,显示了SPI热聚集在可见光下的透光率。不管是S1的水溶液中还是S2的缓冲液中,贮藏期0~360d的范围内,SPI溶液的浊度随贮藏时间延长而逐渐增大,溶液中蛋白的聚集程度越来越强。而经过微射流和超声波处理,蛋白溶液的浊度明显下降,吸光度下降,透光率提高。
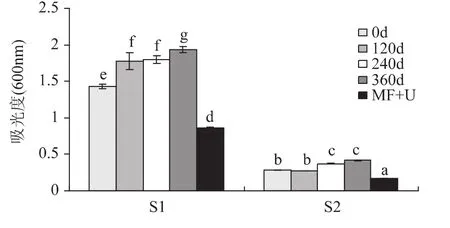
图8 不同溶剂中SPI溶液浊度Fig.8 Turbidity of SPI in different solvent
S2缓冲液中存在尿素和巯基乙醇,尿素破坏了蛋白的许多疏水键和氢键等非共价键,使蛋白的溶解性增加。巯基乙醇则破坏蛋白分子内二硫键等共价键,S2缓冲液中的浊度与S1比较明显下降,可以推测溶液中SPI生成聚集主要是疏水键和氢键等非共价键起连接作用。
3 结论
通过实验明确了在常温密闭贮藏条件下,SPI的溶解性随着贮藏时间的延长而逐渐下降,可溶性蛋白含量从贮藏0d的59.5% ±1.2%降低到360d的43.3%±1.6%。凝胶电泳图谱和排阻色谱显示SPI在贮藏期0~360d内,SPI亚基等成分发生解聚,SPI聚集的粒径随贮藏时间延长而变大,分布范围更宽,SPI聚集溶液浊度分析也显示随贮藏时间延长溶液浊度值更高。经过微射流和超声波双重处理,SPI可溶性蛋白含量上升到88.1%±1.3%。凝胶排阻色谱波峰显示SPI中亲水性变化,SPI聚集的粒径显著下降,SPI聚集的浊度在水溶液中要显著高于尿素和巯基乙醇的缓冲液,SPI聚集主要是由非共价键连接。
[1]Caballero B,Trugo L,Finglas P.Encyclopedia of food sciences and nutrition(Second Edition)[M].American:Academic Press,2003:5375-5379.
[2]Tang C H,Wang X Y,Yang X Q,et al.Formation of soluble aggregates from insoluble commercial soy protein isolate by means of ultrasonic treatment and their gelling properties[J].Journal of Food Engineering,2009,92(4):432-437.
[3]王小英,李娜.超声处理对大豆蛋白溶解性及蛋白组分的影响[J].中国油脂,2009,34(4):31-34.
[4]Jambrak A R,Lelas V,Mason T,et al.Physical properties of ultrasound treated soy proteins[J].Journal of Food Engineering,2009,93(4):386-393.
[5]Chen L,Chen J S,Ren J Y,et al.Modifications of soy protein isolates using combined extrusion pre-treatment and controlled enzymatic hydrolysis for improved emulsifying properties[J].Food Hydrocolloids,2011,25(5):887-897.
[6]涂宗财,汪菁琴,阮榕生,等.超高压均质对大豆分离蛋白功能特性的影响[J].食品工业科技,2006,27(1):66-67.
[7]杨国龙,赵谋明,杨晓泉,等.限制性酶水解-超滤法生产改性大豆蛋白[J].食品科学,2006,27(5):163-166.
[8]Lordache M,Jelen P.High pressure microfluidization treatment of heat denatured whey proteins for improved functionality[J].Innovative Food Science & Emerging Technologies,2003,4(4):367-376.
[9]宋佳天,赵新淮.大豆蛋白的酶水解及类蛋白反应对其抗氧化活性的影响[J].食品科学,2012,33(1):115-119.
[10]Petrucelli S,Anon M C.Relationship between the method of obtention and the structural and functional properties of soy protein isolates.1.Structural and hydration properties[J].Journal of Agricultural and Food Chemistry,1994,42(10):2161-2169.
[11]孙燕婷,黄国清,肖军霞,等.超声处理对大豆分离蛋白溶解性和乳化活性的影响[J].中国粮油学报,2011,26(7):22-26.
[12]Bernard E C,Alistair S G,Michael J L.Some functional properties offractionated soy protein isolates obtained by microfiltration[J].Food Hydrocolloids,2007,21(8):1379-1388.
[13]石彦国,刘洪洪,孙冰玉.贮藏条件对大豆分离蛋白溶解性的影响[J].食品工业科技,2010,31(3):336-338.
[14]M Ryan,E McEvoy,S Duignan,et al.Thermal stability of soy protein isolate and hydrolysate ingredients[J].Food Chemistry,2008,108:503-510.
[15]Anupam M,John N C.The effect of surfactants on the solubility,zeta potential,and viscosity of soy protein isolates[J].Food Hydrocolloids,2004,18(1):101-108.

