象山港网箱养殖对近海沉积物细菌群落的影响
裘琼芬 ,张德民,叶仙森,郑珍珍
(1.宁波大学海洋学院,宁波 315211;2.国家海洋局宁波海洋环境监测中心站,宁波 315012)
随着世界人口的增长和捕捞渔业的日渐枯竭,水产养殖业快速发展,已成为人类蛋白质的重要来源之一。网箱养殖作为一种高度集约化的养殖模式,具有高产、高效益等特点[1]。但与此同时,大量养殖废物的输出,使海洋食物链和生态系统遭到了直接或间接的影响[1-2]。近海是养殖活动的集中地带,海水网箱养殖对环境中碳、氮、磷、悬浮颗粒、硫化物和营养盐等产生了显著影响[3]。海水鱼类养殖饵料中估计有23%的碳,21%的氮和53%的磷会在养殖环境底部沉积物中积累,对1 km以内的环境都会有显著影响[4]。Yoza等通过对夏威夷欧胡岛养殖区域沉积物的分析表明,养殖区域有机碳含量比非养殖区高25%—37%,氨含量比非养殖区高30%—46%[5]。此外,有机物质的富集,大大增加了耗氧量[4],是近海富营养化和氧气缺失的源头之一[6-7];同时,因养殖活动引入的抗生素类物质[8-9],已成为水生动物甚至人类健康的重要问题。
微生物的多样性是正确评价海洋生态系统结构和功能的主要组成部分。养殖活动影响了沉积物中微生物多样性,影响了微生物群落的组成和分布,进而扰乱了微生物的生态功能[10]。Caruso等发现地中海区域的渔场在存在前后,水体中异养细菌的密度变化不大,而沉积物中异养细菌的密度则显著增加[11],表明养殖活动对近海环境中微生物的分布存在显著影响。养殖活动对海洋环境中微生物群落的改变反过来对人类的健康又会有决定性的影响(比如:病原菌的传播和抗生素的耐抗)。因此,详细分析微生物多样性是研究人类活动对海洋生态系统影响必不可少的一部分[2]。
关于养殖活动对沉积物细菌多样性影响的研究还较少,以往沉积物中微生物多样性的研究也多是基于培养技术[12-14]。但已有的研究表明,分离培养等传统的微生物研究方法只能得到环境中不到1%的微生物[15-16],因此以往对沉积物中微生物的纯培养分析不能真实地反映其中的微生物群落结构,也会导致对沉积物中微生物多样性的认识产生偏差,影响对近海生态系统的正确评价。近年来,基于16S tag分析的454(Roche)焦磷酸测序技术的一个反应可以得40万到100万条序列,包含了足够的信息用于微生物的分类[17]。这种方法的使用在人类微生物群组和环境微生物群落方面都得到了很多新的结果[18-19],但成本还较昂贵。T-RFLP技术是将RFLP技术和荧光标记技术相结合后发展的一种较先进的分子生态学方法,是检测操作分类单元(OTUs)的高通量方法,可用于大量样品的检测,并得到数据化的结果,Liu等[20]于1997年将其首次应用于微生物群落多样性的研究。该方法灵敏度较高,适于微生物群落多样性中等或更低环境样品的多样性分析,是目前大量环境样品微生物生态分析的主要手段[21]。
1 实验方法
1.1 样品采集
沉积物样品于2011年7月取自浙江省宁波市象山港内3个不同区域(图1):象山港口非养殖区(CK:29°36'11.94″N,121°46'18.00″E)、西沪港口交汇区(IS:29°33'0.66″N,121°44'10.86″E)和西沪港内网箱养殖区(AC:29°32'33.66″N,121°46'6.42″E)。同期,国家海洋局宁波海洋环境监测中心站测定了3个区域表层沉积物的总有机碳(TOC)含量、上层水的TOC和盐度(表1)。每个区域布置3个平行位点,用底泥采样器在各位点采集深度大于70 cm的柱状沉积物,粒径分析表明均为粉砂质粘土(表1)。将沉积物在原位按深度切割分成6层:0—5,5—10,10—15,15—20,20—25,50—55 cm。所有沉积物样品立即用液氮冰冻,带回实验室存于-20℃。

表1 样品采集区域的理化背景Table 1 Physicochemical background of the sediments in sampling sites
1.2 理化分析
采样现场测定沉积物的氧化还原电位(Eh)和温度。氧化还原电位的测定采用带甘汞-铂电极的PHB-4便携式酸度计(上海精科),并根据pH值通过公式Eh=Eh'+(pH-7)×60对实测值Eh'进行校正。去离子水浸提沉积物,用pH计(上海精科)测得上清液的pH值。硫酸盐浓度测定按照HJ/T342—2007标准方法进行。

图1 采样位点示意图Fig.1 Sampling sites
1.3 沉积物总DNA的提取
总DNA的提取采用MP公司的土壤DNA提取试剂盒(FastDNA SPIN kit for soil),称取混匀的沉积物核心样品各0.5 g按照说明书进行操作,最后将总DNA溶于100 μL DES(试剂盒提供)中。
1.4 细菌16S rRNA基因的扩增
采用带FAM荧光标记的细菌16S rRNA基因通用引物27F-FAM(5'-FAM-AGA GTT TGA TCM TGG CTC AG-3')和907R:(5'-CCG TCA ATT CCT TTR AGT TT-3'),取1 μL总DNA作为模板进行PCR。反应体系(50 μL):5 μL 10×Buffer,4 μL 2.5 mmol/L dNTP,1 μL 10 μmol/L 引物,1 μL 2.5 U Taq DNA 聚合酶(TaKaRa 公司),1 μL模板DNA,加灭菌ddH2O至50 μL并混匀。扩增条件:94℃ 5 min;94℃ 30 s,53℃ 45 s,72℃ 90 s,30个循环;72℃ 7 min。PCR产物经1%琼脂糖凝胶电泳检测产量和特异性后,用DNA纯化试剂盒(北京天根生化科技有限公司)纯化。
1.5 细菌16S rRNA基因的限制性酶切
采用限制性内切酶Msp I(TaKaRa公司)对细菌的16S rRNA基因PCR纯化产物进行酶切。反应体系(40 μL):4 μL 10× Buffer,4 μL 0.1%BSA,10U 限制性内切酶,30 μL PCR 纯化产物,加灭菌 ddH2O 至 40 μL 并混匀。37℃酶切3 h后,立即加入3×40 μL的预冷无水乙醇和0.1×40 μL的3mol/L NaAc(pH值5.2),采用乙醇沉淀法纯化脱盐,纯化后溶于10 μL灭菌ddH2O。
1.6 限制性片段的基因扫描
取1—3 μL酶切纯化得到的样品,与10 μL HiDi-甲酰胺和0.2 μL内标(MapMarker 1000)混匀后在95℃变性3 min,马上置于冰浴,然后通过ABI 3130 Genetic Analyzer进行限制性片段的基因扫描,并由 ABI GeneMap分析软件获取T-RFLP结果。
1.7 克隆/测序和系统发育分析
构建CK区域0—5 cm沉积物样品的细菌16S rRNA基因克隆文库。扩增引物采用无FAM荧光标记的引物27F/907R,其余PCR条件同上。以凝胶纯化后的PCR产物为模板,pMD19-T Vector(TaKaRa公司)为载体,在16℃连接反应3 h。连接产物转入大肠杆菌JM109感受态细胞(TaKaRa公司),并涂布于含X-gal和IPTG的LB培养基上。分别筛选93个细菌阳性克隆进行测序,所得序列利用ARB软件[25]中的NJ算法(Neighbor-Joining)进行系统发育分析。所有序列已提交EMBL,序列号为HE648378-HE648470。
1.8 数据处理
以细菌16S rRNA基因T-RFLP图谱中每一个限制性片段(T-RF)为1个可操作分类单元(OTU),以T-RF相对峰高值(每个T-RF的峰高占累计峰高的比值)作为各OUT的相对丰度,相对丰度低于0.5%的OTU不予考虑。根据OTU的数目(S)及其相对丰度(Pi)进行多样性分析,包括计算Shannnon-Weiner多样性指数(H'=-∑ Pi lnPi)和Pilou的均匀度指数(E'=H/lnS)。
2 结果与分析
2.1 沉积物理化性质
象山港不同区域的沉积物温度相似,且具有相同的变化趋势(表2):表层沉积物的温度均为26.5℃,随着深度的增加,温度逐渐降低。pH值测量结果显示,沉积物均呈微碱性(图2),pH值处于7.6—7.9之间,且CK与IS区域沉积物相似,但AC区域不同深度沉积物pH值明显高于其它两个区域。与pH值不同,AC区域各深度沉积物的Eh介于CK和IS区域,且随深度呈下降趋势(图2)。CK区域不同深度沉积物的Eh变化不明显,均处于190 mV左右,远远高于IS区域(100 mV左右)。硫酸盐含量在养殖区和交汇区沉积物中随着深度的变化无明显规律(图2),但在对照区呈现随深度降低的趋势。尤其在50—55 cm沉积物中,硫酸盐含量显著降低,低于768×10-6。平均来说,AC区域的较高,不同深度沉积物的均值为1200×10-6,CK区域则只有 950×10-6。

表2 各区域不同深度沉积物温度(Mean±SE,n=3)Table 2 Temperature of the different deep sediments in each site(Mean± SE,n=3)

图2 各区域不同深度沉积物的pH、Eh和硫酸盐含量(Mean±SE,n=3)Fig.2 pH,Eh andcontents of the different deep sediments in each site(Mean±SE,n=3)
2.2 基于T-RFLP的细菌群落结构分析
采用细菌16S rRNA基因的通用引物27F/907R扩增沉积物总DNA,进行末端限制性片段长度多态性分析,得到细菌群落的T-RFLP图谱(图3)。由图3可以看出,所有沉积物中细菌种类较丰富,末端限制性片段(T-RFs)的长度主要集中在100—200 bp和510—520 bp左右。相比于同一区域、不同深度沉积物的细菌群落结构差异,不同区域之间细菌群落结构的差异更加显著。比较3个区域不难发现,CK区细菌T-RFs明显多于AC区,且以T-RF长度处于165 bp和520 bp左右的相对丰度最高。在IS区域,则是T-RF 230 bp和520 bp占主要地位。AC区域中,不同平行位点间细菌群落的差异较大,尤其是表层0—5 cm、20—25 cm和50—55 cm。但T-RF 520 bp所代表的细菌在不同深度的沉积物中还是占有较高的相对丰度。
2.3 细菌群落系统发育分析
由细菌16S rRNA基因的克隆文库和系统发育分析(图4)可知,沉积物中细菌的多样性丰富,主要包括变形细菌纲(Proteobacteria)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、放线菌门(Actinobacteria)、热微菌门(Thermomicrobia)、硝化螺旋菌门(Nitrospirae)、酸杆菌门(Acidobacteria)、梭杆菌门(Fusobacteria)、拟杆菌门(Bacteroidetes)浮霉菌门(Planctomycetes)以及OP11等。对所得序列进行in silico酶切分析可知,T-RF 165 bp可能属于变形细菌(Proteobacteria)或厚壁菌门(Firmicutes)的细菌,但克隆文库中只有4个克隆属于厚壁菌门(Firmicutes),因此推测T-RF 165 bp主要属于变形细菌纲(Proteobacteria);而T-RF 510—520 bp所代表的细菌则主要分布在热微菌门(Thermomicrobia)。由此可见,热微菌门(Thermomicrobia)的细菌在所有沉积物中均有一定的丰度,在细菌克隆文库中也占了19.4%;而变形细菌(Proteobacteria)则在未受养殖活动影响的CK区域中有较高的相对丰度,在CK区域0—5 cm沉积物样品的细菌克隆文库中占23.7%。
2.4 细菌群落多样性分析
基于细菌16S rRNA基因T-RFLP图谱中末端限制性片段的数目及其相对丰度,计算了各区域不同深度沉积物中细菌多样性指数H'和均匀度指数E'(表3)。由表3可知,在AC区域,除表层0—5 cm外,细菌的多样性指数和均匀度指数均随着深度的增加而降低。与对照区CK相比,AC区域细菌的多样性显著降低。与AC不同,CK区域具有较一致的均匀度指数,细菌群落在不同深度的沉积物中具有相似物种丰富度。IS区域的多样性指数和均匀度指数则介于CK和AC区域之间。因此,从细菌的多样性来说,CK>IS>AC。
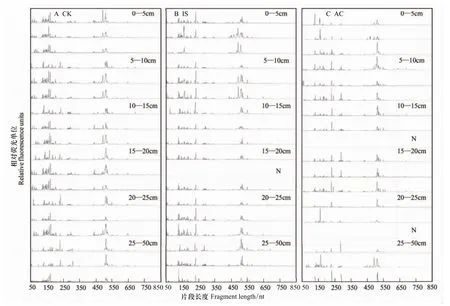
图3 沉积物中细菌群落的T-RFLP图谱Fig.3 T-RFLP profiles of bacterial communities of sediments

表3 基于T-RFLP图谱的细菌多样性分析(Mean±SE,n=2或3)Table 3 Analysis of bacterial diversity based on T-RFLP profiles(mean± SE,n=2 or 3)
3 讨论与结论

图4 细菌16S rRNA基因序列的系统发育关系Fig.4 Phylogenetic relationship(neighbor-joining)of bacterial 16S rRNA gene sequences
微生物群落的结构和功能受环境因素的制约[26],沉积物中微生物的多样性与养殖活动对近海环境的影响密切相关。一直以来,温度被认为是微生物群落最重要的影响因子之一[27-28]。本研究的结果也显示,随着深度的增加,沉积物温度降低(表2),细菌群落的多样性呈降低趋势(表3)。另外,许多研究表明,pH值对微生物群落结构会产生显著影响[29-30]。网箱养殖区沉积物的pH值较对照区及交汇区高(图2),对养殖区微生物多样性的降低。养殖活动还给近海环境带入了大量的还原性有机物[31],耗氧率也会比对照区高2—5倍[4]。因此,本研究中养殖区沉积物的氧化还原电位与对照区相比也降低了。氧化还原电位的降低使沉积物环境逐渐呈现缺氧状态,影响需氧微生物的代谢活动,不利于有机质的好氧分解,进而影响养殖环境与养殖生物的健康。氧化还原电位和pH值与其它营养盐类的分布存在一定关系[32]。本研究中沉积物硫酸盐的浓度变化(图2C)与氧化还原电位的变化无很好的相关性,说明存在影响沉积物氧化还原电位的其它因素,硫酸盐并非主导因素。因此,沉积物的温度、pH值和氧化还原电位都会影响其中微生物的群落结构和多样性[13,29]。
多样性指数是评价微生物群落多样性的有效方法,它包括微生物种类的丰富度及种类的均匀度[33]。细菌群落结构的多样性分析表明,网箱养殖降低了象山港近海沉积物中细菌群落的多样性(表3)。在未受养殖活动影响的对照区沉积物中,细菌群落多样性丰富,多样性指数H'>3.5,且具有良好的均匀度(0.93)。受养殖活动影响后,沉积物中微生物的多样性指数下降,且不同深度沉积物中细菌的均匀度也不再一致。近海的网箱养殖不但降低了沉积物中细菌的多样性,而且细菌的群落结构也发生了改变。在对照区,变形细菌(Proteobacteria)和热微菌门(Thermomicrobia)的细菌是其中的优势菌群(图3,图4),但在养殖区,变形细菌(Proteobacteria)丰度明显减少,且因养殖活动中不同时期引入不同数量和成分的有机物,有机物在不同位置和不同深度的分布都可能存在一定差异,使得不同深度、不同平行位点间细菌群落的差异较大(图3)。在交汇区,养殖海水受到外界海水的稀释,其中由养殖活动带入的物质浓度降低,沉积物受养殖活动的影响也降低,使微生物的多样性处于对照区与养殖区之间(表3)。刘晶晶等[14]采用分离培养的方法对象山港网箱养殖区细菌群落的研究中也发现,网箱养殖区细菌群落的多样性要低于对照点,且某些与鱼类疾病相关的假单胞菌、弧菌等特定细菌类群富集。由此可见,近海网箱养殖使沉积物中的细菌群落由多样性较高的稳定结构向多样性降低的不稳定结构转变,使养殖环境处于相对脆弱状态,导致养殖病害爆发几率增加。
此外,养殖区表层0—5 cm沉积物中细菌的多样性低于5—10 cm的沉积物,这与Bore等[34]对潮间带沉积物中细菌的多样性研究结果相似,他们发现10—15 cm沉积物中细菌的可操作分类单元(OUT)数高于表层0—10 cm的样品。推测其原因可能是表层沉积物受流动水体的干扰最为直接,养殖活动带入的有机物等也主要聚集在沉积物表层,使表层沉积物中微生物的多样性明显下降。
综上所述,本研究将T-RFLP技术和16S rRNA基因文库的方法相结合,发现近海网箱养殖活动不但使象山港沉积物Eh、pH等理化性质有所改变,而且使细菌的群落结构也发生了变化,降低了细菌群落的多样性和均匀度。
[1] He Y Q,Zheng Q H,Wen W Y,Zhang Y Y.A study on seawater environment affected by cage mariculture in Daya bay.Tropic Oceanology,1996,15(2):22-27.
[2] Nogales B,Lanfranconi M P,Piña-Villalonga J M,Bosch R.Anthropogenic perturbations in marine microbial communities.FEMS Microbiology Reviews,2011,35(2):275-298.
[3] Xu Y J,Qian L M.Impacts of cage culture on marine environment.Chinese Journal of Applied Ecology,2004,15(3):532-536.
[4] Wu R S S.The environmental impact of marine fish culture:towards a sustainable future.Marine Pollution Bulletin,1995,31(4/12):159-166.
[5] Yoza B A,Harada R M,Nihous G C,Li Q X,Masutani S M.Impact of mariculture on microbial diversity in sediments near open ocean farming of Polydactylus sexfilis.Ecological Indicators,2007,7(1):108-122.
[6] Gyllenhammar A,Hakanson L.Environmental consequence analyses of fish farm emissions related to different scales and exemplified by data from the Baltic-a review.Marine Environmental Research,2005,60(2):211-243.
[7] Kondo R,Kawahara N,Shigematsu K,Miyada T.Comparison of bacterial communities in fish farm sediments along an organic enrichment gradient.Aquaculture,2009,287(1/2):107-113.
[8] Agersø Y,Bruun M S,Dalsgaard I,Larsen J L.The tetracycline resistance gene tet(E)is frequently occurring and present on large horizontally transferable plasmids in Aeromonas spp.from fish farms.Aquaculture,2007,266(1/4):47-52.
[9] Nonaka L,Ikeno K,Suzuki S.Distribution of tetracycline resistance gene,tet(M),in Gram-positive and Gram-negative bacteria isolated from sediment and seawater at a coastal aquaculture site in Japan.Microbes and Environments,2007,22(4):355-364.
[10] Tamminen M,Karkman A,Corander J,Paulin L,Virta M.Differences in bacterial community composition in Baltic Sea sediment in response to fish farming.Aquaculture,2011,313(1/4):15-23.
[11] Caruso G,Genovese L,Mancuso M,Modica A.Effects of fish farming on microbial enzyme activities and densities:comparison between three Mediterranean sites.Letters in Applied Microbiology,2003,37(4):324-328.
[12] Magot M,Ollivier B,Patel B K.Microbiology of petroleum reservoirs.Antonie van Leeuwenhoek,2000,77(2):l03-116.
[13] Dang H Y,Song L S,Li T G,Qin Y S.Progresses in the studies of subsea floor deep biosphere microorganisms.Advances in Earth Science,2005,20(12):1306-1313.
[14] Liu J J,Zeng J N,Chen Q Z,Jian Z B,Zhao Y Q,Liao Y B,Shou L,Xu X Q,Huang Y J,Du P.The bacterial ecological distribution in water and sediment of cage culture area in Xiangshangang Bay.Acta Ecologica Sinca,2010,30(2):377-388.
[15] Amann R I,Ludwig W,Schleifer K H.Phylogenetic identification and in-situ detection of individual microbial cells without cultivation.Microbiology and Molecular Biology Reviews,1995,59(1):143-169.
[16] Parkes R J,Cragg B A,Wellsbury P.Recent studies on bacterial populations and processes in subseafloor sediments:a review.Hydrogeology Journal,2000,8(1):11-28.
[17] Liu Z,DeSantis T Z,Andersen G L,Knight R.Accurate taxonomy assignments from 16S rRNA sequences produced by highly parallel pyrosequencers.Nucleic Acids Research,2008,36(18):e120,doi:10.1093/nar/gkn491.
[18] Costello E K,Lauber C L,Hamady M,Fierer N,Gordon J I,Knight R.Bacterial community variation in human body habitats across space and time.Science,2009,326(5960):1694-1697.
[19] Turnbaugh P J,Hamady M,Yatsunenko T,Cantarel B L,Duncan A,Ley R E,Sogin M L,Jones W J,Roe B A,Affourtit J P,Egholm M,Henrissat B,Heath A C,Knight R,Gordon J I.A core gut microbiome in obese and lean twins.Nature,2009,457(7228):480-484.
[20] Liu W T,Marsh T L,Cheng H,Forney L J.Characterization of microbial diversity by determining terminal restriction fragment length polymorphisms of genes encoding 16S rRNA.Applied and Environment Microbiology,1997,63(11):4516-4522.
[21] Marsh T L.Terminal restriction fragment length polymorphism(T-RFLP):an emerging method for characterizing diversity among homologous populations of amplification products.Current Opinion in Microbiology,1999,2(3):323-327.
[22] Fierer N,Jackson R B.The diversity and biogeography of soil bacterial communities.Proceedings of the National Academy of Sciences,2006,103(3):626-631.
[23] Huber J A,Mark Welch D B,Morrison H G,Huse S M,Neal P R,Butterfield D A,Sogin M L.Microbial population structures in the deep marine biosphere.Science,2007,318(5847):97-100.
[24] Spellerberg I F,Fedor P J.A tribute to Claude Shannon(1916—2001)and a plea for more rigorous use of species richness,species diversity and the‘Shannon-Wiener'Index.Global Ecology and Biogeography,2003,12(3):177-179.
[25] Ludwig W,Strunk O,Westram R,Richter L,Meier H,Yadhukumar,Buchner A,Lai T,Steppi S,Jobb G,Förster W,Brettske I,Gerber S,Ginhart A W,Gross O,Grumann S,Hermann S,Jost R,König A,Liss T,Lüßmann R,May M,Nonhoff B,Reichel B,Strehlow R,Stamatakis A,Stuckmann N,Vilbig A,Lenke M,Ludwig T,Bode A,Schleifer K H.ARB:a software environment for sequence data.Nucleic Acids Research,2004,32(4):1363-1371.
[26] Cotner J B,Biddanda B A.Small players,large role:microbial influence on biogeochemical processes in pelagic aquatic ecosystems.Ecosystems,2002,5(2):105-121.
[27] Xi F,Zheng T L,Jiao N Z,Zhang Y.A preliminary analysis of mechanism of deep sea microorganisms diversity.Advances in Earth Science,2004,19(1):38-46.
[28] Tourna M,Freitag T E,Nicol G W,Prosser J I.Growth,activity and temperature responses of ammonia-oxidizing archaea and bacteria in soil microcosms.Environmental Microbiology,2008,10(5):1357-1364.
[29] Zhou J,Lei T.Review and prospects on methodology and affecting factors of soil microbial diversity.Biodiversity Science,2007,15(3):306-311.
[30] Temudo M F,Muyzer G,Kleerebezem R,van Loosdrecht M C M.Diversity of microbial communities in open mixed culture fermentations:impact of the pH and carbon source.Applied Microbiology and Biotechnology,2008,80:1121-1130.
[31] Tanner J E,Fernandes M.Environmental effects of yellowtail kingfish aquaculture in South Australia.Aquaculture Environment Interactions,2010,1(2):155-165.
[32] Sims J L,Patrick W H Jr.The distribution of micronutrient cations in soil under conditions of varying redox potential and pH.Soil Science Society of America Journal,1978,42:258-262.
[33] Stam M C,Mason P R D,Pallud C,van Cappellen P.Sulfate reducing activity and sulfur isotope fractionation by natural microbial communities in sediments of a hypersaline soda lake(Mono Lake,California).Chemical Geology,2010,278(1/2):23-30.
[34] Böre S I,Hedtkamp S I C,van Beusekom J E E,Fuhrman J A,Boetius A,Ramette A.Time-and sediment depth-related variations in bacterial diversity and community structure in subtidal sands.The ISME Journal,2009,3(7):780-791.
参考文献:
[1] 何悦强,郑庆华,温伟英,张银英.大亚湾海水网箱养殖与海洋环境相互影响研究.热带海洋,1996,15(2):22-27.
[3] 徐永健,钱鲁闽.海水网箱养殖对环境的影响.应用生态学报,2004,15(3):532-536.
[13] 党宏月,宋林生,李铁刚,秦蕴珊.海底深部生物圈微生物的研究进展.地球科学进展,2005,20(12):1306-1313.
[14] 刘晶晶,曾江宁,陈全震,江志兵,赵永强,廖一波,寿鹿,徐晓群,黄逸君,杜萍.象山港网箱养殖区水体和沉积物的细菌生态分布.生态学报,2010,30(2):377-388.
[27] 席峰,郑天凌,焦念志,张瑶.深海微生物多样性形成机制浅析.地球科学进展,2004,19(1):38-46.
[29] 周桔,雷霆.土壤微生物多样性影响因素及研究方法的现状与展望.生物多样性,2007,15(3):306-311.

