结石患者和健康对照者尿微晶生长、聚集过程的比较研究
柳一鸣 夏志月 欧阳健明*, 贾丽萍 张广娜 丁一鸣
(1湖南理工学院化学化工学院,岳阳 4 140001)
(2暨南大学生物矿化与结石病防治研究所,广州 5 10632)
泌尿系结石(简称尿石)已经成为威胁人类健康的一种常见病、多发病[1-2],目前对其预防还没有十分有效的方法,结石形成的机制尚不清楚[3-4]。尿石的主要成分有草酸钙、磷酸钙、尿酸、磷酸铵镁、胱氨酸等,其中约80%为含钙结石[5]。
尿石形成包括尿石晶体的成核、生长、聚集和粘附等过程[6-7]。尿液中病理性微晶(微米级)滞留在肾脏中后,会继续生长和/或聚集,最终形成结石(毫米级)。因此,尿微晶与尿石存在着密切的关系。尿液中某种晶体消失,此类尿石复发的倾向就减小;而尿微晶持续或重新出现常常预示着成石活跃或结石病复发[6,8]。有报道[9]表明,即使在健康人尿液中,尺寸大于5μm的微晶亦多达78 000 mL-1。结石患者尿液中尺寸大于12μm的微晶数目占尿液中微晶总数的16%~65%,而健康人尿液中大于12μm的微晶仅占尿微晶的13%以下,从而得出结石患者尿液中的微晶更易沉积在肾小管或尿路狭窄部位形成结石。
尿液中存在抑制尿石盐生长的物质,包括尿小分子(如柠檬酸盐、焦磷酸盐等)和尿大分子[如酸性粘多糖(GAGs)、肾钙素、凝血酶原片段1、骨桥蛋白(OPN)、肌醇六磷酸、蛋白质总量和TH蛋白等],它们大多为阴离子。正常人和尿石病人尿液中的上述抑制剂不仅在浓度上存在差异,而且在结构和活性上存在差异[10-11]。
本文比较研究了健康人尿微晶与结石患者尿微晶的生长过程,找出了其中的差异,期望为探索尿石形成机理、预防尿石形成提供启示。
1 实验部分
1.1 仪器和试剂
XL-30型环境扫描电子显微镜SEM(Philips公司)。X射线粉末衍射仪(D8FOCUS,德国Bruker公司)。CaCl2和Na2Oxa等化学试剂均为分析纯,购自上海化学试剂公司。配制20 mmol·L-1的CaCl2和Na2Oxa贮备液。
1.2 尿样收集和处理
(1)标本来源:收集暨南大学第一附属医院碎石中心主要组分为CaOxa的结石患者的新鲜晨尿5例,其中男3名,女2名,年龄32~58岁,平均年龄44.2岁;5名对照者为无结石病史的健康体检者,来自暨南大学师生,其中男3名,女2名,年龄22~53岁,平均年龄 41.6 岁。
(2)尿样处理方法:收集新鲜晨尿后,立即加入2%(质量分数)的叠氮化钠溶液防腐 (加入量为10 mL·L-1尿液),一部分尿液用于检测其中的Ca2+和Oxa2-浓度;另一部分在常温下离心15 min(4 000 r·min-1),除去细胞碎片,然后加入相当于尿液体积20%的 0.15 mol·L-1的 NaCl溶液稀释尿液,备用。
1.3 尿液中Ca2+、Oxa2-、柠檬酸盐和葡胺聚糖(GAGs)含量检测
分别采用火焰原子吸收光谱法、高锰酸钾褪色法、阿利辛蓝比色法和偏钒酸铵活化催化动力学光度法[12-14]测定上述5例结石患者和5例对照者尿液中的钙、草酸根(Oxa2-)、柠檬酸盐和GAGs的含量,结果见表1,结石患者和对照者之间均存在显著性差异(p<0.05)。

表1 五例健康者和五例患者尿液中的Ca2+、Oxa2-、柠檬酸盐、GAGs和OPN浓度Table 1 Concentrations of Ca2+,Oxa2-,citrate,GAGs and OPN in urines of 5 patients with renal stones and 5 healthy subjects
1.4 尿微晶生长动力学研究
在上述两类稀释尿液中加入浓度为20 mmol·L-1的CaCl2和Na2Oxa溶液,加入量根据原尿中Ca2+L-1;然后分为数份,放入50 mL的培养皿中,在每个培养皿底部预先放置3片洗净的石英基片,置入37℃的恒温箱中,让尿液慢慢挥发析出晶体,并在放置时间t=1、8和48 h时各取出1片基片,用蒸馏水小心洗去基片表面的尿液,在真空干燥器中干燥1 d后,用XRD分析微晶的组分,用SEM检测微晶的形貌和尺寸;在统计微晶尺寸和数量时,各选择4个代表性的微晶区域 (面积均为1 mm×1 mm),取平均值。实验平行2次。
1.5 统计学
应用SPSS16.0统计软件进行统计学分析,分别采用单因素方差分析,计量资料采用(x±t)表示,组间比较用SNK法和LSD法。
2 结果与讨论
2.1 结石患者和对照者尿微晶的生长动力学差异
表2列出了CaOxa结石患者和对照者尿微晶在生长不同时间后的尺寸和数量变化,其代表性SEM图片见图1和图2。可以看出,两类尿微晶的生长存在如下差异:
(1)尿微晶尺寸随时间的变化差异
随着生长时间 (t)从1 h增加到8 h和48 h,CaOxa结石患者尿液中的微晶尺寸显著增大,如t=1 h 时微晶尺寸约为(6±4)μm(图 1a),t=8 h 时,其尺寸增加至(11±8)μm(图 1b),而 t=48 h 时(图 1c),增加至(29±17)μm,大部分尿微晶的尺寸在20μm以上,晶体的聚集程度增加。这说明,在结石患者尿液中,CaOxa晶体的形成主要为生长控制,即:随着生长时间的延长,尿晶体尺寸不断增长。
相比之下,对照者尿微晶的结晶规律(图2)与结石患者有所不同。随着t从1 h增加到48 h,对照者的尿微晶尺寸缓慢增长,尺寸仅从(6±5)μm增加至(15±9)μm,绝大部分尿微晶尺寸仍然在20μm以下,微晶分布均匀。这说明,在对照者尿液中,微晶的生长过程同时为成核控制和生长控制。
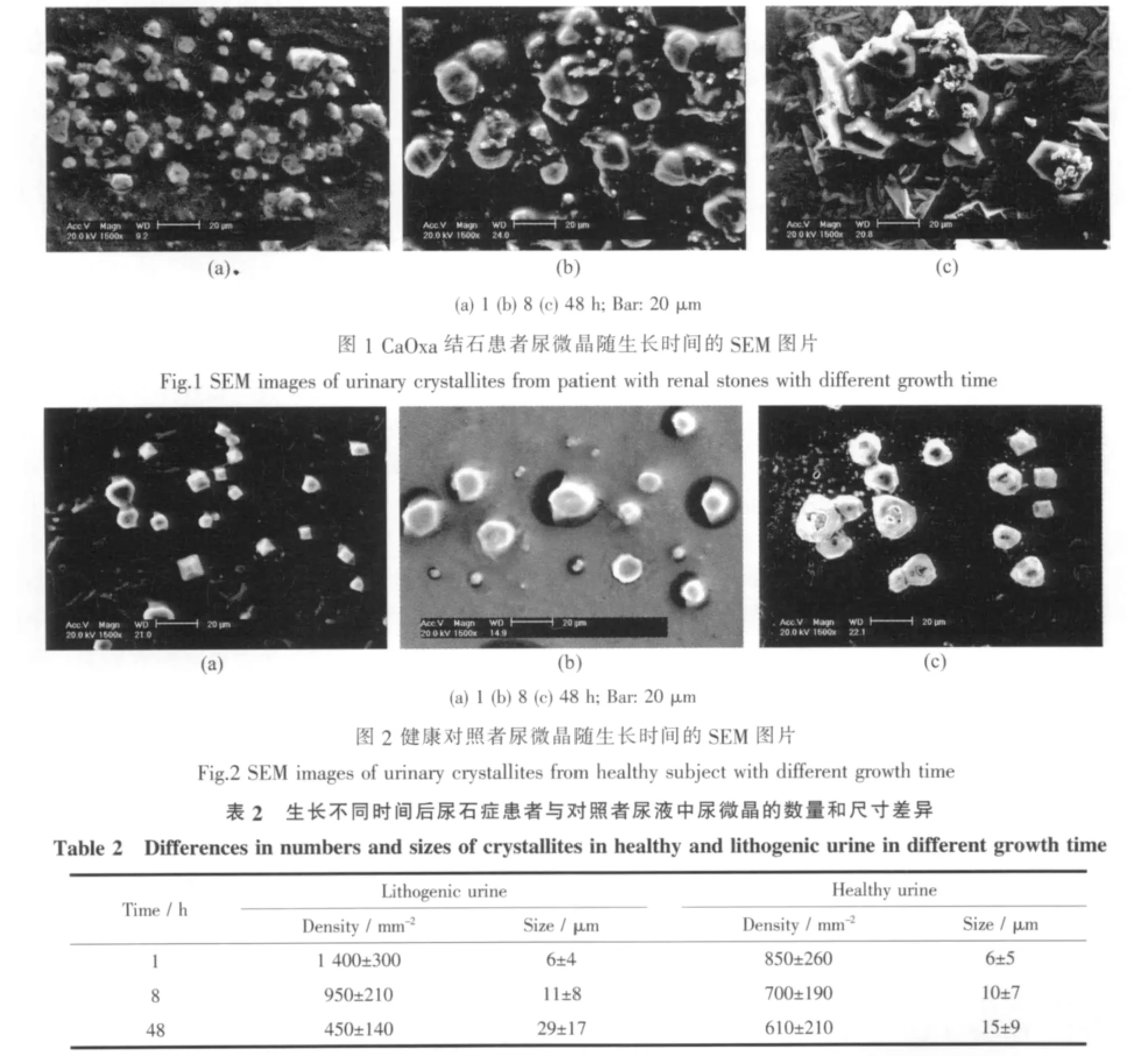
以前的报道[9,15-17]认为,结石患者的尿微晶尺寸显著大于对照者,如Tiselius[17]报道了CaOxa结石患者尿微晶的平均尺寸为4.57μm,大于正常人的4.47μm,并且结石患者尿微晶聚集明显比患者严重得多。Abdel-Halim等[16]研究了结石患者和对照者的新鲜晨尿及其放置6 h、24 h后的尿微晶,发现患者晨尿中出现结晶尿的频率(9.3%)比对照者(2%)的高,放置6 h两者的区别不大,而放置24 h后,患者尿样中出现结晶尿的频率增加到27.1%,显著大于对照者的12%;在患者尿样中,不管是晨尿还是放置24 h后尿液,均存在微晶聚集现象,但对照者尿液中没有。患者尿微晶的聚集存在两种情况:一种是不同微晶相互靠拢,形成大尺寸的微晶(如图1c,2a);另一种是小尺寸的微晶在大尺寸微晶的表明不断沉积(如图 3c)。
(2)尿微晶数密度随时间的变化差异
对于结石患者尿液,随着生长时间的延长,不但尿微晶尺寸显著增加,而且微晶数密度显著减少(表2),如在t=1、8和48 h时,其微晶数密度分别为(1 400±300)、(950±210)和(450±140)mm-2。 即:随着生长时间增加,患者尿液中的小尺寸微晶在不断消失,而大尺寸的尿微晶则进一步生长,特别是在t=48 h时,患者尿液中小尺寸的微晶显著减少。SEM结果(图1c)表明,的确在大尺寸的尿晶体表面有小尺寸的微晶沉积。
而对照者尿样在分别生长1、8和48 h后,其微晶数密度分别为(850±260)、(700±190)和(610±210)mm-2(表2),即:微晶数密度随生长时间增加而缓慢减少,尺寸则缓慢增加。
上述两类尿微晶的尺寸和数量变化规律可以从下面几个方面得到解释:
(1)根据尺寸-溶解度 (Gibbs-Thomson)关系式(1)[18],体系中粒径不同的粒子,在体系中的溶解度也不同。当分散于溶液中的粒子尺寸较小时,溶液中该粒子的溶解度c(r)会远远超过其正常的平衡饱和度值,即溶解度会显著提高,特别是当溶液中粒子的粒径r<1μm时,溶解度的增加更为明显。当小尺寸的尿微晶在尿液中溶解导致尿液过饱和后,尿液中的尿石盐组分又会沉积到尺寸较大的尿微晶表面上,致使尿液中尿石盐的过饱和度减小,然后尿液又进一步溶解其余的小尺寸粒子,如此反复的溶解-沉积-再溶解-再沉积过程,致使尿液中小尺寸的尿微晶慢慢消失,而大尺寸的尿微晶则不断长大。

式中c(r)为粒径为r的粒子的溶解度,c*为大粒子(r→∞)的平衡饱和度,M为溶液中固体的物质的量质量,γ为界面张力,ν为难溶电解质中的离子物质的量数 (对于非电解质,ν=1),R为气体常数,T为绝对温度,ρ为固体的密度,v(M/ρ)为固体溶解物的物质的量体积。
(2)由于尺寸较小的粒子的比表面积较大,即所处能态较高,尺寸较大的粒子则比表面积较小,即所处能态较低,而体系中的固相有调节自己以获得最小表面自由能的趋势,因此,许多小粒子易转化成大粒子而进入低能态,即小粒子会慢慢消失,而大粒子不断长大[19]。
从图1a可以看出,患者尿液中的粒子分布不均匀,大粒子和小粒子之间显著的比表面积差异和溶解度差异,使得小尺寸尿微晶随尿液放置时间逐渐消失,而大尺寸尿微晶逐渐长大(图1b,1c);同时,由于小尺寸微晶不断溶解、消失,导致尿微晶总数随尿样放置时间的增加而减少(表2)。
而对照者的尿微晶尺寸较为均匀(图2a),大、小粒子之间的比表面积和溶解度差异均比患者的小,即:粒子间的相互作用力和表面自由能差异较小,发生聚集的驱动力也减小,使得对照者尿液体系较为稳定,因而不容易结晶生成大尺寸的晶体粒子。
(3)归因于结石患者尿液中的抑制剂(包括尿大分子和尿小分子)浓度和活性均比对照者的显著降低[20-21]。在我们研究的5例对照者和5例患者尿液中,GAGs的含量分别为 (8.80±1.92) 和 (5.18±1.19)mg·L-1(表 1),柠檬酸盐的含量分别为(228±123)和(153±79)mg·L-1。尿抑制剂的浓度降低后,其与Ca2+离子的配位能力减小,导致患者尿液中Ca2+离子的扩散系数(D)增加,故在患者尿液中含Ca2+尿石盐(如CaOxa、磷酸钙等)的生长速度比在对照者尿液中的增加,产生的尿石盐微晶尺寸比对照者的大。有关结石患者尿液中的尿大分子与对照者的差异,在本文的后半部分还将详细讨论。
上述结果(图1和2)可从理论上解释为什么对照者不形成结石而患者可以形成结石:对于患者,随着每日Ca2+和Oxa2-等尿石盐组分的摄入,尿石盐(如CaOxa等)晶体会在尿液中不断长大,从而形成大体积的微晶粘附在尿路的细胞上,最终形成结石;而在对照者尿液中,Ca2+和Oxa2-等尿石盐组分的摄入对微晶尺寸的贡献不很明显(图2),由于大量中、小尺寸的尿微晶容易随尿液而排出体外,因而不易形成结石。
2.2 结石患者与对照者尿微晶的差异
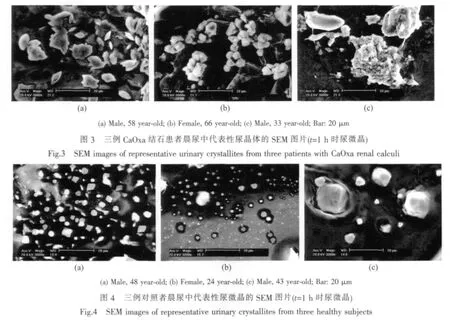
图3和4分别为结石患者和对照者在t=1 h时尿微晶的SEM照片,比较可以看出如下差异:
(1)形貌和聚集状态
结石患者尿微晶(图3)存在如下3个明显的特征:(a)棱角尖锐;(b)聚集的微晶较多;(c)可见一些小晶体沉积在大晶体上。
相比之下,对照者尿微晶存在3个与患者近似相反的特征:(a)尿微晶棱角较为圆钝;(b)聚集的晶体较少;(c)大晶体表面再次沉积小晶体的现象较少。
对5例结石患者和5例对照者的尿微晶的统计表明,在对照者的微晶中,90%的微晶粒径小于20μm,而结石患者的尿微晶从1μm到220μm不等,大尺寸微晶显著多于对照者。患者尿微晶尺寸增加的重要原因之一是聚集所致。
两类尿微晶的这种形貌和聚集差异与这两类尿液中存在的抑制剂(包括尿大分子、尿小分子)物种、浓度和活性密切相关。虽然尿液过饱和(导致了尿微晶形成)是尿石形成的先决条件,然而,结石患者和对照者的尿草酸钙均为过饱和,表1列出了本文所研究的5例患者和对照者尿液中Ca2+和Oxa2-的浓度。因此,对微晶形貌和聚集起重要作用的是尿液中存在的抑制剂浓度及其活性,包括GAGs、TH 蛋白、骨桥蛋白(OPN)、尿桥蛋白、肾钙素(NC)、凝血酶原激活肽F1片段(UPTF1)等[9,10,20-24]。这些尿大分子大都带有阴离子基团或阴离子侧链,它们抑制CaOxa成核、生长和聚集的能力大小取决于其分子的结构、浓度和对尿微晶晶面位点的识别情况等[24]。例如,OPN更容易识别尿液中的二水草酸钙(COD)晶体并与之结合;而UPTF1则更容易识别一水草酸钙(COM)晶体。尿大分子的这种选择性与尿液中的钙浓度也有很大关系[23-24]。与结石患者相比,对照者尿液中含有的这些物质不但种类较多,浓度较大,而且活性较强,如对照者尿液中的葡胺聚糖(GAGs)含量为(8.80±1.92)mg·L-1,明显高于草酸钙结石患者(5.18±1.19)mg·L-1(见表 1);柠檬酸盐含量((228±123)mg·L-1)亦比结石患者的((153±79)mg·L-1)高(文献[25]结果分别为(264±144)mg·L-1和(202±142)mg·L-1)。同样,对照者尿液中骨桥蛋白(OPN)含量(88.79±35.28)mg·L-1也比结石患者 (35.77±27.92)mg·L-1高得多[20]。
这些尿大分子和柠檬酸盐与Ca2+离子之间存在配位作用,例如Wesson等[26]研究发现,OPN通过其羧基和磷酸基位点与COM中含Ca2+丰富的[100]、[120]、[010]晶面作用,从而抑制COM的形成和聚集;OPN还能以多聚天冬氨酸序列(ploy-Asp(86-93))与COD晶面Ca2+结合[22],促进COM向COD转化,而COD与肾上皮细胞的粘附能力小,易随尿液排除体外[23],从而减少结石的生成。Mustafi等[27]研究发现,每微摩尔硫酸软骨素二糖单位可与0.757μmol游离Ca2+结合,而NC可以通过γ-羧基谷氨酸中的氧原子与 Ca2+离子以4∶1定量结合;UPTF1的N-末端区域有10个谷氨酸残基,对Ca2+的结合能力大小与谷氨酸上的γ-羧基化程度成正比[28]。特别是柠檬酸盐,不但可与钙离子配位形成可溶性的配合物柠檬酸钙,而且可以封闭CaOxa生长的活性位点,抑制CaOxa的成核和生长,此外,柠檬酸盐还可以诱导二水草酸钙(COD)和三水草酸钙(COT)形成,而COD和COT的形成可以减小CaOxa结石形成的危险性[29]。
因此,在对照者尿液中,这些抑制剂可与尿液中CaOxa微晶表面上的Ca2+离子存在配位-离解平衡,在这个动态过程中,CaOxa晶体表面上的Ca2+离子(尤其是在晶体周边的Ca2+离子)不断被上述尿大分子所溶解,溶解后的Ca2+离子同时也不断地沉积到CaOxa晶面上,这种永不停止的溶解-沉积作用使得对照者尿液中的微晶棱角较为圆钝,甚至可以看到晶体表面亦有被溶解的现象(图2c)。而结石患者尿液中因为缺少这些抑制剂或者其浓度较低,CaOxa晶体的沉淀-溶解动态平衡要弱得多,因此微晶的棱角较尖锐(图1c)。
(2)组分差异
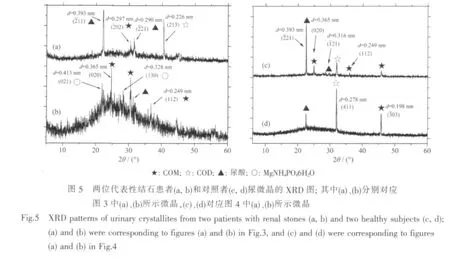
从SEM的形貌可以看出,患者尿微晶中有较多的COM 晶体(图 1a,1b,图 3),对照组中则有四方锥形的COD晶体(图2a,图4b)。采用XRD图对尿微晶进行了进一步的表征,结果如图5所示,其中图5a、5b分别为图 3a、3b患者尿微晶的XRD图,图5c、5d为对应图4a、4b的对照组尿微晶的XRD图。与标准XRD图比较,出现在d=0.365、0.297、0.249和0.198 nm的衍射峰归属于COM的 (020)、(202)、(112)和(303)晶面,d=0.393、0.316 和 0.290 nm 归属于尿酸的(211)、(121)和(221)面,d=0.413 和 0.328 nm归属于 MgNH4PO4·6H2O 的(021)和(130)面,d=0.278和0.226 nm归属于COD的(411)和(213)晶面。这表明,结石患者尿微晶主要为COM、COD、尿酸和MgNH4PO46H2O,而对照组尿微晶主要为尿酸、COD和COM等。
由于COM晶体与肾小管细胞的接触程度比COD更大[30],即COM与肾小管细胞表面有更强的结合力。理论计算也表明[31],COM的确比COD对细胞膜有更强的亲合力,因此,COD晶体将比COM晶体更容易随尿液排出体外.如能生成更多的COD晶体,将有利于预防尿石的形成。
图5b的基线较高,可能是以下原因造成:(1)由于尿微晶的量较少,导致背景干涉严重,玻璃峰相对增强;(2)尿液中的无定形物质(如细胞碎片等)与尿微晶共同沉淀;(3)一些微晶的结晶度不高,特征峰表现较弱,使得仪器噪音看起来会比较明显。
3 结 论
CaOxa结石患者与健康对照者的尿微晶及其生长过程均存在差异。对照者尿液中90%的微晶小于20μm,尺寸较为均一;而患者尿微晶尺寸差异大,从1μm到220μm不等,大尺寸的微晶显著多于对照者尿液。对照者尿微晶多为圆形或椭圆形,而患者的尿微晶棱角尖锐,微晶的聚集程度远大于对照者。患者尿微晶中COM的含量明显比对照者的多。患者尿微晶的形成过程为生长控制,即随着生长时间增加,尿微晶的尺寸不断增大,数量减少,且出现聚集现象;而对照者尿微晶的生长过程同时为成核控制和生长控制。上述差异归因于两类尿液中的抑制剂浓度及其活性存在差异。
[1]Yu SL,Gan X G,Huang J M,et al.J.Urol.,2011,186(3):1114-1120
[2]Yao X Q,Ouyang J M,Peng H,et al.Carbohydr.Polym.,2012,90(7):392-398
[3]Chaiyarit S,Thongboonkerd V.J.Proteome Res.,2012,11(6):3269-3280
[4]Zhang S,Su Z X,Yao X Q,et al.Mater.Sci.Eng.C-Mater.Biol.Appl.,2012,32:840-847
[5]LI Jun-Jun(李君君),HOU Shan-Hua(侯善华),XIA Zhi-Yue(夏志月),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2012,28(2):245-250
[6]Daudon M,Hennequin C,Boujelben G,et al.Kidney Int.,2005,67:1934-1943
[7]Peng H,Ouyang J M,Yao X Q,et al.Int.J.Nanomed.,2012,7(8):4727-4737
[8]Daudon M,Jungers P.Nephron.Physiol.,2004,98:31-36
[9]Robertson W G,Peacock M,Marshall R W,et al.New England J.Med.,1976,294(5):249-252
[10]Poon N W,Gohel M D I.Carbohydr.Res.,2012,347:64-68
[11]Lauren A,Thurgood·Phulwinder K.,Ryall R L.Urol Res.,2008,36:103-110
[12]BAI Yu(白钰),OYYANG Jian-Ming(欧阳健明),BAI Yan(白燕),et al.Spectrosc.Spectr.Anal.(Guangpuxue Yu Guangpu Fenxi),2004,24(8):1016-1019
[13]CHEN Jun-Hao,GU Guang-Yu,WANG Yi-Li.J.Clin.Lab.Sci.(Linchuang Jianyan Zazhi),1999,5(17):266-267
[14]Poon N,Gohel M D I.Carbohydr.Res.,2012,347(1):64-68
[15]Daudon M,Cohen-Solal F,Barbey F,et al.Urol.Res.,2003,31:207-211
[16]Abdel-Halim R E.J.Urol.Nephrol.,1993,27:145-149
[17]Tiselius H G,Hallin A,Lindback B.Urol.Res.,2001,29(2):75-82
[18]Mullin JW.Crystallization.London:Butterworth Heinemann,2000:102-288
[19]Wang G,Liu T,Xie X L,et al.Mater.Chem.Phys.,2011,3(128):336-340
[20]Schwille PO,Schmiedl A,Fan J,et al.Urol.Res.,1999,27:117-126
[21]Lee T,Lin Y C.Cryst.Growth Des.,2011,11(7):2973-2992
[22]Chien Y C,Masica D L,Gray J J,et al.J.Biol.Chem.,2009,284(35):23491-23501
[23]Langdon A,Wignall G R,Rogers K,et al.Calcd.Tiss.Int.,2009,84(3):240-248
[24]Jung T S,Sheng X X,Choi C K,et al.Langmuir,2004,20:8587-8596
[25]Michelacci Y M,Glashan R Q,Schor N.Kidney Int.,1989,36:1022-1028
[26]Wesson J A,Ganne V,Beshensky A M,et al.Urol.Res.,2005,33(3):206-212
[27]Mustafi D,Nakagawa Y,Makinen M W.Cell Mol.Biol.,2000,46(8):1345-1360
[28]Buchholz N P,Kim D S,Grover P K.J.Bone Miner.Res.,1999,14(6):1003-1012
[29]Mechlin C,KalorinC,Asplin J,et al.J.Endourol.,2011,25(9):1541-1545
[30]Lieske JC,Leonard R,Toback F G.Am.J.Physiol.,1995,4(268):604-612
[31]Mandel N.J.Am.Soc.Nephrol.,1994,5(5):S37-45

