对高中化学“三热”表示方法的分析与探讨
刘均照,张英锋,马子川
(1.秦皇岛市第一中学,河北 秦皇岛 066006;2.河北师范大学化学与材料科学学院,河北 石家庄 050016)
在高中新课程标准教科书中,增加了焓变的概念,即恒压热效应。课本中也给出了明确的说明:当ΔH为“-”或 ΔH<0时,为放热反应;当 ΔH 为“+”或 ΔH>0时,为吸热反应[1]。由于在燃烧热和中和热的表示方法上,教科书只是在用焓变表示反应热时遵守了这一惯例,但在用语言叙述时恰恰没有遵守这个惯例,故不同版本教科书,甚至高考题中都出现了分歧和混淆现象。
一、教科书中的表示方法
(一)燃烧热
什么是燃烧热?对于这个问题人教版(人民教育出版社出版)和苏教版(凤凰教育出版社出版)教科书都给出了定义。人教版选修4第7页“101kP时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。”[1]从定义中我们能看出,表示的放出的热量。所以在表示方法上可以有两种形式。如果用ΔH表示应该带着正负号;如果直接用数值表示可以不带正负号比较。但是在教师用书中给的课后题的参考答案无论用ΔH表示还是直接说明数值都带着正负号,比如化学选修4教师教学用书第20页“已知CH4的燃烧热为-889.6kJ/mol”[2]类似的话在后面的补充习题中也有出现。可见新教科书中已经明确把燃烧热看成一种反应热,完全按照反应热的要求去表示。
而苏教版在第8页:“在101kP下,1mol物质完全燃烧的反应热叫做该物质的标准燃烧热[3]。”这里就是把燃烧热规定为反应热,而且成为标准燃烧热,这还是比较准确的,但是与人教版教科书定义上时有出入的。我认为其表示方法无论用ΔH还是直接说明都应该带着正负号,这也在后面的课后题中有所体现。苏教版化学选修4第28页本专题作业第4题的题干中出现了这样的语言:“已知天然气的主要成分为CH4,标准燃烧热为-890.3kJ·mol-1。煤气的种类较多,多为氢气、一氧化碳等的混合物,已知氢气的标准燃烧热为-285.8kJ·mol-1,一氧化碳的标准燃烧热为-283.0kJ·mol-1。”[3]
可见,不同版本的教科书对于燃烧热的定义有偏差,杨香涛,陈世明[4]就曾提出融合两种定义,提出:在101kP下,1mol纯物质完全燃烧生成稳定的物质时所放出的热量叫做标准燃烧热。笔者也比较赞同这种观点,这个定义即体现了与大学教课书的衔接,又有与原来知识的统一。
(二)中和热
对于中和热的定义,在人教版教科书必修2中提了出来:“酸与碱发生中和反应生成1molH2O时所释放的热量成为中和热。”[5]可以看出这也是作为释放放热量
在第29页有“一元强酸跟一元强碱中和时,中和热为-57.3kJ/mol”,[2]而在同一页的后面又出现了“1 molCH3COOH与1 mol NaOH溶液反应时,中和热是56.0kJ/mol”。[2]可见教师教学用书对于中和热的表示方法也没有重视,存在混淆使用情况。
二、高考题中的表示方法
燃烧热和中和热在高考题中表示方法屡屡出现,但是笔者搜集各省市的高考题时发现,各省市高考题中对于燃烧的考察标准并不一致。下面举近几年高考题例子加以分析。
(一)认同不带正负号高考试题
例1.(2009四川9)25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.2H+(aq)+SO42-+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1);ΔH=-57.3 kJ/mol
B.KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l);ΔH=-57.3 kJ/mol
C.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1);ΔH=-5518 kJ/mol
答案选B,中和热和燃烧热都没有带负号。
例2.(2008四川7)下列关于热化学反应的描述中正确的是
A.HCl和NaOH反映的中和热ΔH=-57.3 kJ/mol,则 H2SO4和 Ca(OH)2反映的中和热 ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=2×283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
答案选 B,CO(g)的燃烧热是 283.0 kJ/mol。不加正负号。四川省高考题连续两年出现相同的问题,可见认同的是燃烧热和中和热不带负号。
例3.(2006天津13)已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221 kJ/mol
②稀溶液中,H=(aq)+OH-(aq)=H2O(1);ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
答案选A,天津高考卷也认同燃烧热不带负号,中和热带负号错误。
例4.(2006重庆10)25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+1/2O2(g)=CO(g);ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);ΔH=+571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890.3 kJ/mol
D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);ΔH=-1400 kJ/mol
答案选D,题干所给数据燃烧热均不带负号,依次为 393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol。
除了选择题,在Ⅱ卷也有体现,比如2004年天津高考题第27题第I小题中“已知丙醛的燃烧热为1815 kJ/mol,丙酮的燃烧热为1719 kJ/mol,试写出丙醛燃烧的热化学方程式______________。”天津市高考题目中多次出项相同问题,同样处理为不带负号。在2009宁夏高考题的第28题第(5)小题“已知单质硫的燃烧热为 296 kJ·mol-1,计算由 S(s)生成 3 mol SO3(g)的ΔH________(要求计算过程)。”也同样未给出负号。
可见从四川省、重庆市、天津市对于燃烧热的表示方法认同不带正负号的情况,甚至宁夏(新课标卷)2009年的高考题中也出现类似的问题。
(二)认同带正负号高考试题
例5.(2011浙江12)下列说法不正确的是
A.已知冰的熔化热为6.0 kJ·mol-1,冰中氢键键能为 20 kJ·mol-1,假设 1 mol冰中有 2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为 α若加入少量醋酸钠固体,则CH3COOH⇌CH3COO-+H+向左移动,α减小,K变小
C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ·mol-1、-3747 kJ·mol-1和-3265 kJ·mol-1,可以证明在苯分子中不存在独立的碳碳双键
D.已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g),ΔH=+489.0 kJ·mol-1
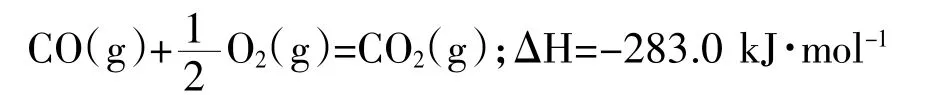
C(石墨)+O2(g)=CO2(g);ΔH=-393.5 kJ·mol-1
则 4Fe(s)+3O2(g)=2Fe2O3(s);ΔH=-1641.0 kJ·mol-1
答案选B,题目中C选项作为正确选项处理,即标准燃烧热应该带负号。
例6.(2010浙江卷12)下列热化学方程式或离子方程式中,正确的是
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1
B.500℃、30MPa下,将 0.5mol N2和 1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)ΔH=-38.6 kJ·mol-1
C.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O=2Al(OH)3
答案选C,浙江省连续两年出现标准燃烧热的问题都处理为带负号,另外浙江省使用苏教版教科书,其试卷也与其教科书一致。
例7.(2010全国2·7)下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa):
①C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(l)ΔH=-2878 kJ/mol
②C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(g)ΔH=-2658 kJ/mol
③ C4H10(g)+9/2O2(g)=4CO(g)+5H2O(l) ΔH=-1746 kJ/mol
④ C4H10(g)+9/2O2(g)=4CO(g)+5H2O(g)ΔH=-1526 kJ/mol
由此判断,正丁烷的燃烧热是
A.-2878kJ/mol B.-2658kJ/mol
C.-1746kJ/mol D.-1526kJ/mol
答案选A,从这个题目可以看出,全国2卷也认同带负号处理燃烧热。
例 8.(2008 宁夏 13) 已知 H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8 kJ·mol-1、-1411.0 kJ·mol-1和-1366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成 C2H5OH(l)的 ΔH 为
A.-44.2kJ·mol-1 B.+44.2kJ·mol-1
C.-330kJ·mol-1 D.+330kJ·mol-1
答案选A,宁夏卷(新课标卷)题干的要求看又是认同燃烧热是带负号。
同样的,除了选择题,这样的情况在Ⅱ卷也有体现,比如在2011全国高考新课标试卷中的第27的题的题干中出现这样的语言“已知H2(g)、CO(g)和CH3OH(l)的燃烧热 ΔH 分别为-285.8kJ·mol-1、-283.0 kJ·mol-1和-726.5kJ·mol-1。”2011 年的新课标卷(原宁夏卷)也是认同燃烧热带着负号,但是宁夏卷2008、2009、2011三年都出现了燃烧热,但是表示方法却是不一致,这就出项较多的矛盾。
所以,不带负号是大家对概念侧重理解在“燃烧”放热,“中和”放热已成是事实,彼此心里都清楚;但当用ΔH表示时就必须按概念来了,这是意义上的“焓”了;带负号是大家从始至终就在用概念去制约它的应用,即把燃烧热和中和热作为反应热来处理。因而就出现了上述的不同的表示方法在高考题答案中都有对的时候,标准不统一。
三、大学《物理化学》教科书中的说法
据国际纯粹与应用化学联合会(IUPAC)1990年的推荐,体系吸热为正值,放热为负值,我国国家标准也已经采纳,这已经是热力学中的惯例。这在大学《物理化学》教科书中也有体现。
(一)《物理化学》中燃烧热的定义
在朱传征、许海涵主编的《物理化学》教科书第48页给燃烧热下了一个定义:“1mol的物质在指定条件下完全燃烧时放出的热量称为燃烧热。所谓燃烧热是指产物处于稳定的聚集状态”。“因而规定25℃ 1Pa下,1 mol处于稳定聚集态完全燃烧时所放出的热量称为该物质的标准燃烧热。”[6]
(二)《物理化学》中燃烧热的表示方法
在朱传征、许海涵主编的《物理化学》教科书中没有明确说明表示方法,但是在例题和课后习题中有所体现。比如在62页第21题“在25℃,Pθ时,丙烯腈(CH2=CHCN)、石墨和氢气的燃烧热分别为-1761 kJ·mol-1,-393.5kJ·mol-1和-285.9kJ·mol-1,[6]这道题目题干中的燃烧热一律带负号表示,体现了教科书对于燃烧热作为反应热的一个体现。
四、建议
根据上面的讨论可知,燃烧热和中和热作为反应热,是应该带着负号处理的。这也更有利于学生以后进入大学学习时,能更好的衔接大学与高中的知识,更有利于与国际接轨。
燃烧热和中和热不管是不是带负号,我们都可以理解。但是这个问题不管是要研究学问还是学生在高考中答题,都需要统一标准。所以希望课程标准、教科书、教师教学用书能有一个固定的,统一的标准,让所有的教师和学生就这个问题达成共识不至于在上述高考题的争议。
[1]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中课程标准实验教科书·化学选修4化学反应原理[M].北京:人民教育出版社,2007.
[2]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中课程标准实验教科书·化学选修4化学反应原理教师教学用书[M].北京:人民教育出版社,2007.
[3]王祖浩.普通高中课程标准实验教科书·化学,化学反应原理[M].南京:江苏教育出版社,2008.
[4]杨香涛,陈世明.对两种版本新课标教材中燃烧热概念的探讨[J].中学化学教学参考,2007(12).
[5]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中课程标准实验教科书·化学必修2[M].北京:人民教育出版社,2007.
[6]朱传征,许海涵.高等院校选用教材·物理化学(师范类)[M].北京:科学出版社,2004.

