盐度对内刺盘管虫受精、孵化及幼虫存活、变态的影响
曹善茂,刘瑞成,李校建,郝帅,徐赫
(大连海洋大学辽宁省省级高校海洋生物资源可持续利用重点实验室,辽宁大连116023)
内刺盘管虫Hydroides ezoensis Okuda隶属于环节动物门Annelida、多毛纲Polychaeta、龙介虫科Serpulidae、盘管虫属Hydroides,是中国北方海域的主要污损生物之一,其成虫终生营固着管栖生活,通常群栖,在中国北方沿海形成明显的种群优势。内刺盘管虫常附着在扇贝、鲍等生物的贝壳上,以及扇贝养成笼、网盘等养殖用具上,其危害主要体现在海水养殖生产及销售上。在养殖生产中与养殖动物争食夺饵,给养殖动物生长发育带来严重影响;附着在贝壳上,影响养殖贝类的品质,给贝类的销售造成损失;还附着在船底、码头、浮桥、柱桩等物体上,给航运业带来不利影响[1]。如何解决内刺盘管虫造成的巨大危害已成为一个急待解决的问题。国内外关于内刺盘管虫的研究已有报道,研究内容主要集中在内刺盘管虫的分类、胚胎发育、生长、发育、变态以及附着机理等[2-7]方面,有关盐度对其生命活动的影响则尚未见报道。
盐度作为一个主要的生态因子对各种海产生物的生长繁殖有重要的影响,本研究中作者主要探讨了在不同盐度条件下内刺盘管虫的胚胎发育及幼虫的生长、变态,以期为内刺盘管虫的生态防除提供科学依据。关于内刺盘管虫生态学方面的研究在国内尚处于起步阶段,国外相关的资料也很少。
1 材料与方法
1.1 材料
试验用内刺盘管虫成虫于2006年3月18日取自大连碧龙海珍品养殖公司鲍养殖网笼中的PCV隔板上,连同隔板一同运到大连市瓦房店沙山育苗场进行暂养。PCV隔板一共两块,虫体密度较大(图1)。取样时海水温度为 (4.5~4.6)℃。
1.2 方法
1.2.1 成虫 将成虫带回沙山育苗场后置于水圈中进行暂养,海水温度为4.5℃。经过19 d的暂养(3月20日至4月8日),将每块PCV隔板从水圈中取出,经清洗、去污后平均分割为4块,置于3个60 L的白塑料桶中进行人工性腺促熟。24 h连续充气,投喂单胞藻类,以新月菱形藻Nitzschia closterium为主,投饵量保持在30万个/(mL·d),每日投喂4次。每日全量换水1次。用控温电加热棒升温,每天0.5℃,达到19.5℃后保持恒温。不定期解剖虫体,观察精卵的发育情况。28 d后镜检发现卵呈棕黄色,卵径达62~64 μm,卵黄积累较好,开始进行试验。

图1 内刺盘管虫成虫Fig.1 Adult Hydroides ezoensis
1.2.2 盐度梯度的设置 试验用海水为沙滤自然海水 (盐度为32,pH 8.2),设定6个盐度梯度:20、25、30、32、35、40。每个梯度设置 3个平行,其中盐度为32的自然海水组作为对照组。高盐度海水用经过烧煮蒸发浓缩的海水与普通海水调配而成;低盐度海水使用蒸馏水与普通海水调配而成。用成都泰华光学有限公司生产的手持盐度折射仪测定盐度值并进行校对。
1.2.3 受精 将一定数量的性腺发育成熟的成虫剥去外壳,按一定雌雄比 (2∶1)分别放于水温为21.5℃的两个培养皿中,雌、雄虫立即排放精卵,随后进行人工授精。将受精卵置于800 mL玻璃烧杯中,密度为25~35个/mL,然后置于塑料水盆中,用控温电加热棒进行恒温控制 (21.5℃±0.5℃)。镜检发现受精卵释放出第一极体时即为受精。
1.2.4 孵化 将人工授精后的成虫置于一个2 L的烧杯中,密度为102个/mL,用300目筛绢网进行洗卵,除去多余的精子,镜检发现大部分受精卵出现二细胞时,将受精卵移至800 mL玻璃烧杯中,保证各盐度海水中受精卵的密度为20个/mL左右。镜检发现早期担轮幼虫时即为孵化。
1.2.5 幼虫 将人工授精后的成虫置于一个2 L的烧杯中,密度为106个/mL,用300目筛绢网进行洗卵。经过孵化形成早期担轮幼虫后将幼虫移至不同盐度的800 mL玻璃烧杯中,保证各盐度海水中担轮幼虫的密度在25个/mL左右,并开始投饵,每天投喂3次。担轮幼虫的饵料为盐藻Dunaliella salina和湛江等鞭金藻Isochrysis zhanjiangensis,密度分别为120万个/mL和350万个/mL。起始投饵量为0.5万个/(mL·d),随后每天增加 0.1万个/(mL·d),至投喂量为2.5万个/(mL·d)时不再增加。每天用300目筛绢网过滤出幼虫后,全量换水1次。24 h连续充气,水温为 (22.5±0.5)℃。每天定时观察,记录幼虫发育情况,在Olympus显微镜下用目微尺测定幼虫的体长和担轮直径,各样品随机测量幼虫15~20个,计算最大、最小和平均值。待幼虫出现三刚节后及时下附着基(清洗干净的海湾扇贝壳)。
1.2.6 计算公式
受精率=释放极体的受精卵数/总卵数×100%,
孵化率=担轮幼虫数/二细胞数×100%,
存活率=三刚节幼虫数/担轮幼虫数×100%,
变态率=附着幼虫数/三刚节幼虫数×100%。
1.3 数据处理
用Excel软件对数据进行处理,用SPSS 11.5软件进行单因素方差分析 (One-Way ANOVA)和Duncan多重比较,显著性水平设为0.05。
2 结果与分析
2.1 盐度对内刺盘管虫受精率的影响
从图2可见:内刺盘管虫的精卵在不同盐度的海水中都有较高的受精率,其中盐度为35的组内刺盘管虫的受精率最高 (96.67%±1.76%),盐度为32的对照组受精率次之 (95.57%±1.06%),盐度为20的组受精率最差 (82.23%±1.85%)。多重比较结果表明:盐度为25、30、32、35的组内刺盘管虫的受精率显著高于盐度为20和40的组(P<0.05),盐度为40的组受精率也显著高于盐度为20的组 (P<0.05),其余组间无显著性差异(P>0.05)。内刺盘管虫对高盐度海水环境的耐受性较强,而对低盐度海水环境的耐受性较弱。内刺盘管虫精卵受精的最适盐度为30~35,在此盐度范围内,内刺盘管虫具有很高的受精率。
2.2 盐度对内刺盘管虫孵化率的影响
从图2可见:盐度对内刺盘管虫的孵化率影响较大,其中盐度为32的对照组孵化率最高(85.68%±1.20%),盐度为20的组孵化率最低(62.03%±3.78%),各盐度组孵化率的大小依次为盐度32>盐度30>盐度35>盐度25>盐度40>盐度20。多重比较结果表明:盐度为25、30、32、35的组内刺盘管虫的孵化率显著高于盐度为20和40的组 (P<0.05),盐度为40的组孵化率也显著高于盐度为20的组 (P<0.05),其余组间无显著性差异 (P>0.05)。

图2 不同盐度下内刺盘管虫的受精率和孵化率Fig.2 The fertility rate and hatching rate of Hydroides ezoensis at different salinities
2.3 盐度对内刺盘管虫生长及存活的影响
2.3.1 存活 从图3可见:盐度对内刺盘管虫的存活影响较大,在试验盐度范围内,内刺盘管虫存活率为10.82%~72.14%,存活率在盐度为25~35时较好,其中盐度为32的组存活率最高,盐度为35的组次之,盐度为40的组最低。多重比较结果表明:盐度为25、30、32、35的组内刺盘管虫的存活率显著高于盐度为20和40的组 (P<0.05),其余组间无显著性差异 (P>0.05)。
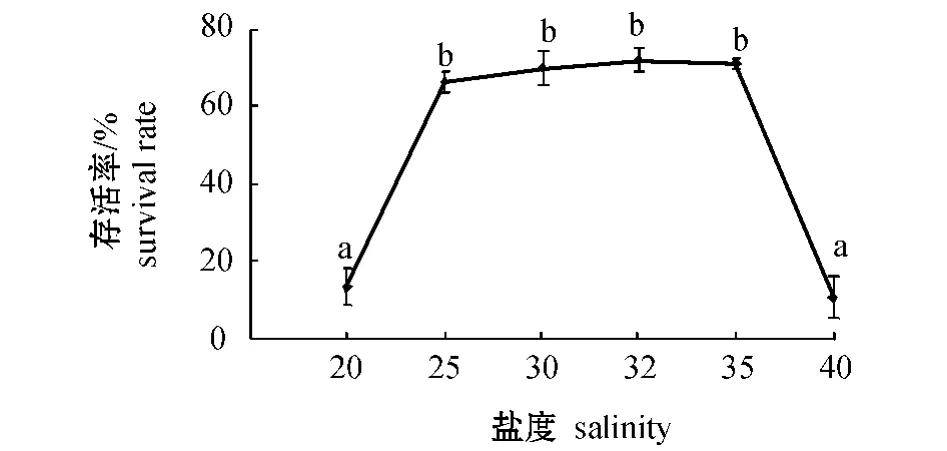
图3 不同盐度下内刺盘管虫的存活率Fig.3 The survival rate of Hydroides ezoensis at different salinities
2.3.2 担轮直径和体长 从图4可见:在试验盐度范围内,各盐度组幼虫担轮直径的变化规律基本上保持一致,呈“弧”型。盐度为32、35的组幼虫生长较为理想,盐度为20、40的组幼虫生长最差。担轮直径的最高值出现在盐度为35的组,达到 (207.58±9.37)μm,其次为盐度为32的组,担轮直径为 (201.28±11.94)μm。
从图4可见:在试验盐度范围内,幼虫在试验前期体长变化量差异不大,而后期差异逐渐明显。盐度为32、35的组幼虫生长较好,幼虫生长平稳且一直保持向上趋势,其中盐度为35时幼虫的生长情况最好,下附着基前最大体长达 (346.29±34.62)μm;盐度为20、40的组幼虫前期发育趋势较为缓慢,但其生长仍呈增长趋势,但盐度为40的组到后期的生长竟出现下降趋势。原因可能是过高的盐度导致幼虫的体细胞渗透失水,从而造成幼虫体积减小。10日内,盐度为35的组幼虫体长日增长量最大 (26.35 μm),盐为度32的组日增长量次之 (24.95 μm),盐度为40的组日增长量最小 (17.03 μm)。多重比较结果表明,第10天时盐度为40的组与其他各组有显著性差异 (P<0.05),其余组间无显著性差异 (P>0.05)。
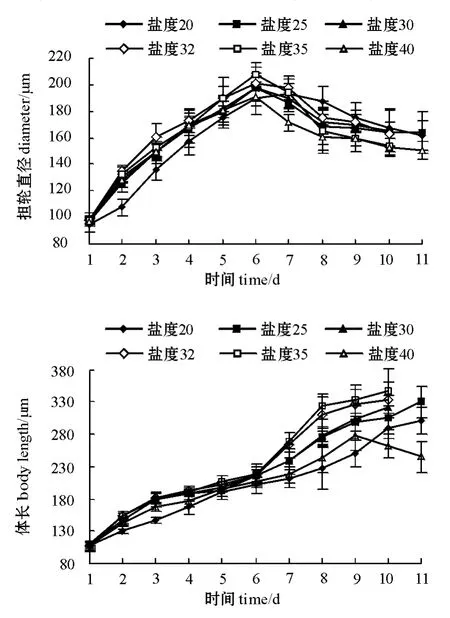
图4 不同盐度下内刺盘管虫幼虫担轮直径和体长随时间的变化Fig.4 The changes in diameter and body length of Hydroides ezoensis trochophore at different salinities and time
2.3.3 变态 从图5可见:盐度对内刺盘管虫的变态影响较大,在试验盐度范围内,内刺盘管虫的变态率为9.07%~63.45%,变态率在盐度为25~35时较好,其中盐度为32的组变态率最大,盐度为35的组次之,盐度为40的组最小。多重比较结果表明:盐度为25、30、32、35的组内刺盘管虫的变态率显著高于盐度为20和40的组 (P<0.05),其余组间无显著性差异 (P>0.05)。
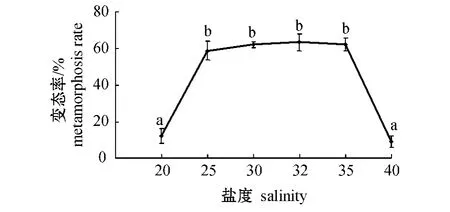
图5 不同盐度下内刺盘管虫幼虫的变态率Fig.5 The metamorphosis rate of Hydroides ezoensis at different salinities
3 讨论
3.1 盐度对内刺盘管虫受精、孵化的影响
内刺盘管虫的孵化是指从受精卵开始一直到卵破膜形成早期担轮幼虫的过程,是其生长的一个重要阶段。在这个时期里,内刺盘管虫的受精卵经历了二细胞、四细胞、八细胞、十六细胞、三十二细胞、多细胞、囊胚期、原肠期等多个发育阶段,因此,受精卵孵化率的高低对内刺盘管虫幼虫的成活具有重要的意义。
盐度是影响内刺盘管虫受精、孵化的重要因素之一。本研究结果表明,不同盐度的海水环境明显地影响内刺盘管虫的受精和孵化。内刺盘管虫受精的最适海水盐度范围为30~35,最佳受精盐度为35,这比正常海区的海水盐度偏高。
对于内刺盘管虫的孵化率而言,最适盐度范围为30~35,最佳孵化盐度为32。不同盐度对内刺盘管虫的孵化虽然有较大影响,但各盐度组仍然具有很高的孵化率。关于盐度对水产动物孵化率的影响有很多报道,郑忠明等[8]、沈伟良等[9]、梁玉波等[10]、陈冲等[11]分别研究了双齿围沙蚕、毛蚶、栉孔扇贝和文蛤在不同盐度下的孵化率,结果都表明盐度对孵化率会产生明显影响,但能够使这些动物有较高孵化率的盐度区间均没有内刺盘管虫大。这说明在长期的进化过程中,内刺盘管虫形成了对环境的强大适应能力和极强的繁殖能力,这也是内刺盘管虫能成为优势种的原因之一。
3.2 盐度对内刺盘管虫生长、存活和变态的影响
廖承义[4]认为,内刺盘管虫出现三刚节后,担轮幼虫便从浮游生活转入底栖生活,幼虫经常匍匐活动,栖息于培养器皿的底部。随后,幼虫的口前叶逐渐萎缩,并出现腮丝原基,此时幼虫经常以头部碰撞培养器皿的底壁,时而又恢复游泳活动去寻找另处底壁,这是幼虫附着前的特征。盐度是影响幼虫发育变态的主要因子之一,盐度高于或低于某一极限值,幼虫的生长发育大大延迟[12-15]。从本试验的6个盐度组比较来看,不管从幼虫的发育进程上还是从个体大小上,内刺盘管虫幼虫的生长有着十分明显的差异,特别是在盐度为20与40的海水环境中,幼虫均有比较多的畸形,生长、存活和变态率均明显低于其他盐度组。因此,盐度对于幼虫的发育、生长、变态是一个关键的生态因子,幼虫在适宜的盐度中才能更好的生长、变态。Kinne[16]指出,盐度影响胚胎发育和幼虫的浮游期,超过对盐度的耐受范围会引起生物体渗透压的改变,渗透压的改变不仅会降低动物的代谢速率,同时也会影响代谢过程的效率[13]。同时,Tettelbach等[17]认为,海湾扇贝等经济养殖贝类胚胎发育的盐度上、下限分别为30和20,最佳发育盐度为25。参照本试验得出的结果,在盐度为20以下、40以上的海水环境中,内刺盘管虫的受精、孵化、生长及变态率都不高。
3.3 防除内刺盘管虫的新思路
内刺盘管虫是一种对盐度适应范围较广的生物,在盐度为20~40时都能正常发育。与文蛤、魁蚶和彩虹明樱蛤等对盐度的耐受力特性相一致[11,18-19],而与对盐度适应范围较窄的菲律宾蛤仔[20]、紫石房蛤[19]完全不同。这种广盐性的特性,为对其防除造成了相当大的困难。
何义朝等[21]认为,生物对环境因素的反应能力取决于个体生理学的可塑性,如作用因素的量变幅度以及作用因素影响的快慢和时间等。作用因素的量变平缓,有助于生物逐渐适应变化的环境,扩大对作用因素的忍受范围,并在临界条件下存活[22]。反之,作用因素的量变幅度大,则会导致生物的生长、发育受阻或停滞,甚至死亡[23]。因此,内刺盘管虫虽对盐度适应性强,但是扩大盐度的变化幅度,也必会对其生长发育造成影响。这也为对内刺盘管虫的防除提供了一种新思路。
[1]吕振明.海水养殖网具污损生物的防除技术[J].中国水产,2002(7):67-68.
[2]杨德渐,孙瑞平.中国近海多毛类[M].北京:农业出版社,1988.
[3]张彦敏,王琦.内刺盘管虫的性腺发育与生殖周期[J].水产科学,1996,15(6):13-15.
[4]廖承义.内刺盘管虫的发育及其幼虫的附着[J].山东海洋学院学报,1981,11(3):39-51.
[5]Okamoto K,Watanabe A,Sakata K,et al.Chemical signals involved in larval metamorphosis in Hydroides ezoensis(Serpulidae:Polyehaeta):Part I:Induction of larval metamorphosis by extract of adult tube clumps[J].J Mar Biotechnol,1998,6(1):7-10.
[6]曹善茂,徐赫,刘康.4种重金属离子对内刺盘管虫担轮幼虫的急性毒性[J].大连水产学院学报,2008,23(1):73-76.
[7]曹善茂,徐赫,刘鹏亮,等.不同温度对内刺盘管虫幼虫生长发育及变态的影响[J].大连水产学院学报,2009,24(6):531-535.
[8]郑忠明,顾小英 蒋敏霞,等.若干生态因子对双齿围沙蚕生长发育的影响[J].浙江海洋学院学报,2000,19(4):378-380.
[9]沈伟良,尤仲杰,施祥元.温度与盐度对毛蚶受精卵孵化及幼虫生长的影响[J].海洋科学,2009,33(10):5-8.
[10]梁玉波,张福绥.温度、盐度对栉孔扇贝(Chlamys farreri)胚胎和幼虫的影响[J].海洋与湖沼,2008,39(4):334-340.
[11]陈冲,王志松.盐度对文蛤孵化及幼体存活和生长的影响[J].海洋科学,1999,23(3):16-18.
[12]林笔水.温度和盐度对缢蛏浮游幼虫发育的影响[J].生态学报,1984(4):385-392.
[13]Davis H C.Survival and growth of clam and oyster larvae at different salinities[J].Biol Bull,1958,114:297-307.
[14]Davis H C,Ansell A D.Survival and growth of larvae of European oyster,O.edulis,at lowered salinities[J].Biol Bull Woods Hole,1962,122:33-99.
[15]Scheltema R S.The relationship of salinity to larval survival and development in Nassarius obsoletus[J].Biol Bull Mar Sci,1965,39:362-375.
[16]Kinne O.Cultue of the bay scallop,Argopecten irradians Laroarck,in Virginia[J].Mar Fish Rev,1985,37:19-24.
[17]Tettelbach S T,Rhodes E W.Combined effects of temperature and salinity on embryos and larvae of the Argopecten irradians irradians[J].Mar Biol,1981,63(3):294-256.
[18]邱显寅,郭学武.魁蚶工厂化育苗技术[J].海洋水产研究,1994,15(S1):71-78.
[19]谢忠明.海水经济贝类养殖技术[M].北京:中国农业出版社,2003:116-248.
[20]王军,王志松.盐度对菲律宾蛤仔浮游幼体存活和生长的影响[J].水产科学,2003,22(2):12-13.
[21]何义朝,张福绥.盐度对海湾扇贝不同发育阶段的影响[J].海洋与湖沼,1990,21(3):197-204.
[22]刘海映,王冬雪,姜玉声,等.盐度对口虾蛄假溞状幼体存活和摄食的影响[J].大连海洋大学学报,2012,27(4):311-314.
[23]杨为东,郭玲玲,赵文,等.pH、盐度和不同饵料对咖啡金黄水母幼体生长与存活的影响[J].大连海洋大学学报,2011,26(3):223-226.

