大肠杆菌S12无细胞系统合成AgrA蛋白的研究
瞿晓晶,权春善
(大连民族学院生物化学工程国家民委-教育部重点实验室,辽宁大连116605)
金黄色葡萄球菌隶属于葡萄球菌属,是革兰氏阳性菌[1],可引起许多严重感染,是一种重要的致病菌。agr系统是双组分信号系统[2],能够使该菌产生致病性并形成生物膜[3-4]。研究agr系统的调节原理,阻断信号转导,将使新型抗生素研究得到重大突破。反应调节子AgrA蛋白是agr系统的重要组成部分之一,其结构和功能目前尚不清楚,其研究的瓶颈是可溶性表达量较低。无细胞蛋白合成系统具有很多优势,如:反应快速[5],下游处理简单[6],不受细胞制约,蛋白表达量高,无细胞毒性[7],反应灵活易调节。郭新娟等简化和优化了大肠杆菌细胞抽提物的制备过程[8],从而提高了细胞抽提物活性,并且优化了大肠杆菌S12无细胞蛋白表达系统。
本文利用无细胞蛋白合成系统,表达了AgrA蛋白,为AgrA的功能研究和agr系统的机制研究奠定了坚实的基础。此外,温度和时间对反应体系的影响很大,因此本文考察了不同温度和时间对无细胞系统合成蛋白的影响。这些研究为agr系统的进一步研究奠定了实验基础,对于无细胞蛋白表达技术的研究和应用具有重要的借鉴意义,为金黄色葡萄球菌耐药机制的研究和新型抗菌活性物质的研发提供了理论依据。
1 材料与方法
1.1 仪器及试剂
仪器:凝胶成像系统(GelDoc-ItTM300 Moterized lens,USA);多任务梯度PCR仪(VeritiTM96-WELL Thermal Cycler,singapore,England);BTX电击仪(EMC630,USA)等。
试剂:一抗 Anti-His(C-Term)mouse(全式金,北京);二抗 Rabbit-Anti-Mouse;EasySee Western Marker(全式金,北京);EasySee Western Blot Kit(全式金,北京);pIVEX2.3d质粒载体(本实验室保存);质粒 DNA小量提取试剂盒(BSC01M1,BioFlux);QIAprep Spin Miniprep Kit(27104,QIAGEN);其他试剂均为生化级,购自生工生物工程(上海)有限公司。
1.2 方法
1.2.1 体外表达载体的构建
首先利用PCR方法从pPROEXHTa-agrA上扩增目的片段agrA以构建表达载体pIVEX2.3d-agrA。引物与目标载体pIVEX2.3d具有~30 bps同源序列,与目的基因片段具有~20 bps同源序列。对PCR产物,即目的基因片段agrA,1%琼脂糖凝胶电泳进行检测,切胶回收。将PCR产物作为大引物,与载体pIVEX2.3d进行第二步PCR反应,实现目的基因插入到pIVEX2.3d载体之中。反应结束后,产物中包括空载体和插入目的基因的表达载体,采用DpnI消化法,消除母系空载体。消化反应结束后取5 μL产物进行电转,宿主细胞是E.coli.DH5α。涂布过夜培养,挑取阳性单菌落,接菌培养,提取质粒,DNA测序验证。
1.2.2 质粒载体的提纯与检测
采用QIAprep Spin Miniprep Kit试剂盒(QIAGEN公司)提取质粒:pIVEX 2.3d-agrA、pIVEX2.3d-GFP和 pIVEX2.3d-agrA-GFP。
1.2.3 大肠杆菌细胞抽提物的制备
(1)细胞培养。挑取E.coli BL21(DE3)codon-plus RIL单菌落于2×YT液体培养基中,次日以接种量5%接到2×YT培养基中,180 r·min-1,30℃培养,当细菌OD600达0.6时,加入终浓度为1 mM的IPTG。当OD600≈3.0时,细菌处于对数生长期中期,离心收菌,称量湿重。
(2)在4℃下,每克收集的菌体用20 mL S30缓冲液 A重悬,离心收菌后浸液氮,保存于-70℃。
(3)在4℃下,每克细胞用1.27 mL S30缓冲液B溶解,解冻重悬。
(4)对菌体进行高压破碎,4℃下12 000×g离心10 min,取上清。
(5)简易空孵化。在37℃下将所得上清孵育30 min。
(6)分装。浸液氮2 min后贮存于-70℃。
1.2.4 利用无细胞体系合成目的蛋白
在质粒的浓度和纯度都符合无细胞蛋白表达系统的要求后,按照优化的无细胞反应体系,采用最简S12细胞抽提物,进行AgrA、GFP、AgrA-GFP蛋白的合成。无细胞系统在180 r·min-1,30℃条件下,避光反应4 h(其中GFP表达条件需提供有氧环境)。按照优化的无细胞反应体系进行AgrA蛋白的合成,GFP作为对照,反应体系见表1。
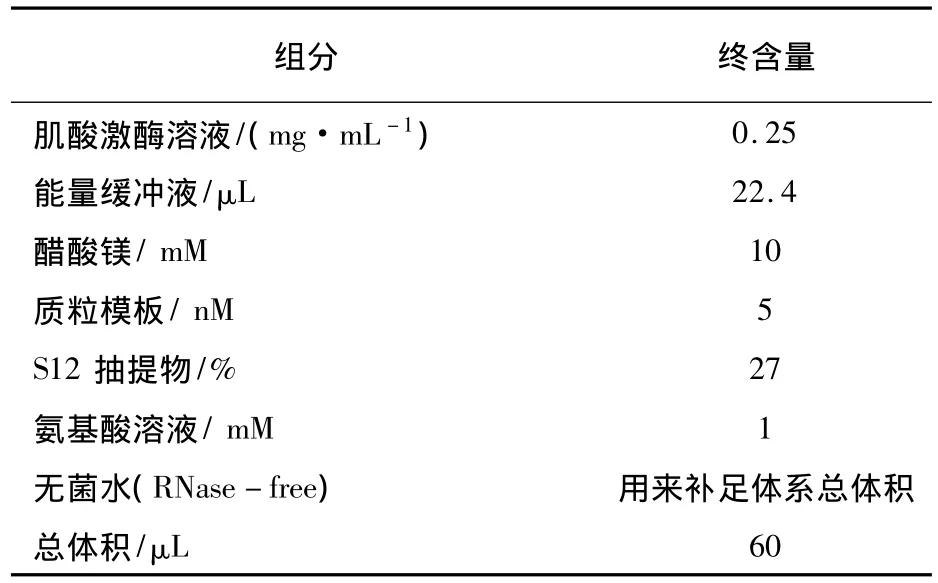
表1 优化的S12无细胞蛋白表达体系组成
1.2.5 目的蛋白的检测
无细胞反应结束后,用丙酮处理反应产物:取5 μL反应产物于无RNase的离心管中,加50 μL丙酮,置于冰上静置5 min。随后10 000 r·min-1离心5 min。弃上清,风干20 min。用20 μL SDS-PAGE上样缓冲液溶解沉淀,进行SDS-PAGE电泳。
质粒载体 pIVEX2.3d-agrA、pIVEX2.3d-GFP和pIVEX2.3d-agrA-GFP表达的蛋白在C端均带有His标签,通过Western blot进行检测。
2 结果与讨论
2.1 体外表达载体的构建
采用PCR方法扩增目的片段agrA(776 bps),进行1%琼脂糖凝胶电泳检测,对得到的目的产物进行切胶纯化,之后使其作为大引物,线性扩增pIVEX2.3d目标载体。结束后,进行消化和电转,得到pIVEX2.3d-agrA(4251 bps)质粒载体(如图1),结果与预期相符。
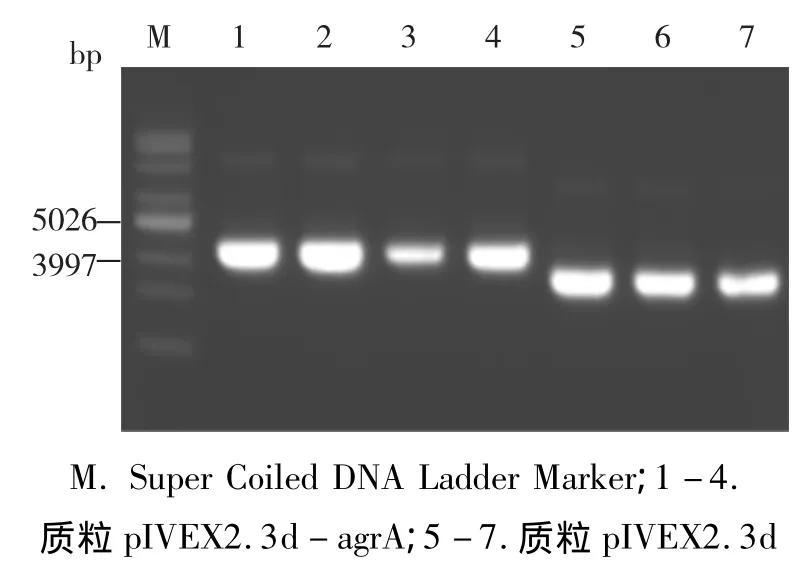
图1 质粒pIVEX2.3d-agrA和pIVEX2.3d的电泳检测图
将得到的质粒进行DNA测序,对测序结果用DNAman软件进行分析,其中,基因比对结果为99%,相应的蛋白质比对结果为100%,得到的质粒可用。
2.2 AgrA蛋白的合成与检测
在进行无细胞蛋白合成反应时,由于GFP蛋白肉眼便能观察到明显荧光,故在蛋白AgrA加上GFP标签,以便于对蛋白AgrA的合成进行检测。本文分别对蛋白AgrA、GFP、AgrA-GFP进行合成反应。反应结束后,表达蛋白GFP和AgrA-GFP的试管便能肉眼明显观察到绿色荧光,AgrA和对照样品试管观察不到明显的荧光。
对上述产物进行SDS-PAGE电泳检测,观测不到明显的目的条带。为了检测蛋白的表达与否,对上述4组反应产物进行Western blot检测,结果如图2。由图2可见,加入质粒模板的均有相应的蛋白表达,未加入任何模板的体系(4号)无蛋白表达。
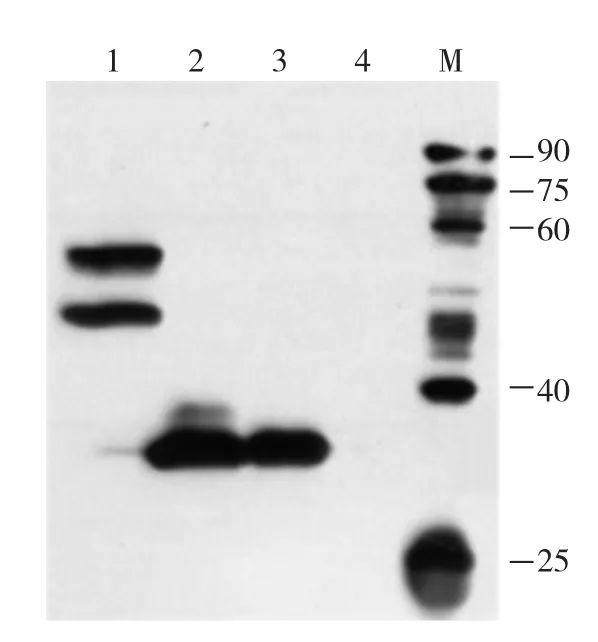
图2 无细胞反应体系的Western blot检测图
从图2看到,1号泳道对应的产物是蛋白AgrA-GFP(55.6 KD)。该泳道存在两条带,其中靠下的条带比蛋白实际分子量小10 KDa左右;靠上的条带与蛋白实际大小相符。有文献报道:形成天然构象的GFP融合蛋白的凝胶条带会比正常分子量小10 KDa左右,而GFP融合蛋白若未形成天然构象,其凝胶条带会与其实际分子量大小相符[9]。靠上的条带可能是没有正确折叠的AgrA-GFP融合蛋白;靠下的条带是正确折叠的AgrA-GFP融合蛋白,大小比实际分子量小10 KDa左右。2号和3号泳道对应的产物分别是GFP(26.2 KDa)和AgrA蛋白(26.3 KDa)。该凝胶条带与实际分子量大小相符。可见,在优化的无细胞表达条件下,AgrA蛋白能够得到有效表达。
2.3 不同反应温度和时间对AgrA合成的影响
温度和时间在无细胞反应过程中起着重要的作用。为了找到最佳的温度和时间条件,在不同温度、时间条件下,对AgrA和GFP蛋白进行表达,其中GFP蛋白易于观察,起对照作用,用于蛋白的定量。反应结束后,GFP的荧光强度肉眼可以观测,荧光强度从大到小依次为30℃、4 h,37 ℃、2 h,28 ℃、12 h,20 ℃、16 h,即在30 ℃、4 h条件下蛋白合成量最大。由western-blot检测结果可知,在20℃、16 h条件下GFP蛋白表达量较低,没有观察到条带,其他条件下均有清晰条带,表明GFP表达(如图3a)。AgrA的western-blot检测结果如图3b。由图3b可见,不同条件下AgrA蛋白均有表达,其中20℃表达量比其他组稍低。综合以上结果,最终确定30℃、4 h为最佳反应温度和时间。
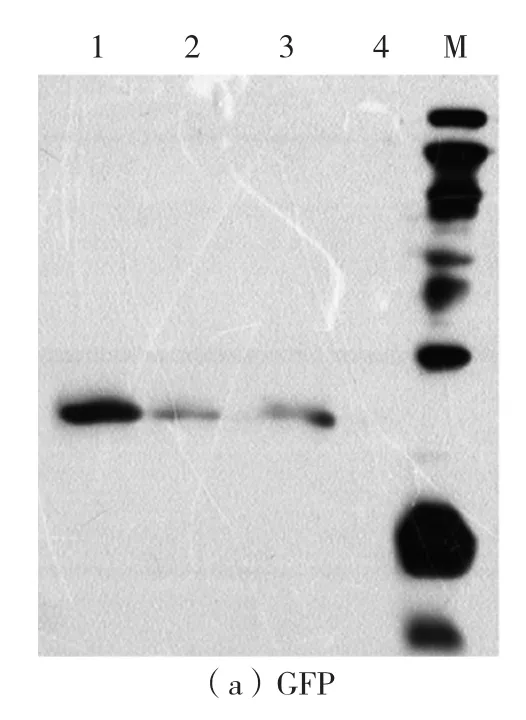
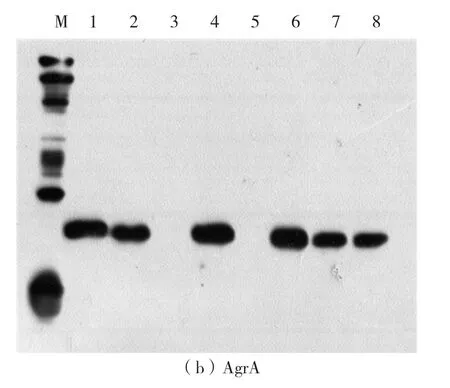
图3 在不同温度和时间条件下合成的AgrA和GFP蛋白的western blot检测图
3 结语
对蛋白的表达传统方法是采用重组载体,在宿主菌体内表达,此方法有多种缺点:表达量低,细胞毒性大,易形成包涵体等。与体内蛋白表达相比,无细胞蛋白表达系统克服了上述缺点,具有操作快速,高通量,表达量高和不形成包涵体等优点。AgrA蛋白中的氨基酸含有半胱氨酸,在蛋白质合成过程中易形成二硫键,聚集在一起而形成包涵体,使蛋白不能正确折叠形成天然构象并且没有活性。为克服AgrA蛋白在胞内表达的缺点,本文采用优化的S12无细胞系统合成AgrA蛋白。在AgrA蛋白的表达中,反应温度和时间起着重要的作用,其中温度的高低会影响蛋白的翻译和修饰,反应时间的长短会影响酶的活性及反应转化率。实验结果表明,在30℃、4 h条件下蛋白的表达效果较好。
[1]HENKE J M,BASSLER B L.Bacterial social engagements[J].Trends Cell Biol,2004,14(11):648-656.
[2] WINZER K,WILLIAMS P.Quorum sensing and the regulation of virulence gene expression in pathogenic bacteria[J].International J Med Microbiol,2001,291(2):131-143.
[3]NOVICK RP,ROSS H,PROJAN S,et al.Synthesis of staphylococcal virulence factors is controlled by a regulatory RNA molecule[J].EMBO J,1993,12(10):3967-3975.
[4]夏培元.耐甲氧西林金黄色葡萄球菌的耐药机制及其治疗药物的研究进展[J].国外医药:抗生素分册,1999,20(4):178-180.
[5]JERMUTUS L,RYABOVA L A,PLUCKTHUN A.Recent advances in producing and selecting functional proteins by using cell-free translation[J].Curr Opin Biotech,1998,9(5):534-548.
[6]CARLSON E D,GAN R,HODGMAN C E,et al.Cell-free protein synthesis:Applications come of age[J].Biotechnol Adv,2011(30):1185-1194.
[7]NAKANO H,YAMANE T.Cell-free protein synthesis systems[J].Biotechnol Adv,1998,16(2):367-384.
[8]郭新娟,权春善,赵鹏超,等.大肠杆菌细胞抽提物制备方案的简化与优化[J].生物工程学报,2013,29(4):532-535.
[9]GEERTSMA E R,GROENEVELD M,SLOTBOOM D J,et al.Quality control of over-expressed membrane proteins[J].Proc Natl Acad Sci,2008,105(15):5722-5727.

