笔管榕榕小蜂的群落结构与物种多样性
陈友铃,陈晓倩,吴文珊,王 钊,卢 冰
(福建师范大学生命科学学院,福建省发育与神经生物学重点实验室,福州 350117)
榕树是桑科(Moraceae),榕属(Ficus)植物的统称,全世界已知的榕树约有750种,主要分布在热带和亚热带地区,是热带雨林地区关键植物类群之一[1-3]。榕树依靠榕小蜂传粉来完成有性繁殖,同时榕小蜂利用榕果内的雌花子房才能繁衍后代,大多数的榕树由专一性、特定的榕小蜂传粉[4-5],只有少数种类的榕树可同时拥有几种传粉小蜂,也只有少数种类的传粉小蜂能同时为几种榕树传粉[6]。榕果内除传粉小蜂外,还寄生着多种非传粉小蜂,某些榕树榕果内的非传粉小蜂种类甚至高达20—30余种[7-9],有些学者认为非传粉小蜂与榕树间也可能存在着专一性[10-11]。非传粉小蜂不能为榕树传粉,但它们利用榕-蜂共生体系繁衍后代[10],研究认为榕果内的小蜂群落中错综复杂的种间关系和适量的种群数量是维系这个共生系统衡的关键[11-13]。
笔管榕(Ficus superba Miq.var.japonica Miq.)为榕属落叶乔木,雌雄同株。笔管榕主要分布于我国台湾、福建、广东、广西、浙江、海南、云南南部等地,在国外多分布于缅甸、泰国、中南半岛诸国、马来西亚至日本琉球等地[14]。笔管榕适应性强,可作为行道树,根、叶可以入药。笔管榕榕果内除了与榕树成一对一共生关系的传粉小蜂之外,还寄生了6种非传粉小蜂[15],目前关于笔管榕及其隐头果内的小蜂的相关研究很少,主要是笔管榕榕果内的传粉小蜂和非传粉小蜂的种类及形态描述[15-20],对其榕果内小蜂群落结构以及种间关系还未进行系统的研究。本文通过对福州地区的笔管榕进行一年的定期追踪观察,从笔管榕榕果内榕小蜂的物种丰富度、多样性指数、均匀度指数、重要值、性比等多个方面来分析笔管榕隐头果内榕小蜂的群落结构及年动态变化规律,从数量角度对传粉榕小蜂与不同生物学特性的非传粉榕小蜂之间关系进行探讨,了解传粉小蜂与非传粉小蜂的性比特点,以及榕小蜂性比与翅型之间的相关性,为榕树-榕小蜂共生体系稳定性研究提供第一手资料。
1 材料与方法
1.1 材料与样地
笔管榕的榕果单生或成对腋生或簇生于叶痕腋部及落叶的老枝上,有时也生于主干上,榕果球形,表面有白色圆斑点,具长约5 mm的梗,成熟时红色或紫色。笔管榕的传粉小蜂为榕小蜂科(Agaonidae)的Platyscapa ishiiana,其余6种为非传粉小蜂,分别为隶属金小蜂科(Pteromalidae)的Philotrypesis sp.和Otitesella ako,广肩小蜂科(Eurytomidae)的Sycophila sp.,隐针榕小蜂亚科(Epichrysomallinae)的Acophila mikii和Sycobiomorpha sp.,以及姬小蜂科(Eulophidae)的 Aprostocetus sp.[15]。本实验研究样地分别为样地 A:福州旗山(26°3'30″N,119°18'49″E),共有样株 17 棵(标记为 A1—A17);样地 B:福州鼓楼区(26°3'30″N,119°18'49″E),共有样株 5 棵(标记为 B1—B5);样地 C:福州台江区(26°3'11″N,119°18'52″E),共有样株 5 棵(标记为 C1—C5);样地D:福州仓山区(26°2'28″N,119°18'51″E),共有样株3棵(标记为D1—D3),总计30株样本(株龄均在30a以上)。福州全年冬短夏长,温暖湿润,属于海洋性亚热带季风气候。
1.2 研究方法
从2011年7月到2012年7月,对样地中的30株笔管榕每周观察1次,记录其花序的发育状况。每月采集一批成熟但未出蜂的D期花序进行单果收蜂实验[21]:在实验室中将榕果剖开,单果放入广口玻璃瓶中,瓶口用120目的纱布封住,放到实验台上(自然光照),待小蜂基本出飞完全后(一般3—5 d),用冷冻处死小蜂。在体视显微镜(Nikon SMZ800)下将未羽化出的小蜂用解剖针从虫瘿中挑出,对小蜂进行鉴定,统计单果中榕小蜂的种类和数量,小蜂保存到装有75%酒精的EP管中,并贴上标签。
1.3 数据分析
采用物种丰富度、Shannon-Wiener多样性指数、Pielou均匀度指数和重要值分析笔管榕隐头果内榕小蜂的群落结构[22-23]。其中:
(1)Margalef丰富度指数[24]D=(S-1)/lnN
(2)Shannon-Wiener多样性指数 H=-∑Piln(Pi),式中Pi=Ni/N
(3)Pielou均匀度指数 J=H/lnS
(4)重要值公式 I.V.=(R.A.+R.F.)/2
(5)Simpson物种优势集中性指数 C=∑(Pi)2,式中Pi=Ni/N
(6)性比 由群落中某一种小蜂的雄蜂数量占据整个种群数量的比例来表示[25],即先计算单个榕果内每种小蜂的性比,然后计算平均值和标准差。用两种形式统计数据:①采用寄生有某种小蜂的全部榕果数据统计性比[9,26];②只统计性比小于和等于0.5的榕果(有效榕果)数据,将性比大于0.5的榕果以及只有雌蜂或雄蜂的榕果数据删除[9,27-28]。
以上公式中,S为样地中小蜂的总种数,Ni为I物种的个体数量,N为样株所有物种个体数量总和,R.A.为相对多度,即该物种的个体比例,R.F.为相对频度,即该物种出现的样果数比例。用Levene方法进行样本总体方差齐性检验。小蜂性比差异用one-way anova方差分析,用最小显著差数法(LSD)比较每两组间的差异程度。所有计算分析均采用Excel2003和SPSS 16.0软件。
2 结果与分析
2.1 榕小蜂群落结构特征
福州地区的笔管榕榕果发育株间异步,一年四季基本上都能采集到雄花期榕果(11月和6月笔管榕植株上雄花期榕果较少)。2011年7月—2012年7月间,在福州地区的30株笔管榕上分15批次收集了830个榕果内的50817头小蜂,隶属于小蜂总科(Chalcidoidea)中的6个科(亚科)的7个种(表1)。笔管榕榕果内的榕小蜂种类在不同季节没有明显变化,5月份仅收集到2种小蜂,其他月份出现的榕小蜂种类为4—6种。单个榕果中榕小蜂的种类通常有1—3种,最多可达5种;单个榕果中小蜂的总数最多185头,最少仅2头(没有被产卵或传粉的笔管榕榕果,在雌花凋亡后还能在树上挂果长达数周)。同一时期在不同样地(例如,10月的A4/B1样株)、或同一样株在不同的时期(例如,样株A4在10月/5月),笔管榕榕果内榕小蜂的种类、数量均有差异。在9月、11月和1月,单果中传粉小蜂的数量明显少于非传粉小蜂,在其他月份传粉小蜂为优势种。统计笔管榕榕果内小蜂群落结构多样性各指标,结果表明:笔管榕榕果内小蜂群落结构的多样性指数为0.72,均匀度指数为0.37,丰富度指数为0.55,优势集中性指数为0.68。
群落中的榕小蜂分为常见种和偶见种,常见种的发生具有连续性,而偶见种没有连续性。在7种榕小蜂中,Aprostocetus sp.为偶见种(全年仅收集到2头),其余6个种为常见种。传粉小蜂Platyscapa ishiiana每月均可采集到,同时全年数量也最多;非传粉小蜂中的Otitesella ako,Acophila miki,Sycobiomorpha sp.和Sycophila sp.几乎每月都会出现,数量有时多有时少;而非传粉小蜂中的Philotrypesis sp.小蜂的发生有明显的周期性,主要出现在7—11月,但其全年总数量却多于其他非传粉小蜂。在收集的15批次的榕小蜂中,每批次榕小蜂的种类与单果中榕小蜂的平均数呈负相关,其回归方程y=-3.8696x+73.152(R2=0.0349,P>0.01),每批次单果传粉小蜂平均数和非传粉小蜂平均数呈显著负相关(y=-0.1919x+19.803,R2=0.291,0.01﹤P﹤0.05),单果中传粉小蜂个体数与非传粉小蜂个体数之间呈极显著相关(y=-0.1514x+18.564,R2=0.1376,P﹤0.01)。
2.2 榕小蜂的年动态变化
笔管榕6种常见榕小蜂的年动态变化规律各不相同(图1)。传粉小蜂的单果平均数量呈规律性波动。非传粉小蜂中的Acophila mikii、Philotrypesis sp.、Otitesella ako具有爆发性大量出现的现象,其中Acophila mikii在1月份数量明显高于其他月份,平均每个果内达到28头;Philotrypesis sp.在9月、10月存在爆发性增多现象,单果中Philotrypesis sp.小蜂数目达14—23头;Otitesella ako在7月出现高峰,小蜂平均10头/果,其他月份这类小蜂的数量均较少或未收集到。Acophila mikii和Philotrypesis sp.分别在1月和9月的爆发性增多,造成单果中非传粉小蜂的平均数量高于传粉小蜂,成为该期榕小蜂群落结构的优势种。在Acophila mikii、Philotrypesis sp.、Otitesella ako爆发性增多的批次中,单果中Scophila sp.小蜂的平均数量均明显上升,前者以及传粉小蜂可能都是Scophila sp.小蜂的宿主。单果中Sycobiomorpha sp.小蜂的平均数量全年都维持较低的水平,即使在数量最多的2月,单果小蜂平均数量也在3头以下。
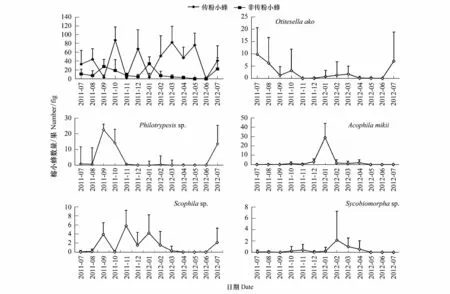
图1 笔管榕榕小蜂种群动态Fig.1 Population dynamic of fig wasps in Ficus superba Miq.var.japonica Miq.
2.3 榕小蜂的重要值比较
统计笔管榕榕果内不同种类榕小蜂的重要值,结果表明:在全年12批次中,有9批次均是传粉小蜂的重要值最大,即传粉小蜂占优势,剩余的3批次中,传粉小蜂的重要值明显小于非传粉小蜂,即非传粉小蜂占优势。重要值年平均结果(表2)表明:传粉小蜂的重要值极显著高于非传粉小蜂,而各种非传粉小蜂之间的重要值没有显著差异。在不同批次中,重要值最大非传粉小蜂的种类往往是不同的,表明在Acophila mikii、Sycophila sp、Philotrypesis sp.和Otitesella ako小蜂多为爆发性发生。

表2 笔管榕榕果内不同种类榕小蜂的重要值比较Table 2 Important value of the fig wasp community of different species
2.4 非传粉小蜂对传粉榕小蜂繁殖率的影响
笔管榕的非传粉小蜂均在果外产卵,造瘿类非传粉小蜂与传粉小蜂抢占产卵资源,寄生或寄居类非传粉小蜂常寄生或寄居于传粉小蜂,寄居类非传粉小蜂与传粉小蜂争夺食物资源,寄生类非传粉小蜂则直接导致传粉小蜂死亡。使用SPSS l6.0软件包分析不同类群的非传粉小蜂数量与传粉小蜂数量之间的相关性(表3),结果表明:非传粉小蜂数量、造瘿类非传粉小蜂数量,以及寄生或寄居类非传粉小蜂数量,与传粉小蜂的总数量、雌蜂数和雄蜂数均呈极显著负相关;与传粉小蜂的性比呈显著正相关,即非传粉小蜂数量增加,可造成传粉小蜂的性比升高,这是因为非传粉小蜂数量(造瘿类非传粉小蜂数量,以及寄生或寄居类非传粉小蜂数量)对传粉小蜂雌蜂的影响略大于雄蜂(表3)。在榕果中,传粉小蜂的雌蜂所在的虫瘿的位置,比较于雄蜂较靠近果壁(果托),因而易受到非传粉小蜂攻击[29]。表3数据还表明,笔管榕寄生或寄居类群非传粉小蜂,对传粉类群的影响明显大于造瘿类群非传粉小蜂。
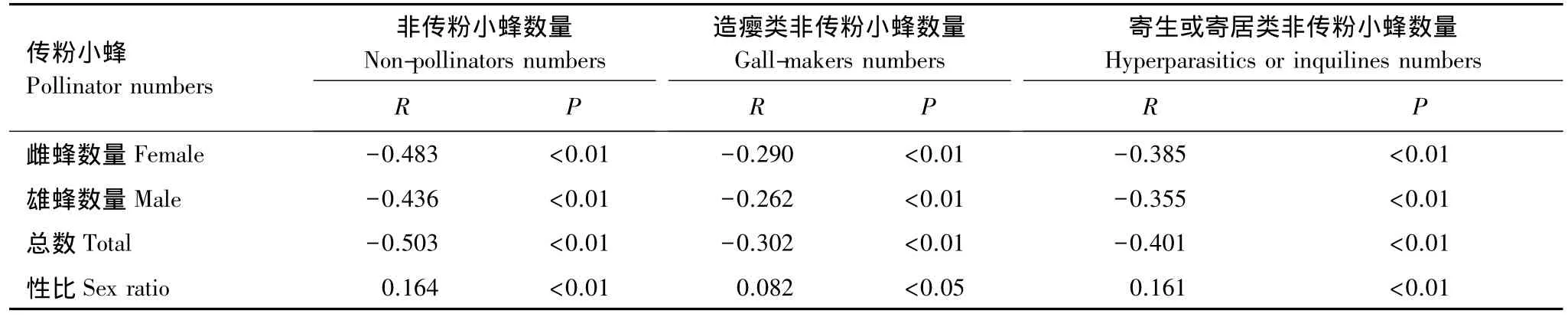
表3 非传粉小蜂数量与传粉小蜂数量及性比间的相关关系Table 3 The relationship between non-pollinators numbers and pollinator numbers and sex ratios
2.5 榕小蜂的性比
传粉小蜂的性比约为0.13,极度偏雌,而非传粉小蜂的性比在0.3左右,均高于传粉小蜂。5种非传粉小蜂中,雄蜂为无翅型的Otitesella ako和Philotrypesis sp.小蜂的性比较低,雄蜂具有翅和无翅两种类型的Sycobiomorpha sp.小蜂的性比居中,雄蜂为有翅型的Sycophila sp.小蜂的性比较高,这与Fellowes[30]和吴文珊等人[9]的研究结果一致,推测榕小蜂性比与雄蜂的翅型有关。Acophila mikii小蜂的雄蜂为有翅型,但其性比在5种非传粉小蜂中是最低的,这可能是因为Acophila mikii小蜂产卵早(A后期),它极有可能又被Sycophila sp.和Philotrypesis sp.小蜂复寄生,且复寄生小蜂可能更倾向于攻击Acophila mikii小蜂的雄蜂,致使其性比降低。
表4可见,用两种方法计算传粉小蜂和Sycophila sp.小蜂的性比具极显著差异,Sycophila sp.小蜂有效榕果仅为69.09%,这意味着若采用方法1计算性比,将有近30%的榕果数据未被统计,因此,用方法2计算小蜂性比有可能更接近事实。
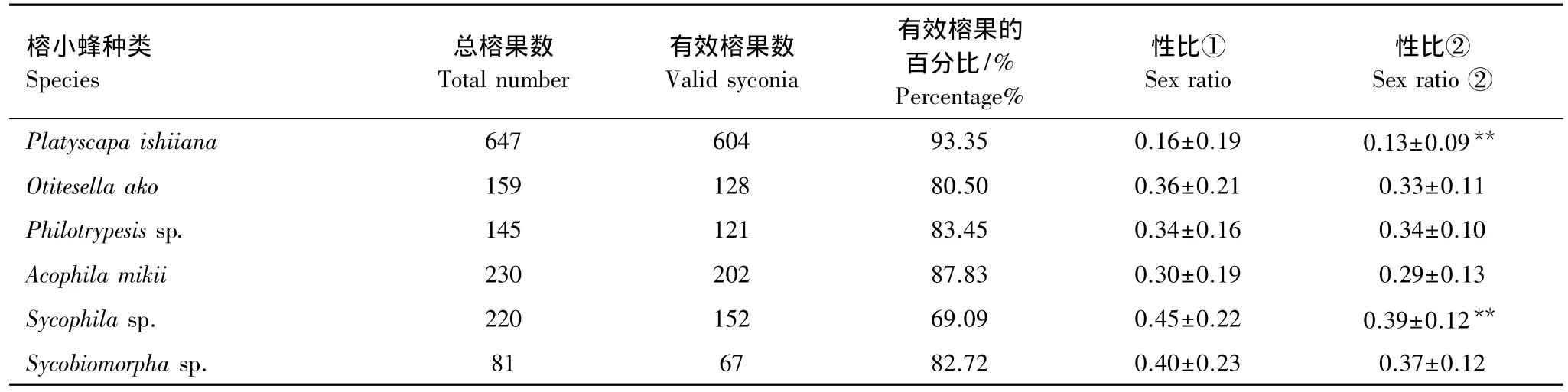
表4 笔管榕不同种类榕小蜂性比的相关数据Table 4 Relative datas of the sex ratio of different kinds of fig wasps in Ficus superba var.japonica Miq.
常常可以看到,在单个榕果内,某种小蜂只有雄蜂或雌蜂的现象(表5),只有传粉小蜂的雄蜂的榕果数略多于只有雌蜂的榕果数,而单性后代的榕果内雄蜂数量极显著多于雌蜂(P<0.01),这可能是由于寄生类非传粉小蜂攻击雌蜂的几率大于雄蜂[29];同时,只有非传粉小蜂的雄蜂的榕果数略少于只有雌蜂的榕果数,具有翅型雄蜂的Acophila mikii和Sycophila sp.小蜂,其单性后代的榕果内雄蜂数量略多于雌蜂(P>0.05),具无翅型雄蜂的Otitesella ako和Philotrypesis sp.小蜂,以及具有翅、无翅两种类型雄蜂的Sycobiomorpha sp.小蜂,其单性后代的榕果内雌蜂数量略多于雄蜂(P>0.05)。
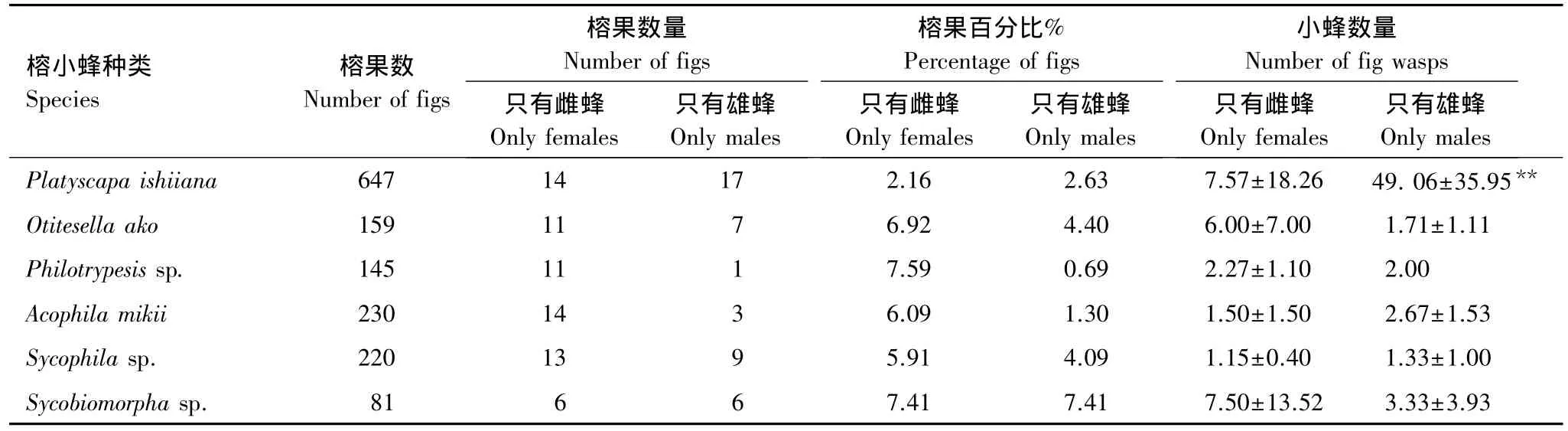
表5 小蜂单性后代的分布Table 5 Distribution of single sex offspring reproduced by fig wasps
3 讨论
3.1 不同榕树榕果内小蜂群落多样性比较
比较福州地区笔管榕、大叶榕和细叶榕榕果内小蜂群落结构多样性各指标(表6),结果表明:笔管榕榕果内小蜂群落结构的多样性指数、均匀度指数和丰富度指数均低于大叶榕和细叶榕,表明笔管榕榕果内非传粉小蜂的种类最少,数量最少,且分布不均匀,由此表明笔管榕传粉小蜂在其群落结构的稳定性最佳;而笔管榕榕果内小蜂群落结构的优势集中性指数最高,表明笔管榕传粉小蜂在其群落中的优势度明显高于大叶榕、细叶榕传粉小蜂在其群落中的优势度,即表明笔管榕传粉小蜂在其群落结构中占据最重要的地位。
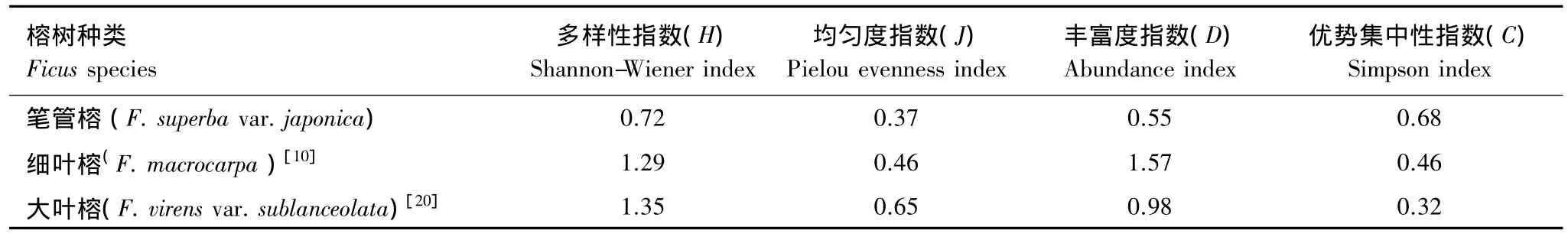
表6 不同榕树榕果内小蜂群落多样性比较Table 6 Species diversity index of fig wasps community in the syconia of different ficus
3.2 榕果内榕小蜂为单性的原因
榕果内某种榕小蜂只有雄蜂或雌蜂的现象较为普遍,造成榕果内某种榕小蜂只有雌性或只有雄性的原因可能是:(1)未经交配的繁殖母蜂产下的卵均发育出雄蜂;(2)已交配的繁殖母蜂,因其产卵数量较少(例如,传粉小蜂在进入苞片通道的过程中伤残过度,导致无力产卵或过早死亡;非传粉小蜂在果外产卵,产卵器穿越果壁十分费时费力,故产卵数量有限,同时复杂的外界环境经常造成产卵中断),或在发育过程中,榕小蜂的雌性或雄性被其他非传粉小蜂寄居或寄生造成死亡;或因先天不足或后天营养不良而夭折,例如,最新研究表明,榕小蜂的卵若产在未发生双受精的胚珠内存活率较低[31],从而造成性别配比缺损。
3.3 传粉小蜂与非传粉小蜂的性比差异
传粉小蜂在果内产卵,笔管榕雌花期花序腔内产卵的繁殖雌蜂数量多为1—3头,局域配偶竞争水平高,故后代性比偏雌;非传粉小蜂在果外产卵,同一只小蜂可以在不同榕果上产卵,同一个榕果上也可以同时有多种非传粉小蜂产卵,局域配偶竞争水平降低,故后代性比高于传粉小蜂[9,32-33]。
大量实验数据表明:传粉小蜂的性比明显小于非传粉小蜂,非传粉小蜂中,雄蜂为无翅型的榕小蜂的性比小于雄蜂具有翅和无翅两种类型的榕小蜂的性比,更小于雄蜂有翅型的榕小蜂的性比[9,30],表明榕小蜂性比可能与其交配方式有关,行果外交配的榕小蜂,由于果外榕小蜂的活动空间大,雄蜂需要花费较多的体力和时间需找雌蜂交配,因此,为满足雌蜂的交配需要更多的雄蜂,故行果外交配的榕小蜂性比,高于行果内交配的榕小蜂的性比。传粉小蜂交配发生在果内的虫瘿内,雄蜂找寻还在虫瘿内的雌蜂交配,雄蜂为找寻配偶所花费的体力和时间大大节省,因此,只需少量的雄蜂就可完成与雌蜂的交配,故传粉小蜂的性比明显偏雌。Acophila mikii雄蜂有翅,但性比在笔管榕非传粉小蜂中是最低的,Acophila mikii小蜂性比与上述推理相左的原因在于:在小蜂群落中Acophila mikii小蜂产卵早,易成为其他复寄生性非传粉小蜂的寄主,因此,雄花期统计的小蜂性比可能无法反映Acophila mikii小蜂的真实性比。
致谢:感谢浙江大学吴为人教授对本文写作的帮助。
[1] Berg C C.Classification and distribution of Ficus.Experientia,1989,45(7):605-611.
[2] Berg C C,Wiebes J T.African fig trees and fig wasps//Koninklijke Nederlandse Akademie van Wetenschappen Verhandelingen Afdeling Natuurkunde,Tweede Reeks.Amsterdam,New York:North-Holland Publishing Cp.,1992,89:298-298.
[3] Weiblen G D.How to be a fig wasp.Annual Review of Entomology,2002,47(1):299-330.
[4] Compton S G.One way to be a fig.African Entomology,1993,1(2):151-158.
[5] Janzen D H.How to be a fig.Annual Review of Ecology and Systematics,1979,10(1):13-51.
[6] Machado C A,Robbins N,Gilbert M T P,Herre E A.Critical review of host specificity and its coevolutionary implications in the fig/fig-wasp mutualism.Proceedings of the National Academy of Sciences of the United States of America,2005,102(S1):6558-6565.
[7] Compton S G,Hawkins B A.Determinants of species richness in southern African fig wasp assemblages.Oecologia,1992,91(1):68-74.
[8] Gu H Y,Yang D R.Community structure and species diversity of fig wasps from Ficus altissima.Biodiversity Science,2003,11(3):188-196.
[9] Wu W S,Zhang Y J,Li F Y,Wu M X,Yan J Y,Chen Y L.Community structure and dynamics of fig wasps in syconia of Ficus microcarpa Linn.f.in Fuzhou.Acta Ecologica Sinica,2012,32(20):6535-6542.
[10] Bai L F,Yang D R,Shi Z H,Peng Y Q,Zhai S W.Community structure of fig wasp in Ficus benjamina in different habitats.Biodiversity Science,2006,14(4):340-344.
[11] Ulenberg S A.The phylogeny of the genus Apocrypta Coquerel in relation to its hosts Ceratoselen Mayr(Agaonidae)and Ficus L.//Koninklijke Nederlandse Akademie van Wetenschappen Verhandelingen Afdeling Natuurkunde,Tweede reeks.Amsterdam,Netherlands:North-Holland Publishing Cp.,1985,83:149-176.
[12] Kerdelhué C,Rossi J P,Rasplus J Y.Comparative community ecology studies on old world figs and fig wasps.Ecology,2000,81(10):2832-2849.
[13] Xu L,Yang D R,Peng Y Q,Wang Q Y,Zhang G M.The community structure and the interspecific relationship of the fig wasps in syconia of Ficus racemosa L.in Xishuangbanna,China.Acta Ecologica Sinica,2003,23(8):1554-1560.
[14] Zhang X S,Wu Z Y,Cao Z Y.Flora of China.Beijing:Science Press,1998,23(1):95-96.
[15] Chen X Q,Wu W S,Sun L L,Chen Y L,Zheng C F.Fig Wasp Species of Ficus superba Miq.var.japonica Miq.in Fuzhou,Journal of Fujian Normal University:Natural Science Edition,2013,29(2):109-118.
[16] Grandi G.Imenotteri dei fchi dell fauna olartica e indo-malese.Annali del Museo Civico di Storia Naturale di Genova,1923,51:101-108.
[17] Wiebes J T.Agaonid fig wasp from Ficus salicifolia Vahl and some related species of the genus Platyscapa Motschoulsky(Hym.,Chalc.).Netherlands Journal of Zoology,1977,27(2):209-223.
[18] Wiebes J T,van Wetenschappen K N A.The Indo-Australian Agaoninae:Pollinators of Figs.Amsterdam:North-Holland Publishing Co.,1994.
[19] Ishii T.Fig chalcidoids of Japan.Japanese Journal of Entomology,1934,8(2):84-100.
[20] Feng G.Preliminary Survey of Fig Waps Community in China,Focusing on Taxonomy of Epichrysomallinae and Sycoscapter(Hymenoptera:Chalcidoidea)[D].Beijing:Chinese Academy of Sciences,2010.
[21] Wu W S,Chen Y L,Cai M M,Liu L.Structure and biodiversity of fig wasp community inside syconia of Ficus virens Ait.var.sublanceolata(Miq.)Corner in Fuzhou.Acta Ecologica Sinica,2012,32(5):1436-1441.
[22] Pielou E C.Ecological Diversity.New York:Wiley,1975.
[23] Sun R Y,Li B,Zhu G Y,Shang Y C.General Ecology.Beijing:Higher Education Press,1993:52-195.
[24] Margalef D R.Information theory in ecology.General Systems:Yearbook of the International Society for the Systems Sciences,1958,3:36-71.
[25] West S A,Herre E A.Partial local mate competition and the sex ratio:A study on non-pollinating fig wasps.Journal of Evolutionary Biology,1998,11(5):531-548.
[26] Wang Z J,Zhang F P,Peng Y Q,Yang D R.Reproductive strategy and impact on the fig-pollinator mutualism of one non-pollinating fig wasp species.Biodiversity Science,2009,17(2):168-173.
[27] West S A,Herre E A,Compton S G,Godfray H C J,Cook J M.A comparative study of virginity in fig wasps.Animal Behaviour,1997,54(2):437-450.
[28] Pereira R A S,Prado A P d.Non-pollinating wasps distort the sex ratio of pollinating fig wasps.Oikos,2005,110(3):613-619.
[29] Yu H,Compton S G.Moving your sons to safety:galls containing male fig wasps expand into the centre of figs,away from enemies.PLoS One,2012,7(1):e30833.
[30] Fellowes M D,Compton S G,Cook J M.Sex allocation and local mate competition in Old World non-pollinating fig wasps.Behavioral Ecology and Sociobiology,1999,46(2):95-102.
[31] Jansen-González S,de Padua Teixeira S,Pereira R A S.Mutualism from the inside:coordinated development of plant and insect in an active pollinating fig wasp.Arthropod-Plant Interactions,2012,6(4):601-609.
[32] Hamilton W D.Extraordinary sex ratios.Science,1967,156(3774):477-488.
[33] Song B,Peng Y Q,Yang D R.The role of foundress relatedness in the offspring sex ratio of fig wasp Diaziella yangi(Hymenoptera:Pteromalidae).Acta Entomologica Sinica,2008,51(4):411-416.
参考文献:
[8] 谷海燕,杨大荣.高榕小蜂群落结构及物种多样性的初步研究.生物多样性,2003,11(3):188-196.
[9] 吴文珊,张彦杰,李凤玉,吴敏霞,严菊媛,陈友铃.细叶榕榕小蜂群落结构及动态变化.生态学报,2012,32(20):6535-6542.
[10] 白莉芬,杨大荣,石章红,彭艳琼,翟树伟.垂叶榕隐头果内小蜂群落结构与生境关系的初步研究.生物多样性,2006,14(4):340-344.
[13] 徐磊,杨大荣,彭艳琼,王秋艳,张光明.西双版纳聚果榕隐头果内小蜂群落结构及种间关系.生态学报,2003,23(8):1554-1560.
[14] 张秀实,吴征镒,曹子余.中国植物志.北京:科学出版社,1998,23(1):95-96.
[15] 陈晓倩,吴文珊,孙伶俐,陈友铃,郑翠芳.福州笔管榕(Ficus superba Miq.var.japonica Miq.)榕果中榕小蜂的种类.福建师范大学学报:自然科学版,2013,29(2):109-118.
[20] 冯贵.中国榕小蜂群落初探及Epichrysomallinae和Sycoscapter的分类[D].北京:中国科学院研究生院,2010.
[21] 吴文珊,陈友铃,蔡美满,刘亮.福州大叶榕隐头果内的小蜂群落结构与多样性.生态学报,2012,32(5):1436-1441.
[23] 孙儒泳,李博,诸葛阳,尚玉昌.普通生态学.北京:高等教育出版社,1993:52-195.

