二斑叶螨侵染下菜豆叶片交替呼吸途径对光合作用、叶温和间接防御的影响
冯汉青, 魏 阳, 张晋平, 孙 坤, 陈 纹, 贾凌云
(西北师范大学生命科学学院,兰州 730070)
在自然环境中,植物频繁地遭到害虫的侵染。近年来,害虫侵染下植物代谢及防御反应的研究已经成为植物学研究的重点和热点问题之一。然而,尽管线粒体呼吸是植物物质和能量代谢的中心环节[1],其在虫害侵染下的变化以及其可能的生理学功能到目前为止尚不清楚,这制约了人们对虫害侵染下植物生理学反应更加全面的认识。
交替呼吸途径是高等植物呼吸系统区别于动物呼吸系统的重要特征之一。这条呼吸途径的运行可以将电子绕过细胞色素氧化酶而直接传递到交替氧化酶,并将分子氧还原成水。由于交替呼吸途径的运行使得电子传递越过了形成质子梯度的两个位点,故能将形成腺嘌呤核苷三磷酸(ATP)的部分化学能以热的形式放出[2]。研究发现,交替呼吸途径能够被病原菌侵染、低温、干旱等多种环境压力因素所诱导,并在植物抵抗上述环境压力中扮演着重要的角色[3]。但到目前为止,是否交替呼吸途径也和植物的抗虫反应相关国内外尚无报道。
研究发现,在害虫侵染下,植物能够通过气味来吸引害虫的天敌,从而间接减少害虫在植物上的数量,这种防御机制被命名为间接防御反应[4]。而早期的研究发现,交替呼吸路径所介导的植物产热作用能够提升花器的气味释放继而吸引昆虫为之授粉[5]。尽管目前尚不清楚植物通过气味吸引害虫天敌的作用是否和交替呼吸路径所介导的产热功能有关,但植物吸引授粉昆虫和害虫天敌行为上的相似性提示了交替呼吸路径有可能和间接防御反应之间存在着一定的联系。此外,光合作用通常会因害虫的侵染而降低[6];但光合作用被发现为植物吸引害虫天敌气味的合成提供了底物[7];故在害虫侵染下,光合作用的维持和保护可能对于植物的间接防御具有重要的作用。而目前的研究发现,在干旱、高光等环境因素造成光合作用抑制时,交替呼吸路径能保护光合作用[8]。因此,交替呼吸路径也可能通过光合作用和间接防御反应之间存在着联系。基于以上分析,交替呼吸路径的生理学特性迎合了植物间接防御反应的生理代谢需求,可能是植物呼吸代谢和植物抗虫策略之间关系研究的重要切入点之一。基于此,我们在由菜豆(Phaseolus vulgaris Linn.)叶片、害虫二斑叶螨(Tetranychus urticae Koch)以及二斑叶螨的捕食天敌智利小植绥螨(Phytoseiulus persimilis Athias-Henriot)组成的三级互作体系中初步分析了交替呼吸途径和植物间接防御反应的关系及其可能的内在机理。相信该研究有利于进一步了解虫害下线粒体呼吸代谢的变化情况及其可能扮演的生理学角色。
1 材料与方法
1.1 植物材料的培养
菜豆种子经次氯酸消毒和萌发后种植于营养土中,在培养室中生长,生长温度为25℃,光强为100μmol photons/m2·s光照周期为 L∥D=16h∥8h。部分植物材料用于害虫及其天敌的饲养;另选取2~3周龄的菜豆幼苗作为供试材料进行处理和生理指标的测量(见1.2~1.7)。
1.2 植物材料的害虫侵染
挑选30头成年雌性二斑叶螨,用毛刷转移到供试菜豆植株第一叶上,使其均匀分布;以未经害虫侵染处理植株的第一叶作为对照。之后将植物置于上述生长条件下继续培养。
1.3 呼吸抑制剂处理
在害虫侵染第10天 的16h光照结束后,将10个连有叶柄的叶片切下,放置于内部盛有一定量蒸馏水的2L玻璃瓶中(叶柄朝下浸没在蒸馏水中以避免叶片水分丧失),先于黑暗下适应4h。之后,依据Martim等描述的方法,将蒸馏水替换为1mmol/L的水杨基氧肟酸 (SHAM,salicylhydroxamic acid;该抑制剂浓度已被报道不会对光合作用等其他代谢造成影响[9]),并在黑暗下维持4h,使SHAM 通过叶柄输入到叶片组织中以抑制交替呼吸途径[10];以未经SHAM溶液处理的叶片作为对照。将SHAM处理的叶片和对照叶片经历3d的光周期(瓶口打开,瓶内光强保持在5 000lx,光周期L∥D=16h∥8h),每天光照结束后替换一次SHAM以保持对叶片交替呼吸途径的抑制。于第4天进行指标测定。
1.4 不同温度和光照的处理
在害虫侵染第10天的16h光照结束后,依据上述办法(见1.3)将10个连有叶柄的侵染叶片放置于盛有蒸馏水的2L玻璃瓶中,先于黑暗下适应8h,之后进行不同温度和光照处理。不同温度处理:将盛有叶片的玻璃瓶在两种不同温度下(20℃和25℃)维持3d(瓶口打开,瓶内光强保持在5 000lx,光周期L∥D=16h∥8h),于第4天利用Y型嗅觉仪观察不同温度生长下植物对害虫天敌吸引力的变化。不同光照的处理:将盛有叶片的玻璃瓶放置于两种不同光照条件下(瓶内光强分别为2 800lx和5 000lx)维持3d(瓶口打开,温度为25℃,光周期L∥D=16h∥8h),于第4天利用Y型嗅觉仪观察不同光强生长下的植物对害虫天敌吸引力的变化。
1.5 利用Y型嗅觉仪观察植物对害虫天敌的吸引作用
Y型嗅觉仪由一条玻璃中管和两条等长的玻璃臂管组成(臂管长10cm;中管长12cm;内径为4cm)。两个臂管分别连接两个盛有叶片的2L玻璃瓶,每个玻璃瓶中放置10个叶片作为气味源(见1.3和1.4)。密封瓶口,使经活性炭净化的空气(流速为3L/min)经过气味源后流向Y型嗅觉仪的臂管。将捕食螨智利小植绥螨引入Y型嗅觉仪中管下风口处,观察捕食螨对两个臂管的选择行为。如果捕食螨在5min内进入了某一臂管,则认为其做了趋向性选择;如果在5min内捕食螨未能进入任何一个臂管,则认为其没有做出趋向性选择。整个观察时间为3h,并对结果进行卡方(χ2)检测。
1.6 呼吸的测量
在呼吸测量之前,将叶片上二斑叶螨移除以避免其对叶片呼吸的干扰。之后将叶片称重并剪成小块,利用Clark氧电极依据以前的方法测量叶片的总呼吸和交替呼吸的容量[11]。
1.7 光合速率和叶片温度的测定
光合速率利用便携式开放气路型光合仪测量(PP Systems,Hertfordshire,UK),叶室的气体流速为300mL/min,光合速率和叶片温度的测量依据操作手册进行。
2 结果
2.1 二斑叶螨侵染对菜豆叶片总呼吸和交替呼吸途径水平的影响
二斑叶螨的侵染显著地增加了菜豆叶片总呼吸和交替呼吸途径容量的水平(表1)。在未遭害虫侵染的对照叶中,交替呼吸途径容量在总呼吸中的比值为30.3%,害虫侵染叶中这一比值上升至为36.8%,表明害虫侵染提升了交替呼吸途径在总呼吸中的比例。

表1 二斑叶螨侵染对菜豆叶片总呼吸和交替呼吸途径容量水平的影响1)Table 1 Effects of T.urticaeinfestation on total respiration(Vt)and alternative pathway capacity(Valt)
2.2 交替呼吸途径影响了害虫侵染叶片对天敌的吸引作用
二斑叶螨侵染的叶片较之未遭侵染的叶片能够吸引更多的天敌智利小植绥螨(图1)。而较之未经SHAM处理的二斑叶螨侵染叶片,SHAM处理后的害虫侵染叶片对智利小植绥螨的吸引作用有所降低(图1),表明了交替呼吸途径的抑制降低了害虫侵染叶片对捕食螨的吸引能力。
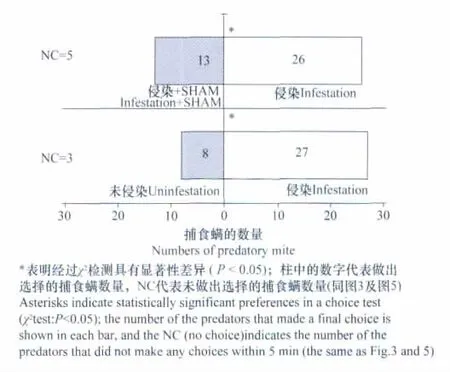
图1 智利小植绥螨在Y型嗅觉仪中对二斑叶螨侵染叶片、未侵染叶片及水杨基氧肟酸(SHAM)处理的二斑叶螨侵染叶片选择趋向性的比较Fig.1 Responses of P.persimilisin a Y-tube olfactometer when offered the spider mite-infested leaves vs.the uninfested leaves or the infested leaves treated with SHAM
2.3 交替呼吸途径的抑制对害虫侵染叶片温度的影响
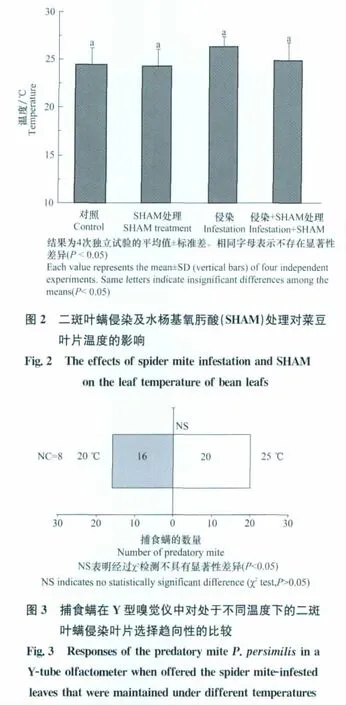
在未遭二斑叶螨侵染的叶片中,SHAM处理没有对叶片的叶温产生影响;二斑叶螨侵染叶片的叶温比对照叶的叶温略高,但并没有显著差异(图2)。较之未经SHAM处理的二斑叶螨侵染叶,SHAM处理后的害虫侵染叶片的叶温平均降低了1.5℃,但两者之间也无显著性差异(图2)。
试验发现,SHAM处理二斑叶螨侵染叶片所引起的最大叶温的降低是5℃,进一步的试验比较了这个水平上的温度降低是否会对虫害侵染叶片吸引害虫天敌的作用产生影响。结果显示,处于20℃下的害虫侵染叶片和25℃下的害虫侵染叶片吸引智利小植绥螨的数量之间没有显著性差异(图3)。上述的观察(图2和3)表明,SHAM处理所造成的害虫侵染叶片对捕食螨吸引作用的降低可能与温度的变化无关。
2.4 交替呼吸途径的抑制对害虫侵染叶片光合速率的影响
在未遭二斑叶螨侵染的叶片中,SHAM处理没有对叶片的光合速率产生显著性影响;二斑叶螨侵染叶较之对照叶片有着较低的光合速率;而在二斑叶螨侵染叶中,SHAM处理进一步显著降低了叶片的光合速率(图4)。
较低的光强度(大约为2 800lx)照射二斑叶螨侵染叶片使其光合速率低到和SHAM处理后的二斑叶螨侵染叶片光合速率相似的水平,影响到害虫侵染叶片对捕食螨的吸引作用(图5);结合上述的观察(图4和5),SHAM处理所造成的害虫侵染叶片对捕食螨吸引作用的降低可能和其引起的光合速率的下降有关。

3 讨论
受二斑叶螨侵染的叶片较之未遭侵染的叶片能够显著地吸引更多的捕食螨(图1),且有着较高水平的交替呼吸途径(表1)。而用SHAM处理明显降低了害虫侵染叶片对捕食螨的吸引作用(图1),表明了害虫侵染叶片对捕食螨的吸引作用可能和交替呼吸途径的上升有关。
如前文所述,产热植物中交替呼吸途径水平的升高能够促进植物产热,从而提升了花器气味的释放以吸引昆虫为之授粉。其后,在一些非产热植物的组织中(如烟草和高粱的叶片)也发现了交替途径水平上升促进组织热量生成的现象[12-13]。因此,推测交替呼吸途径抑制所引起的害虫侵染叶片对捕食螨吸引作用下降的现象(图1)可能和交替呼吸途径的产热功能有关。但试验结果显示,害虫侵染并未引起叶片温度的显著性升高;且SHAM的处理也没有引起害虫侵染叶片叶温的显著下降(图2)。在试验中观察到,SHAM处理害虫侵染叶片所引起的最大水平的温度降低是5°C;但此温度不会影响害虫侵染叶片对捕食螨的吸引作用(图3)。综上结果表明,交替呼吸途径抑制所引起的害虫侵染叶片对捕食螨吸引作用下降的现象可能和温度的变化无关。有研究表明,线粒体的丰度、呼吸底物的供应水平以及交替氧化酶碳端等影响线粒体将化学能转化为热量的因素在产热植物中和非产热植物中均有着明显不同,这可能制约了非产热植物利用交替呼吸途径去产生热量的能力[14]。而本研究的观察也反映了尽管交替途径的抑制能轻微地降低非产热植物叶片的温度,但这种影响是非常有限且不显著。据此,本研究认为非产热植物中可能并不存在通过交替呼吸途径的产热来吸引害虫天敌的生理机制。
尽管交替呼吸途径看上去并非通过叶片温度的变化来影响害虫侵染叶片对捕食螨的吸引作用,但本研究发现,SHAM的处理导致了害虫侵染叶片光合速率的显著下降(图4),表明了害虫侵染下交替呼吸途径能够保护植物的光合作用。许多研究也发现,在干旱和高光等逆境下,交替呼吸途径的抑制也会导致植物叶片光合作用的下降[8]。有学者提出了逆境下交替呼吸途径对植物光合作用影响的内在机理,认为逆境胁迫会导致叶绿体中还原力的过度产生,如果这些过多的还原力没有被消散就会导致叶绿体中活性氧水平的上升,从而对叶绿体造成氧化损伤并继而降低光合作用;而植物可以通过苹果酸-草酰乙酸穿梭等路径将叶绿体中过多的还原力传递到线粒体,并被交替呼吸途径所消散,从而保护了光合作用[8]。已有报道表明,害虫侵染也会导致叶片中还原力的过度积累和氧化损伤[15-16]。据此,本研究认为,在害虫侵染下交替呼吸途径可能通过上述机制保护了叶片的光合作用。而如前文所述,植物吸引害虫天敌的气味的体内合成所需的底物主要通过光合作用产生。当用一个较低的光强度照射二斑叶螨侵染的叶片使其光合速率降低到了和SHAM处理后的二斑叶螨侵染叶片光合速率相似的水平时,害虫侵染叶片对捕食螨的吸引作用也有所降低(图5),表明了害虫侵染叶片对捕食螨的吸引作用可能和其光合速率水平有关。由此猜测,交替呼吸途径抑制剂处理下害虫侵染叶片对捕食螨吸引作用降低的现象可能其是导致光合速率降低的结果。
必须提出的是,未经二斑叶螨侵染的叶片较之侵染的叶片有着更高的光合速率,但却无法吸引更多的捕食螨(图1和4)。这似乎与叶片对捕食螨的吸引作用可能和光合速率有关这一结论有矛盾之处。但有研究提出,害虫侵染是引起叶片对捕食螨产生吸引作用的前提条件:害虫侵染引发了植物体内信号路径的改变,从而激活了一些特异性基因的表达,这些基因的表达产物利用了光合作用所提供的底物以合成吸引害虫天敌的气味[17]。
交替呼吸途径也可能以其他方式去影响植物的间接防御反应,但本文的试验结果表明了光合作用很可能是联系交替呼吸途径和植物间接防御反应的重要节点。
[1] Plaxton W,Podesta F.The functional organization and control of plant respiration[J].CRC Critical Reviews Plant Sciences,2006,25:159-198.
[2] Millenaar F F,Lambers H.The Alternative oxidase:in vivo regulation and function[J].Plant Biology,2003,5:2-15.
[3] Van Aken O,Giraud E,Clifton R,et al.Alternative oxidase:a target and regulator of stress responses[J].Physiologia Plantarum,2009,137:354-361.
[3] Degenhardt J.Indirect defense responses to herbivory in grasses[J].Plant Physiology,2009,149:96-102.
[5] Meeuse B D J.Thermogenic respiration in Aroids[J].Annual Review of Plant Biology,1975,26:117-126.
[6] Kerchev P I,Fenton B,Foyer C H,et al.Plant responses to insect herbivory:interactions between photosynthesis,reactive oxygen species and hormonal signalling pathways[J].Plant Cell Environment,2012,35(2):441-53.
[7] Staudt M,Lhoutellier L.Monoterpene and sesquiterpene emissions fromQuercus coccifera exhibit interacting responses to light and temperature[J].Biogeosciences,2011,8:2757-2771.
[8] Arnholdt-Schmitt B,Costa J H,deMelo D F.AOX-a functional marker for efficient cell reprogramming under stress[J].Trends Plant Science,2006,11:281-287.
[9] Bartoli C G,Gómez F,Gergoff G,et al.Up-regulation of the mitochondrial alternative oxidase pathway enhances photosynthetic electron transport under drought conditions[J].Journal of Experimental Botany,2005,56(415):1269-1276.
[10] Martim S A,Santos M P,Peçanha A L,et al.Photosynthesis and cell respiration modulated by water deficit in grapevine(Vitis vinifera L.)cv[J].Cabernet Sauvignon Brazilian Journal of Plant Physiology,2009,21:95-102.
[11] Feng H Q,Wang Y Y,Li H Y,et al.Salt stress-induced expression of rice AOX1ais mediated through an accumulation of hydrogen peroxide[J].Biologia,2010,65:868-873.
[12] Van Der Straeten D,Chaerle L,Sharkov G,et al.Salicylic acid enhances the activity of the alternative pathway of respiration in tobacco leaves and induces thermogenicity[J].Planta,1995,196:412-419.
[13] Kumar S,Sinha S K.Possible role of alternative respiration in temperature rise of water stressed plants[J].Journal of Biosci-ences,1994,19(3):331-338.
[14] Grant N,Onda Y,Kakizaki Y,et al.Two Cys or not two Cys?That is the question;alternative oxidase in the thermogenic plant sacred lotus[J].Plant Physiology,2009,150:987-995.
[15] Heng-Moss T M,Ni X,Macedo T,et al.Comparison of chlorophyll and carotenoid concentrations among Russian wheat aphid (Homoptera:Aphididae)-infested wheat isolines[J].Journal of Economic Entomology,2003,96(2):475-81.
[16] Botha A M,Lacock L,van Niekerk C,et al.Is photosynthetic transcriptional regulation in Triticum aestivum L. cv.′TugelaDN′a contributing factor for tolerance to Diuraphis noxia (Homoptera:Aphididae)[J].Plant Cell Reports,2006,25(1):41-45.
[17] Arimura G,Köpke S,Kunert M,et al.Effects of feeding Spodoptera littoralis on lima bean leaves:IV.diurnal and nocturnal damage differentially initiate plant volatile emission[J].Plant Physiology,2008,146(1):965-973.

