自然环境下关于过饱和蒸气的讨论
路俊哲,马晓栋
(新疆师范大学 物理与电子工程学院,新疆 乌鲁木齐 830054)
0 引言
过饱和蒸气就是在一定温度下超过饱和蒸气应有的密度而仍不液化或凝华的蒸气。由于蒸气中总是充满了尘埃和杂质等小微粒,它们起着凝结核的作用。过饱和蒸气的状态非常不稳定,一旦遇到凝结核,部分蒸气就会凝结成液体,其余蒸气就会回到原来的饱和蒸气状态。在一些文献[1-3]中对于过饱和蒸气的讨论总是在系统与大气隔绝的条件下进行的,即液滴周围只有液体的蒸汽,并且液滴周围的蒸汽压比较小,然而这些情况只能是在一些非常特殊的实验条件下才能得以实现,过于理想化,显然这一研究不具代表性。而在日常生活和大多数生产实践活动中,液滴是处在自然环境下的液滴,是和大气相接触的,因此,在自然环境下研究过饱和气体是具有现实意义的。
1 基本理论
由于问题的复杂性,为了叙述的方便,先指出讨论中的基本理论:(1)要考虑以大气分界面为平面的液体(以下简称液体);(2)要考虑大气中的液体蒸气(以下简称蒸气);(3)要考虑涨落,从而使得蒸气以大气中灰尘颗粒为核,形成凝结的液滴(以下简称液滴);(4)要考虑液体与蒸气的平衡条件和液滴与蒸气的平衡条件;(5)远离液体的蒸气,如果压强大于饱和蒸气压而不能向液滴凝结,则处在过饱和状态;(6)在一定温度下,与液滴平衡的蒸气压强大于与液体平衡的蒸汽压强,这是产生过饱和蒸汽的原因。
2 与大气隔绝的过饱和蒸气
在一些文献[1-3]中对于过饱和蒸气的讨论总是在系统与大气隔绝的条件下进行的,设液气两相在温度T下平衡时,如果分界面为平面,液相α和气相β的化学势相同,有

如果分界面是半径为r的曲面,则有

其中p和p'是分界面分别为平面和曲面时的平衡蒸气压,σ为液体表面张力系数。把(2)式中的μα按压强线性展开,有
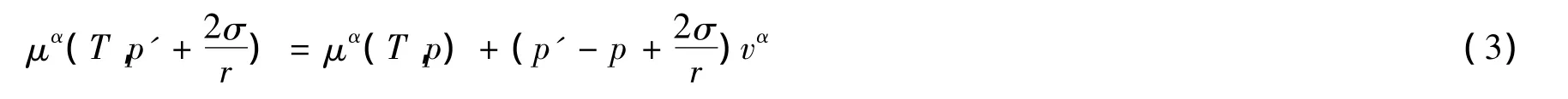
其中vα为液相的摩尔体积。把(1)和(2)式代入(3)式得

把蒸气看成理想气体,则有

其中φ是温度的单值函数。把(5)式代入(4)式得

在实际问题中,可以验证

则(6)式可近似地写为

以水滴为例[1]作一估算。
由此可知,当水滴愈小时,与水滴达到平衡所需的蒸气压强越高。
在一定蒸气压强p'下,与蒸气达到平衡时的液滴半径,即中肯半径为

由(3)式可看出,对于r>rc的液滴,有μα<μβ,液滴将凝结而增大,对于r<rc的液滴,有μα>μβ,液滴将汽化而消失。如果蒸气中灰尘少、颗粒小,蒸气由涨落而以灰尘颗粒为核形成的液滴比较小,液滴会减少而汽化,而使蒸气成为过饱和蒸气。
上述的讨论较为理想化,液滴或液体周围只有液体蒸气,这种情况只有在特殊的实验条件下才能实现。在实际问题中,过饱和蒸汽都是处于自然环境下的。
3 自然环境下的过饱和蒸气
在自然环境下,液滴是远离地面液体的大气中的液滴。设在温度T下,液体与蒸气达到平衡,此时的蒸气压强就是液体在温度T下的饱和蒸气压,记为p,根据力学平衡条件,液体的压强等于大气压p0,则液体与蒸气的相变平衡条件[1-3]为

其中,μα(T,p0)、μβ(T,p)分别是液体和蒸气的化学势,α、β分别表示液、气两相。此时液滴压强为p0+,其中,σ是液体表面张力系数,r是液滴的半径,则液滴化学势为,大气中的液滴与蒸气的相平衡条件为

其中p0是大气压强。将此化学势按压强线性展开[1-3]得
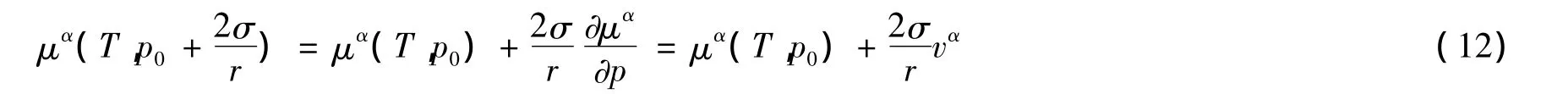
把(10)、(11)式代入(12)式得

把蒸气看成理想气体,即可把(5)式代入(13)式得

并直接得中肯半径

此结果与(9)式相同。
本文省略了一般文献[1-3]推导过程中比较繁琐的部分,但却可以比一般文献多考虑了大气,所得结果比一般文献简单。由(10)和(12)式可得,即液滴化学势大于蒸气化学势,由涨落不断产生的液滴会不断汽化消失。
为了讨论在自然环境下的过饱和蒸气,假设原来温度为T,液体与蒸汽达到平衡,后来温度由T减小到T -ΔT.
如果温度由T减小到T-ΔT,与液体达到平衡的蒸气压强则由p降低为p-Δp,p-Δp也就是温度TΔT下液体的饱和蒸气压,液体与蒸气的相变平衡条件是

其中,μα(T-ΔT,p0)、μβ(T-ΔT,p-Δp)分别是温度降低后的液体和蒸气的化学势。此时,液体附近的蒸气向液体凝结,蒸气压强将由p减小到p-Δp,但在远离液体的地方,蒸气则不能向液体凝结。而能否向液滴凝结,以下进行讨论。
假设远离液体的蒸气压强仍然为p,半径为rc的液滴恰好与远离液体的蒸气达到平衡,rc称为中肯半径,则液滴与远离液体蒸气的相平衡条件为其中分别是液滴和远离液体蒸气的化学势,把化学势μα(T-ΔT,p0+)按压强线性展开得

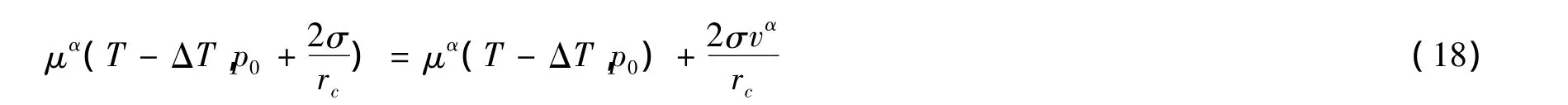
把(15)和(16)式代入(17)式得
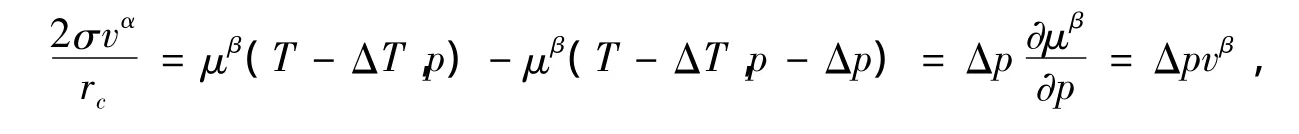
即有

有解,说明此时存在与远离液体的蒸气达到平衡的液滴。根据(17)和(18)式又可推断出:①如果液滴半径r大于中肯半径rc,其化学势

则由(20)和(21)式得:

即液滴的化学势小于远离液体蒸气的化学势,液滴将凝结而增大。
②如果液滴半径r小于中肯半径rc,同理可得:
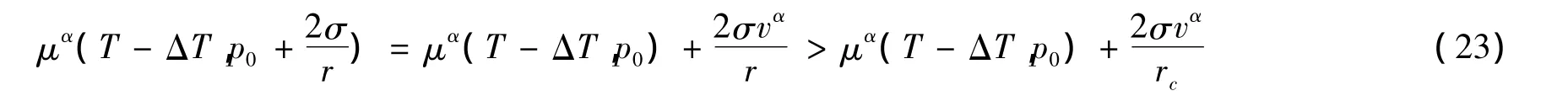
由(21)和(23)式得:

即液滴的化学势大于远离液体蒸气的化学势,液滴将汽化而消失。
以上讨论从理论上说明了液滴的产生和消失,并且得出液滴是否凝结决定于中肯半径是否小于液滴半径,而由(19)式可知中肯半径与远离液体的蒸气压强和饱和蒸气压的差别Δp成反比,液滴半径的大小则取决于大气中灰尘颗粒的数量。考虑到上述三个因素可以推断出:如果大气中灰尘多、颗粒大,远离液体的蒸气由于涨落将会形成以灰尘颗粒为核的液滴,并且此液滴的半径比较大。此时,在远离液体的蒸气压强和饱和蒸气压差别比较小时,就可以使中肯半径大于液滴半径;反之,如果大气中灰尘少、颗粒小,远离液体的蒸气以灰尘颗粒为核所形成的液滴半径就比较小,只有在远离液体的蒸气压强和饱和蒸气压差别比较大时,才能使中肯半径小于液滴半径。因此,大气中灰尘越少、颗粒越小,远离液体处在过饱和状态的蒸气压强就越大。根据(19)式,以水为例,在温度为 293.15 K,表面张力系数为 0.072 8 N·m-1,vα=10-3m3·kg-1,vβ=1.6 m3·kg-1时,可估算分别与中肯半径rc=10-6、10-5、10-4、10-3m相对应的过饱和蒸气压与饱和蒸气压的百分差为389%、38.9%、3.89%、0.389%,即中肯半径越小,远离液体的蒸气压强和饱和蒸气压差别越大,远离液体的过饱和蒸气压强就越大。
4 结语
在自然环境下讨论了过饱和蒸气,并与一些文献[1-3]作对比,其研究既具有一般性,又避免了其他文献中一些繁琐的讨论过程。利用相平衡条件,通过公式推导,研究大气中的液滴的生长和消失的原因,并得出结论:大气中灰尘越少、颗粒越小,远离液体处在过饱和状态的蒸气压强就越大。以水为例验证此结论正确。因此,讨论自然环境下的过饱和蒸气有益于理解、分析和解决实际问题。
[1]汪志诚.热力学·统计物理学[M].北京:高等教育出版社,2008:94-97,121-124.
[2]马本堃,高尚惠,孙煜.热力学与统计物理学[M].北京:高等教育出版社,1995:111-115.
[3]王竹溪.热力学[M].北京:高等教育出版社,1955:189-196.

