不同时间电刺激对C2C12细胞糖代谢的影响研究
徐晓阳, 闫旭杰, 周 周, 潘红英, 赵秀峰
(华南师范大学体育科学学院,广东广州 510631)
不同时间电刺激对C2C12细胞糖代谢的影响研究
徐晓阳*, 闫旭杰, 周 周, 潘红英, 赵秀峰
(华南师范大学体育科学学院,广东广州 510631)
以小鼠骨骼肌母细胞(C2C12)肌管为研究对象,测定不同时间电刺激对其AMPK、HK-Ⅱ、GS-1基因表达、GLUT4基因及蛋白表达等糖转运和代谢相关指标的变化,探讨不同收缩时间对骨骼肌细胞糖代谢的影响及机制. 骨骼肌细胞的肌糖原消耗随刺激时间延长而增加,为了保证骨骼肌细胞糖消耗的需要,通过AMPK信号通路的调控,其膜对胞外糖转运的能力会随收缩时间延长而增强;骨骼肌细胞内糖原合成酶的合成则随肌糖原储量的持续下降而增加.
骨骼肌细胞; 电刺激; 糖代谢; 信号转导
糖是骨骼肌细胞收缩的重要能量来源,多数运动项目的完成都离不开糖供能,而体内糖供能的能力则决定了运动员的运动成绩. 因此,糖的大量消耗也是导致这些运动项目运动性疲劳的重要原因[1]. 骨骼肌细胞收缩将引起胞内糖原的大量消耗[2].但对骨骼肌细胞在收缩过程中糖原消耗调控机制的信号传导, 以及肌糖元消耗和合成平衡调控的机制不清楚. 在体研究干扰因素多, 取材周期长, 对研究结果有一定的影响.本文利用小鼠骨骼肌母细胞(C2C12)作为研究对象,研究不同时间电刺激对其中糖原含量、AMPKα1和α2、HKⅡ GS-1mRNA的表达、葡萄糖转运载体4(GLUT4)mRNA的表达及其蛋白含量的变化.
1 材料与方法
1.1 细胞培养
研究用小鼠骨骼肌母细胞(C2C12),由南方医科大学解剖学教研室提供. 培养基为10%胎牛血清的高糖培养基(DMEM),置于37℃、5%CO2、饱和湿度的CO2培养箱中,细胞生长汇合达70%~80%时,采用0.25%胰蛋白酶消化,以2×105/mL的细胞浓度转入直径3.5 cm的培养皿中,细胞长满皿底时,将培养基换为含有2%马血清的分化培养基,每48 h换液1次,分化5 d后进行后续研究.
培养所用各试剂均购自Hyclone公司.
1.2 分组及电刺激方式
将培养细胞分为对照组(C组)、电刺激60 min组(E60组)、电刺激120 min组(E120). 用美国GRASS公司生产的S48 双向脉冲电刺激器进行电刺激,设定电压15 V,频率3 Hz,脉宽30 ms. 刺激结束后,即刻收样,测定各指标.
1.3 指标的测定
1.3.1 糖原含量的测定 肌管糖原含量用南京建成肌糖原及肝糖原蒽酮法测定试剂盒测定.
1.3.2 GLUT4蛋白含量的测定 GLUT4蛋白含量的测定采用武汉优尔生公司的小鼠GLUT4酶联免疫分析试剂盒测定,各指标监测严格按照试剂盒说明操作. 用酶标仪在450 nm波长下依序测量各孔的吸光度(OD值),通过标准曲线计算GLUT4蛋白含量.
1.3.3AMPKα1和α2、HKⅡ、GS-1、GLUT4mRNA表达的测定 研究所涉及的各基因表达采用实时荧光定量PCR法测定.
1.4 数据统计处理
应用SPSS 17.0统计学软件对研究所获数据进行统计学处理. 各数据以均值±标准差(X±SD)表示,以方差分析进行各组间的差异显著性检验,P<0.05为差异具有显著性,P<0.01为差异具极显著性.
2 结果与分析
2.1糖原含量的变化
表1说明:电刺激60 min时C2C12肌管中糖原略高于对照组(P>0.05),电刺激120 min时肌管中糖原显著降低(P<0.05).

表1 不同时间电刺激肌管糖原含量的变化
研究表明:强度在75%VO2max(最大摄氧量,Maximal oxygen consumption)以上的运动中糖供能可占到总能耗的70%~80%;持续时间超过60~90 min的50%~80%VO2max强度的运动,肌糖原储量将是运动能力的限制因素[1]. 离体研究证明了肌细胞收缩时糖耗量增加. MAROTTA等[2]以50 V、30 ms、3 Hz电刺激C2C12肌管,90 min后观察到肌管中糖原分解增加,糖原代谢相关酶活性改变,电刺激60 min时糖原含量略高于对照组(表1),其原因为:收缩时肌细胞不仅依靠肌糖原的储备,肌肉还大量吸收培养液中的糖来满足能量供应. 这与运动时人体骨骼肌细胞在运动开始阶段吸收和利用血糖的速度上升,随着运动的进行,血糖的吸收和利用速度仍保持上升趋势的情况相似,体外实验中收缩可明显升高葡萄糖转运[3]. 但刺激时间延长到120 min时,肌管中糖原含量出现了明显下降. 说明即使环境中有可摄取的糖,肌管还是会大量消耗自身储备的肌糖原.
2.2AMPK基因表达的变化
电刺激可以改变C2C12肌管AMPK-α1mRNA与AMPK-α2mRNA的表达(表2). 当刺激60 min时,二者的相对表达率均明显升高,刺激120 min时,AMPK-α1mRNA的相对表达率仍明显高于对照(P<0.01),而AMPK-α2mRNA的相对表达率虽高于对照,但差异已不显著(P>0.05).
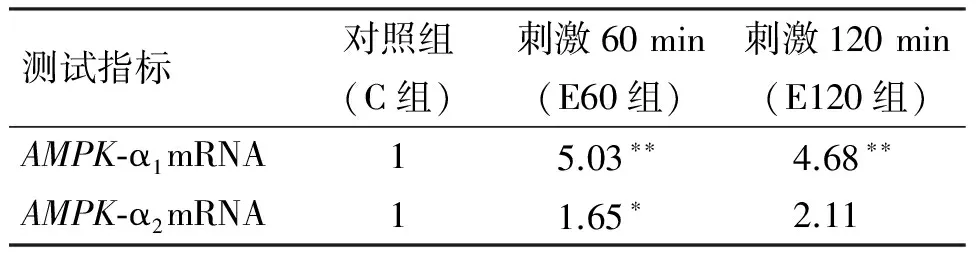
表2 电刺激不同时间肌管内AMPK-α1、2mRNA相对表达率
注:*表示与C组比较有显著性差异(P<0.05);**表示与C组比较有极显著性差异(P<0.01).
活细胞内ATP合成和水解之间是动态平衡的,绝大多数细胞的ATP/ADP比值都保持在小波动范围(10∶1). 运动引起肌肉内糖原和ATP消耗增多使得ATP/ADP比值下降,AMP大幅上升,并通过与AMPK-γ亚基相结合激活AMPK[4-5],高浓度的ATP可拮抗这一过程.AMPK被激活后,上调ATP的合成过程,运动应激可能先激活AMPK的α2亚型. 鼠和人骨骼肌内,高糖原浓度可抑制AMPK的激活,说明AMPK不仅可以调节ATP的合成,还可感知细胞中能量的储存状况.AMPK-β上的糖原绑定域(GBD)在能量储存感知过程中发挥重要作用. GBD的另外一个作用是促进糖原合成酶与其底物相结合[6],加速糖原的合成. 研究证明,体外电刺激糖尿病大鼠骨骼肌可以明显增加肌内磷酸化AMPK蛋白含量及其磷酸化程度(p-AMPK/AMPK),但AMPK蛋白含量则无变化[7].
并非所有运动都可激活AMPK信号通路,运动是否激活该通路,与运动强度和时间有关. FUJII等[8]让受试以70%VO2max强度在功率自行车上运动60 min,分别于运动的20、60 min以及运动结束后的30 min时对股外侧肌进行活检,观察到AMPK-α2表达在运动20、60 min时显著升高,运动后30 min依然保持高水平. CHEN等[9]发现:受试分别进行40%、60%和80%VO2max强度运动,AMPK-α2的表达在60%VO2max强度运动时上升,80%VO2max强度运动时上升明显. WOJTASZEWSKI等[10]让受试以90%VO2max的强度运动5 min后,强度降为55%VO2max持续运动55 min,股外侧肌活检发现运动后即刻AMPK-α2的活性升高了3~4倍,3 h后才恢复至安静水平. DERAVE等[11]对2 h游泳运动后18~24 h的大鼠分灌胃糖溶液和水,结果发现其快肌中AMPK和葡萄糖载体均明显增多. SEAN等[12]观察到人体60 min、70%VO2max强度的自行车运动可以使肌细胞内AMPK-α2蛋白含量增加2倍. 离体研究也证明:使孵育大鼠骨骼肌收缩、处于缺氧和高渗透压环境等都可同时增加AMPK-α1、α2亚型的活性[13].
由表2可知,电刺激C2C12肌管60、120 min时,E60和E120组的AMPK-α2的基因表达均升高,其中电刺激60 min 组有显著性升高(P<0.05),但刺激时间达120 min时其表达虽高于对照,差异却不明显(P>0.05),说明AMPK-α2的激活有时间依赖性,并不会随着时间的延续而持续升高.
AMPK的α2亚基主要在骨骼肌、心肌和肝脏中含量最高.在AMP刺激下,α2活性提高的幅度大于α1的活性[14]. 有研究发现:在某些因素刺激下,AMPK活性的2个主要催化亚基α1和α2的变化并不一致[15]. 如3周单腿伸展耐力训练使训练腿的AMPK-α1、α2活性分别增加94%和49%[16]. 本文刺激60 min时,C2C12肌管AMPK-α1、α2表达均明显上升,α1上升的幅度更大,而当刺激时间达120 min时,二者的表达虽高于对照,但只有α2的差异显著(P<0.01),这与其他研究者发现的结果一致. 随着收缩时间的延长,非骨骼肌细胞特异性的AMPK系统被激活,从更大的范围调控机体能量平衡进行. 因此,α1亚基对骨骼肌细胞能量平衡的调节作用可能较α2亚基更为持久. 同时,骨骼肌细胞能量平衡还有其它信号转导系统参与调控[17],收缩也会启动非骨骼肌特异的AMPK途径[18]. 本研究中刺激120 min时AMPK-α2mRNA表达没有持续上调,验证了上述观点.
2.3GLUT4基因表达和蛋白含量的变化
电刺激60、120 min时,GLUT4 mRNA表达明显增加(表3),2个时间点C2C12肌管中GLUT4蛋白含量也均极明显增加(P<0.01).
表3不同时间电刺激肌管内GLUT4 mRNA和蛋白含量的变化
Table 3 Contents of GLUT4 and GLUT4 mRNA in C2C12 after electrical stimulation
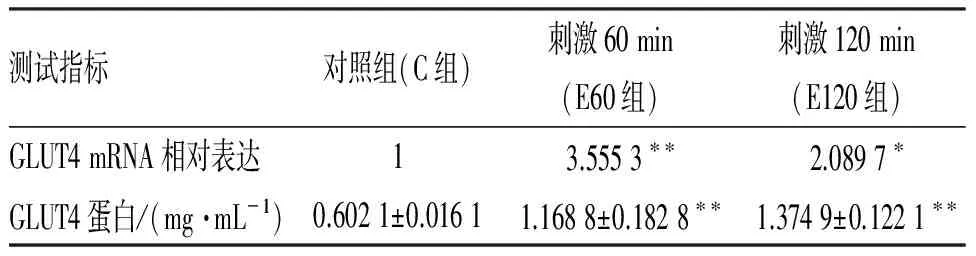
注:*表示与C组比较有显著性差异(P<0.05);**表示与C组比较有极显著性差异(P<0.01).
有研究[19]认为:GLUT4基因的开放和关闭主要受控于GLUT4基因启动子上游元件与MEF-2的相互作用.AMPK和CaMK可使转录抑制因子(HDACs)磷酸化,并从MEF2结合位点解离,增加GLUT4基因表达. OJUKA等[20]发现:AMPK激活剂AICAR可使L6细胞内GLUT4蛋白、MEF2A和MEF2D浓度显著上升,而AMPK的抑制剂可以阻止这种上升. 采用0.5 mmol/L AICAR体外孵育骨骼肌18h,GLUT4蛋白升高了50%. 李良刚等[21]用AICAR孵育骨骼肌细胞,胞内HDACs减少了29%,而GLUT4 mRNA上升了124%. 事实上,包括HDL、ApoA、脂联素、芦荟萃取物、二甲双胍、蜂胶提取物和橘皮素等都可通过激活AMPK途径促进肌细胞GLUT4的转位[22-28]. 但AMPK途径增加GLUT4活性并非都涉及对其基因表达的影响,也与AMPK介导减少肌细胞膜胆固醇、引发细胞骨架重塑有关[22,29-30]. 也有研究表明:AMPK-α2基因敲出鼠训练28天,其骨骼肌GLUT4基因表达和蛋白含量仍然出现了155%和120%的增加,说明训练引起的骨骼肌细胞GLUT4增加,虽与AMPK-α2增加MEF2A的核结合有关,但并非必须[31].
本文研究发现:电刺激60 min和120 min时GLUT4 mRNA表达均明显高于对照(表3),2个时间点GLUT4蛋白含量也显著上升(P<0.01),该变化特性与各刺激时间AMPK-α1、α2基因表达的变化趋势相似,由此可推测电刺激肌管引起胞内能量状况改变,激活骨骼肌特异和非特异AMPK通路,进而上调GLUT4 基因表达和蛋白质合成,可能还有AMPK参与的其它过程共同作用,导致了C2C12肌管GLUT4含量的增加,有利于肌管从环境中摄取更多的糖,以供其收缩的能量和糖原合成的需要.
2.4糖代谢的变化
从表4可知:电刺激60 min时,C2C12肌管HKⅡmRNA相对表达量极明显上升(P<0.01),电刺激120 min时,该表达量虽高于对照,但差异没有显著性(P>0.05);电刺激60和120 min时C2C12肌管GS-1mRNA的相对表达量则均极明显上升(P<0.01).
表4不同时间电刺激C2C12肌管HKⅡ、GS-1mRNA相对表达量的变化
Table 4 Expression of HKⅡ and GS-1mRNA in C2C12 after electrical stimulation
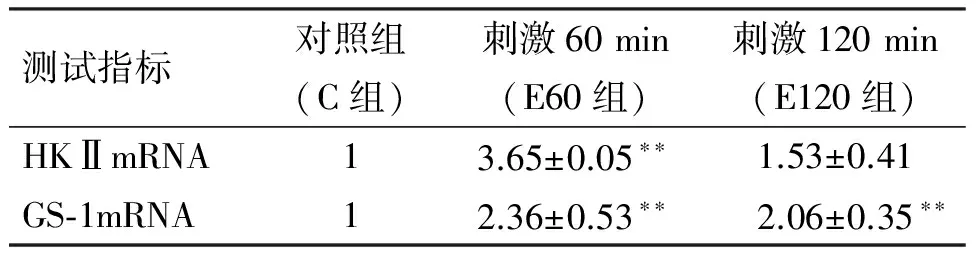
注:**表示与C组比较有极显著性差异(P<0.01).
哺乳动物的己糖激酶有4种同工酶,其特点、分布及生理作用各不同[32-33]. HKⅡ主要分布在糖代谢敏感的骨骼肌和脂肪组织中,其活性受多种因素(如肿瘤、缺氧等)通过AMPK、PKC等信号转导通路调节[34-35]. 己糖激酶Ⅱ(HKⅡ)能和线粒体外膜蛋白结合,更容易利用ATP从而加速糖原合成,同时还能向线粒体提供较多的ADP以加速三羧酸循环[36]. HKⅡ的催化作用更趋向于将G-6-P用于糖原再合成. G-6-P还可负反馈抑制糖原磷酸化酶(GP)和正反馈激活糖原合成酶(GS),并作为糖原合成的底物[37]. 当肌糖原储量较丰富,运动强度较大时,肌糖原分解产生较多的G-6-P,足以抑制HK活性而限制了肌肉摄取和利用血糖. 相反,在长时间运动后期肌糖原被大量消耗,分解生成的G-6-P减少时,对HK的抑制被减弱[16].AMPK可调节HKⅡ基因的表达. WINDER等[38]的研究显示:大鼠经AICAR作用后其GLUT4和HK含量均上升,线粒体内其它一些酶的活性也增加;红白肌中HK基因表达上调.
运动可增加红肌中GLUT4,HKII,COX-1, CS和 HAD 蛋白的含量.本研究中GLUT4基因表达和蛋白含量在2个刺激时间点均明显增加,这支持了KOVAL等[39]提出的“GLUT4/HK”介导的葡萄糖进入肌细胞是糖原合成的关键限速步骤的观点, GLUT4和HK相互配合,收缩先提高GLUT4对血糖入肌细胞的转运能力,HK在葡萄糖进入肌浆后即对其进行磷酸化[40],为糖原合成提供更多的原料. 而且,HK对葡萄糖的及时磷酸化还有利于降低肌细胞内葡萄糖的浓度,以及GLUT4对葡萄糖的继续转运[41].REN等[42]认为运动后GLUT4和HK活性的增加有利于运动后糖原的合成. 但电刺激时间延长至120 min时,肌管糖原含量、HKⅡmRNA表达却没有持续增加,可能与合成的糖原量与收缩消耗的糖原量不平衡有关,且肌管ATP储量的浄减少,不利于糖原合成的持续增加.
糖原合成酶(glycogen synthase,GS)的异构体GS-1、2分别存在于骨骼肌和肝脏中. 研究显示,GS-l是催化葡萄糖经磷酸葡萄糖转变成糖原的关键酶,与胰岛素抵抗有关. 在糖原合成的一系列步骤中,GS的活性调节涉及G-6-P的变构调节,以及上游激酶和磷酸酶的磷酸化和去磷酸化等作用[43]. 研究证实AMPK是糖原合成酶活性调节的上游激酶之一,许多在体及离体研究都发现AMPK可磷酸化GS的2号位点,减弱其活性. 在小鼠肌肉中,AMPK-α2亚基可能对GS活性的调节起最重要作用,但是也有研究表明AMPK-α2敲出小鼠进行跑台运动或是离体牵拉,GS的2号位点的磷酸化均能正常增加,这说明AMPK-α1可能也对GS活性的调节起作用[44].
本研究显示:电刺激60和120 min组GS-1mRNA表达均极显著高于对照组(P<0.01). 这符合运动后即刻糖原合成酶的活性和基因表达都会保持较高水平的规律. 有研究[45]发现:糖原合成酶活性在运动中下降,运动后上升到峰值. 魏守刚等[46]研究发现:耐力训练大鼠在力竭运动后24 h的恢复期中骨骼肌GS活性呈现运动后即刻降低、1 h内迅速升高、6 h后再次降低、24 h后又增高的变化;间歇性高强度训练大鼠运动后骨骼肌GS活性延迟性增高. 电刺激各组AMPK-α1的表达均显著升高,结合AMPK能抑制GS活性,但同时还能通过GLUT4增加葡萄糖摄取的研究结果[47],本文推测:HKⅡmRNA表达的升高加速了细胞内G-6-P含量的升高,后者变构激活GS,这一调节作用的强度可能超过了AMPK对其磷酸化失活作用的调节强度,因而导致了电刺激60 min细胞内糖原的含量没有下降,反而略有上升的现象. 但随着刺激和收缩时间的继续延长,肌糖原合成和消耗失衡,因而导致刺激时间达120 min时肌糖原含量显著下降的结果. 这些结果表明:运动中骨骼肌细胞虽然可以在一定时间内通过增加摄取环境中葡萄糖,加速自身糖原合成来满足其收缩的能量需要,但这种调节能力是有限的,如果不能及时终止运动,最终将导致其糖原含量减少、运动能力降低,进而出现运动性疲劳.
3 结论
本文采用不同时间电刺激的方法研究了小鼠骨骼肌母细胞(C2C12)的AMPK、HK-II、GS-1基因表达、以及GLUT4基因及蛋白表达等糖转运和代谢相关指标的变化,结果表明:骨骼肌细胞的肌糖原消耗随刺激时间延长而增加,为了保证骨骼肌细胞糖消耗的需要,可通过AMPK信号通路的调控,其膜对胞外糖转运的能力会随收缩时间延长而增强;骨骼肌细胞内糖原合成酶的合成则可随肌糖原储量的持续下降而增加.
[1] 刘晓莉, 张晓辉, 兰江.补充低聚糖对人体大强度运动能力的影响[J].中国临床康复, 2004, 8(3):516-517.
[2] MAROTTA M, BRAGS R, GMEZ-FOIX A M. Design and performance of an electrical stimulator for long-term contraction of cultured muscle cells[J]. Biotechniques, 2004,36(1):68-73.
[3] DERAVE W, EIJNDE B O, VERBESSEM P. Combined creatine and protein supplementation in conjunction with resistance training promotes muscle GLUT- 4 content and glucose tolerance in humans[J]. J Appl Physiol,2003,94(5):1910-1916.
[4] ADAMS J, CHEN Z P. Intrasteric control of AMPK via the γ1 subunit AMP allosteric regulatory site[J]. Protein Sci,2004,13(1):155-165.
[5] JOHN W S, SIMON A H, KEVIN A G, et al. CBS domains form energy-sensing modules whose binding of adenosine ligands is disrupted by disease mutations[J]. J Clin Invest,2004,113(2):274-284.
[6] HARDIE D G. Minireview: The AMP-Activated Protein kinase cascade: The key sensor of cellular energy status[J]. Endocrinology, 2003,144(12):5179-5183.
[7] 林强. 电刺激促进2型糖尿病大鼠骨骼肌细胞葡萄糖运载体4转位的细胞内机制研究[D].复旦大学硕士论文,2008
[8] FUJII N, HAYASHI T, HIRSHMAN M F, et al. Exercise induces isoform specific increase in 5′AMP-activated protein ki-nase activity in human skeletal muscle[J]. Biochem Biophys Res Commun. 2003,273(3): 1150-1155.
[9] CHEN Z P, MITCHELHILL K I, MICHELL B J, et al. AMPK signalingin contracting human skeletal muscle: acetyl-CoA carboxy-lase and NO synthase phosphorylation[J]. Am J Physiol, 2000,279(5):1202-1206.
[10] WOJTASZEWSKI J F, JORGENSEN S B, HELLSTEN Y, et al. Glycogen-dependent effects of 5-aminoimidazole- 4-carboxamide(AICA)-riboside on AMP-activated protein kinase andglycogen synthase activities in rat skeletal muscle[J]. Diabetes, 2002, 51(2): 284-292.
[11] DERAVE W, AI H, IHLEMANN J, et al. Dissociation of AMP-activated protein kinase activation and glucose transport incontracting slow-twitch muscle[J]. Diabetes, 2000,49(8):1281-1287.
[12] SEAN L, MCGEE, KIRSTEN H, REBECCA L S, et al. Exercise increases nuclear AMPK α2 in human skeletal muscle[J]. Diabetes,2003,52(4):926-928.
[13] HAYASHI T, HIRSHMAN M F, KURTH E J, et al. Evidence for 5′AMP-activared protein kinase mediation of the effect of muscle contraction on glucose transport[J]. Diabetes,1998,47(8):1369-1373.
[14] HARDIE D G, HAWLEYET S A. AMP-activated protein kinase-development of the energy sensor concept[J]. J Physiol,2006,574(1):7-15.
[15] TOYODA T, TANAKA S, EBIHARA K, et al. Low-intensity contraction activates the alphal-isoform of 5′-AMP-activated protein kinase in rat skeletal muscle[J]. Am J Physiol Endocrinol Metab, 2006, 290(3): 583-590.
[16] 许豪文.运动生物化学概论[M]. 北京:高等教育出版社.2001.
[17] FRITAH A, STEEL J H, PARKER N, et al. Absence of RIP140 reveals a pathway regulating GLUT4-dependent glucose uptake in oxidative skeletal muscle through UCP1-mediated activation of AMPK[J]. PLoS One,2012,7(2):E32520.
[18] WEBER-CARSTENS S, SCHNEIDER J, WOLLERSHEIM T, et al. Critical illness myopathy and GLUT4: significance of insulin and muscle contraction[J]. Am J Respir Crit Care Med, 2013, 187(4):387-396.
[19] 李世昌,赵贤,费朵.MEF2对肌生成的作用及运动对其影响的分子机制[J].中国运动医学杂志, 2009,28(5):585-589.
[20] OJUKA E O, JONES T E, NOLTE L A, et al. Regulation of GLUT4 biogenesis in muscle:evidence for involvement of ampk and ca2+[J]. Am J Phy, 2001,282(5):1008-1013.
[21] 李良刚,陈槐卿. 减少和抑制核HDACS对骨骼肌细胞GLUT4基因表达的影响[J]. 体育科学, 2007,27(12):20-26.
[22] VI V, BUI P, EGUCHI M, et al. Adiponectin induces LKB1/AMPK-dependent glucose uptake via actin cytoskeleton remodeling[J]. J Mol Endocrinol,2013, 51(1):155-165.
[23] DALLA-RIVA J, STENKULA K G, PETRLOVA J, et al.Discoidal HDL and apoA-I-derived peptides improve glucose uptake in skeletal muscle[J]. J Lipid Res, 2013,54(5):1275-1282.
[24] SONG P, KIM J H, GHIM J, et al. Emodin regulates glucose utilization by activating AMP-activated protein kinase[J]. J Biol Chem,2013,288(8):5732-5742.
[25] LEE J O, LEE S K, KIM J H, et al. Metformin regulates glucose transporter 4 (GLUT4)translocation through AMP-activated protein kinase (AMPK)-mediated Cbl/CAP signaling in 3T3-L1 preadipocyte cells[J]. J Biol Chem, 2012, 287(53):44121-44129.
[26] SHEN J Z, MA L N, HAN Y,et al. Pentamethylquercetin generates beneficial effects in monosodium glutamate-induced obese mice and C2C12 myotubes by activating AMP activated protein kinase[J]. Diabetologia,2012,55(6):1836-1846.
[27] UEDA M, HAYASHIBARA K, ASHIDA H. Propolis extract promotes translocation of glucose transporter 4 and glucose uptake through both PI3K and AMPK dependent pathways in skeletal muscle[J].Biofactors,2013 Jul,39(4):457-466.
[28] KIM M S, HUR H J, KWON D Y, et al. Tangeretin stimulates glucose uptake via regulation of AMPK signaling pathways in C2C12 myotubes and improves glucose tolerance in high-fat diet-induced obese mice[J].Mol Cell Endocrinol,2012,358(1):127-134.
[29] HABEGGER K M, HOFFMAN N J, RIDENOUR C M, et al. AMPK enhances insulin- stimulated GLUT4 regulation via lowering membrane cholesterol[J]. Endocrinology, 2012,153(5):2130-2141.
[30] SYLOW L, JENSEN T E, KLEINERT M,et al. Rac1 is a novel regulator of contraction stimulated glucose uptake in skeletal muscle[J]. Diabetes, 2013, 62(4):1139-1151.
[31] GONG H, XIE J, ZHANG N, et al. MEF2A binding to the GLUT4 promoter occurs via an AMPKα2-dependent mechanism[J]. Med Sci Sports Exerc, 2011, 43(8): 1441-1450.
[32] POSTIC C, LETURQUE A, PRINTZ R L, et al. Development and regulation of glucose transporter and hexokinase expression in rat[J]. Am J Physiol,1994,266: 548-549.
[33] ALLEN C B, GUO X L, WHITE C W. Changes in pulmonary expression of hexokinase and glucose transporter mRNAs in rats adapted to hyperoxia[J]. Am J Physiol,1998,274: 320-329.
[34] ROBEY R B, MA J F, SANTOS A V P. Regulation of mesangial cell kexokinase activity by PKC and the MAPK pathway[J]. Am J Physiol,1999(277):742-749.
[35] BRAITHWAITE S S, PALAZUK J R, CLOCA C W, et al. Reduced expression of hexokinase Ⅱ in insulin-resistant diabetes[J]. Diabetes, 1995(44):43-48.
[36] 黄勇奇,吴耀生.己糖激酶-Ⅱ与肿瘤的糖代谢[J].生命的化学,2004,24(4):342-344.
[37] 黄涛,孙海生,夏志.AMPK、能量代谢与运动的关系研究[J].吉林体育学院学报,2006,22(4):64-65.
[38] WINDER W W, HOLMES B F, RUBINK D S, et al. Activation of AMP-activated protein kinase inereases mitoehondrial enzymes in skeletal musele[J]. J Appl Physiol,2000,88(6):2219-2226.
[39] KOVAL J A, DEFRONZO R A, O′DOHERTY R M, et al. Regulation of HKII activity and expression in human muscle by moderate exercise[J]. Am J Physiol. Endocrinol. Metab, 1998(274): 304-308.
[40] 韩素萍,张承玉.黄芪生药对游泳大鼠糖代谢相关酶影响的研究[J].中国体育科技, 2008,44(2):129-132.
[41] HOLLOSZY J O, HANSEN P A. Regulation of glucose transport into skeletal muscle.In:Reviews of Physiology[M]. Berlin:Springer-Verlag, 1996,128, 99-193.
[42] REN J M, SEMENKOVICH E A, GULVE J, et al. Exercise induces rapid increases in GLUT4 expression,glucose transport capacity,and insulin-stimulated glycogen storage in muscle[J].J Biol Chem,1994,269:14396-14401.
[43] YU H, HIRSHMAN M F, FUJII N, et al.Muscle-specific overexpression of wild type and R225Q mutant AMP-aetivated Protein kinase gamma-3 subunit differentially regulates glycogen accumulation[J]. Am J Physiol Endocrinol Metab, 2006,291: 557-565.
[44] HALSE R, FRYER L G D, MCCORMACK J G. et al. Regulation of glycogen synthase by glucose and glycogen:A possible role for AMP-Activated protein kinase[J]. Diabetes, 2003(52):9-15.
[45] 全凯.不同运动强度后糖原合成酶以及相关指标的研究[D].北京:首都体育学院,2008.
[46] 魏守刚, 杨则宜, 高红. 不同运动训练方式和补剂对大鼠肌糖原生物合成的影响[J]. 中国运动医学杂志,2003,22(1):35-40.
[47] 周亮. 补糖和刺五加促进大鼠运动后糖原恢复的机理研究[D]. 北京:北京体育大学, 2006.
Keywords: skeletal muscle cells; electrical stimulation; carbohydrate metabolism; signaling pathway
EffectsofDifferentTimeElectricalStimulationonCarbohydrateMetabolisminSkeletalMuscleCell
XU Xiaoyang*, YAN Xujie, ZHOU Zhou, PAN Hongying, ZHAO Xiufeng
(College of Sports Science, South China Normal University, Guangzhou 510631, China)
The aim of this study was to measure the changes in cellular glucose intake and carbohydrate metabolism in mouse C2C12 skeletal muscle cells, and to investigate the effect on skeletal muscle cells carbohydrate metabolism by electrical stimulation of different times as well as the possible mechanism. Glycogen consumption increased continuously with prolonged contraction of skeletal muscle cells.The capacity of glucose translocation across the cell membrane was enhanced with the increase of contraction time. The activity of glycogen synthase was increased due to declining muscle glycogen reserves after 60 and 120 min electrical stimulation.And all of these changes were possibly regulated by theAMPKsignaling pathway.
2013-08-25
广东省体育局2012~2013奥运全运专项攻关项目(201220NS046)
*通讯作者:徐晓阳,教授,Email:xuxy@scnu.edu.cn.
1000-5463(2013)06-0155-06
G804.7
A
10.6054/j.jscnun.2013.09.021
【中文责编:谭春林 英文责编:李海航】

