饲喂果葡糖浆对意大利蜜蜂解毒酶的影响
孟丽峰,靳三省,刁青云
(中国农业科学院 蜜蜂研究所,北京100093)
糖类是蜜蜂生长发育所需碳水化合物和能量的主要来源,在维持蜂群健康、个体免疫能力和工蜂分工方面起着重要作用[1]。在自然条件下蜜蜂主要采集植物花蜜、蜜露等,经过一系列复杂的过程,最终转化成主要含果糖和葡萄糖的物质贮存在蜂巢中。养蜂者为了刺激蜜蜂繁育达到壮群的目的,经常奖励饲喂白砂糖。此外,在蜜源枯竭、冬季越冬期间也必须人工饲喂白砂糖,维持群势。白砂糖是蜜蜂饲养过程中主要的人工饲料糖。
近年来,随着白砂糖价格的持续高涨,养蜂者已经开始使用果葡糖浆代替蔗糖进行冬季饲喂。果葡糖浆主要由酶法转化玉米淀粉得到,玉米淀粉在α-淀粉酶的作用下生成麦芽低聚糖,麦芽低聚糖在淀粉转葡糖苷酶的作用下生成液化葡萄糖,在葡萄糖异构酶的作用下,一部分葡萄糖生成果糖,最终形成由葡萄糖和果糖组成的混合糖浆[2-3],果葡糖浆甜度和蔗糖接近,高浓度下不易结晶,偏酸性,不易发酵有利于储存,价格低廉,经常用作蜜蜂的饲料。目前对于果葡糖浆饲喂蜜蜂的风险性评估还较少,特别是机理更不清楚。Barker 等[4]报道,以蜂蜜为对照,饲喂果葡糖浆对蜜蜂的寿命没有影响,但是果糖在有机酸和矿物质的作用下水解产生羟甲基糠醛,对蜜蜂是有毒的,使蜜蜂寿命缩短,出现类似痢疾的症状。王文祥等[5]研究发现饲喂果葡糖浆和饲喂白砂糖对意大利蜜蜂王台接受率、单个王台产浆量、蜂王初生体质量和工蜂体内的两种氧化酶Cu-Zn SOD 和CAT 的mRNA 表达量均无显著差异。然而,饲喂果葡糖浆对于蜜蜂体内解毒酶的影响还处于空白。本文以意大利蜜蜂体内3 种主要的解毒酶细胞色素P450、羧酸酯酶(CarE)、谷胱甘肽-S-转移酶(GSTs)为研究对象,比较饲喂果葡糖浆和蔗糖对意大利蜜蜂解毒酶的影响,以明确果葡糖浆对蜜蜂的安全性。
1 材料与方法
1.1 实验材料
1.1.1 供试昆虫 江西农业大学蜜蜂研究所饲养的意大利蜜蜂(Apis mellifera ligustica)。
1.1.2 实验用糖 果葡糖浆(江西天禾糖业发展有限公司,F42);蔗糖(广西华盛集团露躺糖业有限责任公司糖厂,一级)。
1.1.3 试剂及仪器 还原型辅酶Ⅱ四钠盐(NADPH)、二硫苏糖醇(DTT)含量均大于99%,购自Biomol公司;7 -羟基香豆素(7 -Hydroxycoumarin)98%、考马斯亮蓝G250、固蓝B 盐Fluka 公司产品;α -乙酸萘酯(α -NA)、毒扁豆碱、十二烷基硫酸钠(SDS)、谷胱甘肽(GSH)、1,1 -二氯 -2,4 - 二硝基苯(CDNB)、均为Sigma 公司产品;牛血清白蛋白(BSA)购自北京同正生物公司;苯甲基磺酰氟(PMSF)99%,购自德国Merck 公司;Tris-base 美国Promega 公司产品;甘油、盐酸、氯化钾、氢氧化钠、磷酸二氢钾、磷酸氢二钠、甘氨酸(Gly)、三氯乙酸(TCA)、乙二胺四乙酸(EDTA)、无水乙醇、96%乙醇,均为分析纯,购自北京化学试剂公司。
5417R 型高速离心机(德国eppendoff 公司产品),SPH-100B 型恒温振荡器(上海世平实验设备公司产品),LS55 型荧光分光光度计(英国Perkin Elmer 公司产品),UV2200 紫外可见分光光度计(上海天普分析仪器有限公司产品),Lambda Bio-45 紫外-可见分光光度计(美国Perkin-Elmer 公司产品)。
1.2 实验方法
1.2.1 蜂群饲养管理 选用群势一致的健康意大利蜜蜂10 群,随机分成2 组,每组5 群,处理组饲喂果葡糖浆,对照组饲喂蔗糖。试验期间,外界缺少蜜源,定期检查蜂群并进行饲喂,以保证蜂群内有充足的食物,其它饲养条件(如自由采水、防病等)也调整一致。饲喂果葡糖浆两个月后,开始取样。成年工蜂取样后放置于温度33 ℃、相对湿度70%的培养箱中饥饿4 h 后,进行酶液制备。
1.2.2 酶液制备 CarE 酶液的制备方法:取意大利蜜蜂腹部加入预冷的pH 7.0,0.04 mol/L 的磷酸缓冲液中,冰浴匀浆,4 ℃,10 800 r/min 离心10 min,取上清液,在预冷的抽滤瓶内用两层滤纸抽滤,滤液作为CarE 测定的粗酶液,剩余酶液贮存于-20 ℃冰箱用于蛋白含量的测定。
GSTs 酶液的制备方法:同CarE 的制备,所需缓冲液为pH 6.5 的磷酸缓冲液。
细胞色素P450 酶液的制备,参照于彩虹和高希武[6]的方法:取蜜蜂大幼虫加入预冷的pH 7.50,1 mol/L的磷酸缓冲液(含50 mmol/L DDT,50 mmol/L PMSF,1 mmol/LEDTA,10%甘油)冰浴匀浆,4 ℃,10 800 r/min离心10 min,取上清液,在预冷的抽滤瓶内用两层滤纸抽滤,滤液作为P450 测定的粗酶液,剩余酶液贮存于-20 ℃冰箱用于蛋白含量的测定。
1.2.3 细胞色素P450O-脱乙基活性测定 参考Hung 和Sun[7]的方法,利用荧光分光光度计检测细胞色素P450 对底物7 -乙氧基香豆素的脱乙基活性,通过其产物7 -羟基香豆素的荧光变化值来确定酶的活性。反应体系:1 mL 反应体系,含0.1 mol/L 的Tris -HCl,10 mmol/L 的NADPH 和7 - 乙氧基香豆素,原酶液,37 ℃,220 转恒温振荡器反应15 min,15%三氯乙酸(TCA)终止反应,10 800 r/min离心
1 min。用移液枪吸取1 mL 注入比色皿,加入450 μL 甘氨酸-氢氧化钠(Gly -NaOH),摇匀,在34 ℃条件下测定荧光值。所有的实验均在室温条件下进行,每一个实验重复3 次。
1.2.4 CarE 活力的测定 参照Hama 等[8]比色测定法:反应体系3.7 mL,包括0.04 mol/L pH 7.0磷酸缓冲液,3 ×10-2mol/L α - 乙酸萘酯(内含毒扁豆碱,终浓度3 ×10-4mol/L),原酶液,30 ℃水浴下反应15 min,加入显色剂(1%固蓝B 盐和5%SDS 以2∶5 混合)终止反应,对照加入等量缓冲液代替原酶液。15 min 后在600 nm 下测定吸光度值。所有的实验均在室温条件下进行,每1 个实验重复3 次。
1.2.5 GSTs 活性的测定 参照Habig 等[9]方法,反应体系900 μL:包括pH 6. 5 磷酸缓冲液,30 mmol/LGSH,30 mmol/L CDNB,适量酶液,在25 ℃恒温下于340 nm 波长处,用时间驱动程序测定其吸光值在2 min 内的变化值。所有的实验均在室温条件下进行,每1 个实验重复3 次。
1.2.6 酶源蛋白含量测定 采用Bradford 考马斯亮蓝G-250 法(Bradford,1976)[10]。
1.2.7 数据分析 所有数据都用SPSS 软件进行分析,方法用成组法t 检验(Two -Samples T-Test)进行分析。
2 结果与分析
2.1 饲喂果葡糖浆对蜜蜂大幼虫体内细胞色素P450 的影响
如图1 所示:以蔗糖为对照,用果葡糖浆饲喂蜜蜂2 个月后,蜜蜂大幼虫体内的细胞色素P450 比活力为0.20[pmol/(min·mgPro)],蔗糖组P450 比活力为0.19[pmol/(min·mgPro)],较对照组活性有所升高但是与对照组差异不显著(P=0.098 >0.05)。
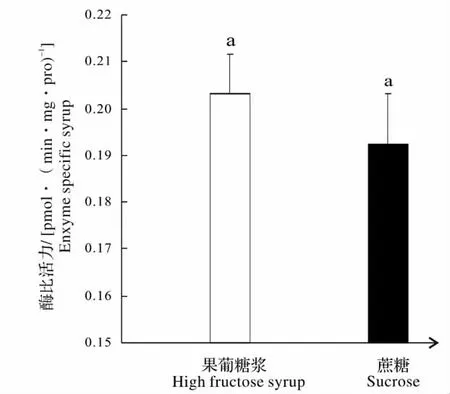
柱形图上方小写字母a 表示差异不显著。The letter a on the bars indicate that the means are not significant between the treatment and the control.图1 果葡糖浆对蜜蜂大幼虫P450 活性的影响Fig.1 Effects of high fructose syrup diet on the activities of the P450 in larvae.
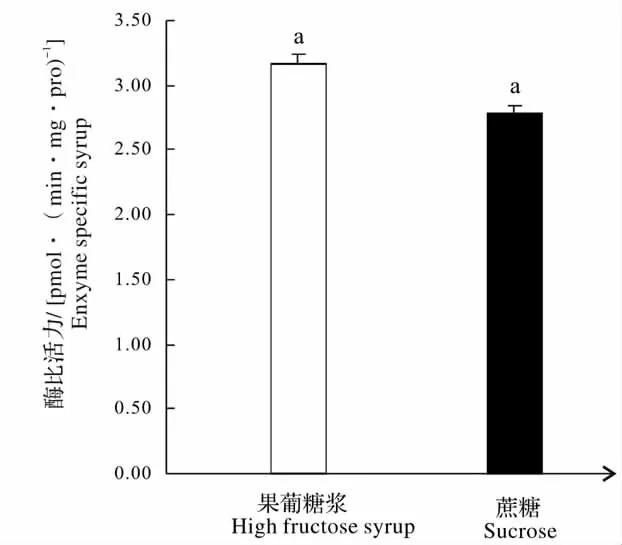
柱形图上方小写字母a 表示差异不显著。The letter a on the bars indicate that the means are not significant between the treatment and the control.图2 果葡糖浆对意大利蜜蜂CarE 的影响Fig.2 Effects of high fructose syrup diet on the activities of CarE in honeybees Apis mellifera ligustica
2.2 饲喂果葡糖浆对蜜蜂工蜂腹部CarE 的影响
如图2 所示饲喂果葡糖浆两个月后,蜜蜂腹部的CarE 比活力为3.2[mmol/(min·mg·Pro)],蔗糖组酶比活力为2.8[mmol/(min·mg·Pro)],和对照组比较,饲喂果葡糖浆后蜜蜂腹部的CarE 活性升高但是与蔗糖组差异不显著(P =0.707 >0.05)。
2.3 饲喂果葡糖浆对蜜蜂工蜂腹部GSTs 的影响
如图3 所示,饲喂果葡糖浆后蜜蜂腹部GSTs的比活力为0.42[mmol/(min·mg·Pro)],对照比活力为0.43[mmol/(min·mg·Pro)],果糖浆对蜜蜂腹部的GSTs 活性无显著影响(P =0.179 >0.05)。GSTs 属于第2 阶段解毒酶,CarE 和P450都属于第1 阶段水解酶,由以上结果可以得出:果葡糖浆在一定程度上能够提高第1 阶段水解酶的比活力,但是对第2 阶段解毒酶无影响。
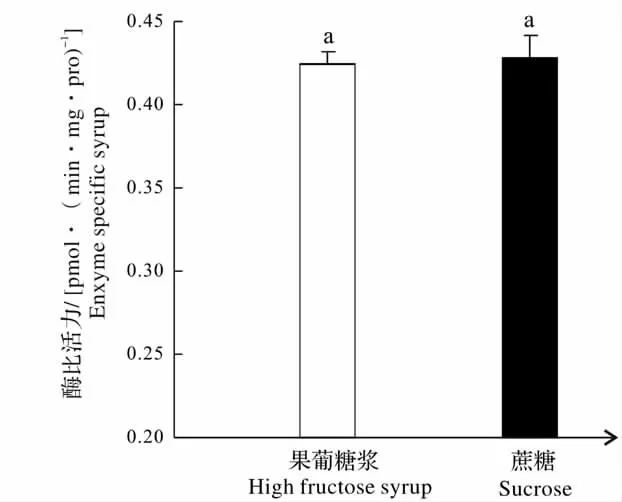
柱形图上方小写字母a 表示差异不显著。The letter a on the bars indicate that the means are not significant between the treatment and the control.图3 果葡糖浆对意大利蜜蜂GSTs 的影响Fig.3 Effects of high fructose syrup diet on the activities of GSTs in honeybees Apis mellifera ligustica
3 讨论
近年来,由于蔗糖价格不断上涨,果葡糖浆被大量用于蜜蜂饲喂,但是有不少养蜂者反应,用果葡糖浆代替白砂糖喂蜂后出现了群势变弱或者见卵不见虫的现象[11]。果葡糖浆F42 饲喂熊蜂后对蜂王寿命、蜂王后期的产卵率、工蜂始出日、转箱率、成群率、产出新王数等无显著影响,但是显著降低了新生熊蜂蜂王的体重及大小[12]。Severson 等[13]发现饲喂果葡糖浆后春季封盖子的数量显著低于饲喂蔗糖组,但是对蜂群的群势和新出房工蜂的体重无显著影响。其原因可能是果葡糖浆在制作的过程中水解不彻底,生成一些低聚糖,而蜜蜂不能消化吸收低聚糖造成的。此外,也有可能是果葡糖浆中的羟甲基糠醛造成的。
细胞色素P450、羧酸酯酶、谷胱甘肽-S-转移酶是昆虫体内普遍存在的3 种主要的解毒酶。和其它昆虫比较,蜜蜂具有较少的编码解毒酶的基因,但是这些解毒酶在蜜蜂代谢杀虫剂、植物化学物质、真菌毒素等方面起着重要的作用[14-15],其中目前研究发现最重要的一种酶是细胞色素P450,它在蜜蜂代谢花粉、花蜜中存在的植物化学物质起着重要的作用,是蜜蜂对氟胺氰菊酯、拟除虫菊酯等农药产生抗性的主要原因[16-17]。本实验结果表明:饲喂果葡糖浆2 个月后,对蜜蜂大幼虫体内的细胞色素P450 活性无显著影响,与Johnson 等[18]对蔗糖、果葡糖浆、蜂蜜等不同的蜜蜂饲料对蜜蜂体内P450 活性无影响的结果一致。王文祥等[5]研究表明分别给意大利蜜蜂饲喂果葡糖浆和饲喂白砂糖,两组的王台接受率、单个王台产浆量、蜂王初生体质量和工蜂抗氧化酶基因mRNA 的表达量均无显著差异。本实验结果表明,饲喂果葡糖浆对蜜蜂体内的3 大解毒酶均无显著影响,但是果葡糖浆在一定程度上能够诱导第1 阶段解毒酶CarE 和P450 的表达,这可能与果葡糖浆水解不彻底有关。
饲喂果葡糖浆对蜂群的影响存在着季节性,秋天饲喂果葡糖浆后,春季蜂群中封盖子数量比饲喂蔗糖的少,但是如果在春季饲喂果葡糖浆则不影响后期封盖子的数量,奥地利养蜂者发现在7 月份和10 月份之间饲喂果葡糖浆对蜜蜂越冬的死亡率无不良影响[19]。唐晓伟[20]对意大利蜜蜂P450随季节的变化规律研究发现:春季解毒酶的活性高于秋季,这可能是果葡糖浆对蜜蜂的影响存在季节性的一个原因。
果葡糖浆在有机酸和高温的作用下很容易生成羟甲基糠醛(HMF),蜂蜜在长时间的储存过程中也可以产生HMF[21]。近年来已有研究表明:羟甲基糠醛对蜜蜂是有毒的。此外,随着HMF 产生的乙酰丙和甲酸对蜜蜂也是有毒的,其毒性和HMF 接近[22],但是目前并未发现HMF 对蜜蜂体内解毒酶影响的报道。Jachimowicz 等[23]研究发现:在实验室条件下,饲喂150 μL/L HMF 的蜜糖溶液20 d 后,蜜蜂的死亡率为58.7%,同样条件下,饲喂30 μL/L HMF 溶液对蜜蜂的存活率无显著影响,因此,当糖饲料中含有的HMF 小于30 μL/L 时被认为对蜜蜂是安全的。LeBlance 等[24]用高效液相色谱测定了美国市面上果葡糖浆中HMF 的含量是28.7 μL/L。因此,合格的果葡糖浆是可以用于蜜蜂饲喂的,但是果葡糖浆在40 ℃下贮存69 d HMF 的含量可以达到250 μL/L,因此,果葡糖浆一定要合理的储存。
通过本实验和前人的研究得出:生产合格的果葡糖浆是可以喂蜂的,饲喂果葡糖浆2 个月对蜜蜂体内的解毒酶、抗氧化酶和蜜蜂的寿命等方面并无显著影响。长期饲喂对蜜蜂生长、群势、生产能力、解毒能力等方面的影响还有待于继续研究。
本实验结果表明:以蔗糖作为对照,饲喂果葡糖浆对蜜蜂体内的3 大解毒酶均无显著影响,但是对第1 阶段解毒酶CarE、P450 和第2 阶段解毒酶GSTs 影响不同,本实验结果为果葡糖浆能否饲喂蜜蜂提供了理论依据,从生化水平上说明了优质、生产合格的果葡糖浆是可以喂蜂的,为果葡糖浆饲喂蜜蜂的风险性评估提供参考数据。
[1]Toth A L,Robinson G E.Worker nutrition and division of labour in honeybees[J].Animal Behaviour,2005,69(2):427-435.
[2]Long J E.High fructose corn syrup[J].Food Sci Technol,1991,48:247 -258.
[3]Buck A W.High fructose corn syrup[J].Food Sci Technol,2001,112:391 -411.
[4]Barker R J,Lehner Y.Laboratory comparison of high fructose corn syrup,grape syrup,honey,and sucrose syrup as maintenance food for caged honey bees[J].Apidologie,1978,9(2):111 -116.
[5]王文祥,刘婷婷,吴小波.饲喂果葡糖浆对意大利蜜蜂蜂群的影响[J].江西农业大学学报,2012,34(4):786 -790.
[6]于彩虹,高希武.棉铃虫细胞色素P450 CO 差光谱的测定[J].昆虫学报,2005,48(2):301 -304.
[7]Hung C F,Sun C N.Microsomal monooxygenases in diamondback moth larvae resitant to fenvalerate and piperonyl butoxide[J].Pestic Bochem Physiol,1989,33(2):168 -175.
[8]Hama H.Resistance to insecticide due to reduced sensitivity of acetylcholinesterase[M].New York:Plenum press,1983:299 -331.
[9]Habig W H,Pabst M J,Jakoby W B.Glutathione -S -transferases AA form rat liver[J].Arch biochem Biophys,1976,175(2):710 -716.
[10]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding[J].Anal Biochen,1976,72(1/2):248 -254.
[11]郑火青,胡福良.果葡糖浆用作蜜蜂饲料的安全性探讨[J].中国蜂业,2012,63(3):12 -13.
[12]廖思米.果葡糖浆、EM 原露及内寄生螨对熊蜂蜂群发育的影响[D].雅安:四川农业大学,2008.
[13]Severson D W,Erickson E H.Honey bee (Hymenoptera:Apidea)colony performance in relation to supplemental carbohydrates[J].Economic Entomology,1984,77(6):1473 -1478.
[14]Claudianos C,Ranson H,Johnson R,et al. A deficit of detoxification enzymes:pesticide sensitivity and environmental response in the honeybee[J].Insect Molecular Biology,2006,15(5):615 -636.
[15]Niu G D,Johnson R M,Berenbaum M R.Toxicity of mycotoxins to honeybees and its amelioration by propolis[J].Apidologie,2011,42(1):79 -87.
[16]Mao W,Rupasinghe S G,Johnson R M.Quercetin -metabolizing CYP6AS enzymes of the pollinator Apis mellifera(Hymenoptera:Apidae)[J].Comp Biochem Physio,2009,154(4):427 -434.
[17]Johnson R M,Wen Z,Schuler M A.Mediation of pyrethroid insecticide toxicity to honey bees (Hymenoptera:Apidae)by cytochrome P450 monooxygenases[J].Economic Entomology,2006,99(4):1046 -1050.
[18]Johnson R M,Mao W F,Pollock H S.Ecologically appropriate xenobiotics induce Cytochrome P450 in Apis mellifera[J].PLoS ONE,2012,7(2):31051.
[19]Ceksteryte V,Racys J.The quality of syrups used for bee feeding berore winter and their suitability for bee wintering[J].A-pic Sci,2006,50(1):5 -14.
[20]唐晓伟.西方蜜蜂细胞色素P450 单加氧酶特性的初步研究[D].北京:中国农业科学院,2011.
[21]Sancho M T,Muniategui S,Huidobro J F.Aging of honey[J].Agric Food Chem,1992,40(1):134 -138.
[22]Bailey L.The effect of acid-hydrolyzed sucrose on honeybees[J].Apic Res,1965,5(3):127 -136.
[23]Jachimowicz T,Sherbiny G.Problems of invert sugar as food for honeybees[J].Apidologie,1975,6(2):121 -143.
[24]LeBlanc B W,Eggleston G,Sammataro D,et al.Formation of hydroxymethylfurfural in domestic high-fructose corn syrup and its toxicity to the honey bee[J].Agric Food Chem,2009,57(16):7369 -7376.

