三带喙库蚊抗性水平与其对乙脑病毒易感性关系的研究*
吴治明 汪中明 李春晓 郭晓霞 阎 婷王 刚 朱小娟 张恒端 董言德 赵彤言**
(1.安徽医科大学,合肥 230032;2. 军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071)
流行性乙型脑炎(Japanese encephalitis,乙脑)是由蚊虫传播的病毒性疾病,主要引起中枢神经系统损害。它的病原体是黄病毒科(Flaviviridae)、黄病毒属(Flavivirus)的乙型脑炎病毒( Japanese encephalitis virus, JEV )。我国除新疆、西藏、青海外均为乙脑疫区,主要病例发生在儿童,病死率较高,后遗症严重,目前虽已有疫苗可供预防,但局部地区仍时有暴发或流行(郭杨等,2008;郭海强等,2011),对媒介蚊虫的控制仍是预防乙脑的关键措施。
三带喙库蚊Culextritaeniorhynchus是我国乙脑的主要传播媒介(王逸民等,1990)。在媒介蚊虫的防治中,化学防治因具有实施方便、见效快等特点而得到广泛应用(陆宝麟,2000)。三带喙库蚊孳生地多为稻田,广泛接触农业用杀虫剂,由于杀虫剂的连续大量使用,加之蚊虫世代历期短、繁殖力强等因素,导致了三带喙库蚊抗药性的发生和发展。目前我国很多地区三带喙库蚊已经对多种杀虫剂产生了不同程度的抗性(周明浩等,2006;刘洪霞等,2008;孙养信等,2009a,2009b,2011;杨维芳等,2011)。
随着对多种与蚊虫抗性相关解毒代谢酶类的深入研究,已分离和鉴定出多种与抗性相关的基因,人们逐渐认识到,蚊虫往往从多个生理途径进化出一系列复杂的机制来抵御某种药物侵害(McCarrolletal., 2001;Hemingwayetal., 2000a;崔峰等, 2007),而这些机制的产生会给蚊虫带来某些生理生化特性的改变。对致倦库蚊敏感品系和抗性品系的研究发现,抗性蚊虫的酯酶在中肠、真皮层、马氏管、唾液腺等组织中高量表达,改变了细胞的氧化还原能力(Hemingwayetal., 2000b)。细胞氧化还原能力的改变,可能会改变中肠结构细胞表面电荷的分布从而阻止病毒对细胞的感染及病毒穿过中肠向血淋巴的释放,最终会影响蚊虫的媒介效能。研究还发现,拟除虫菊酯抗性蚊虫通过升高谷胱甘肽转移酶含量来减少脂质过氧化物的产生,使昆虫组织免受氧化性损伤,可能会有利于病原体的存活;相反,P450单加氧酶含量的升高,增加细胞的氧化作用而不利于病原体的存活(Vontasetal., 2001)。这些研究表明杀虫剂抗性的产生,有可能促进或抑制疾病的传播。
本研究通过野外采集不同种群三带喙库蚊,测定其对两种常用拟除虫菊酯类杀虫剂的抗性水平,同时进行乙型脑炎病毒的感染实验。以期了解自然环境中三带喙库蚊抗药性水平与其对乙脑病毒的易感性之间的关系,对乙脑的防治具有重要的意义。
1 材料与方法
1.1 材料
1.1.1实验虫株: 三带喙库蚊的实验室品系(LAB)由陕西省疾病预防控制中心引进,野外采集后连续饲养3年多,未接触任何杀虫剂。野外种群是在2011年7~8月采集的陕西安康建民种群(AKJM)(32°42′57″N,108°56′42″E)、江苏南京江浦种群(NJJP)(32°01′18″N,118°28′54″E)和安徽濉溪南坪种群(SXNP)(33°50′16″N,116°88′53″E)。采集场所均为养猪场,用电动吸蚊器多次采集饱血后的三带喙库蚊成蚊,带回养虫室产卵孵化,利用繁殖的第1代(安康建民种群有F1和F3代)进行生物测定和感染实验。养殖条件:温度26±1 ℃、相对湿度75%±5%、光照14 h/d。
1.1.2实验用鼠:昆明(KM)乳鼠,1~3日龄时对病毒最敏感,用于病毒的鼠脑传代; KM小鼠,成年,用于采新鲜鼠血,以上实验用昆明鼠均购于军事医学科学院实验动物中心。
1.1.3病毒:乙型脑炎病毒(GenBank No.L48961)毒种由本所菌毒种保藏中心提供。
1.1.4质粒和菌株:pMD18-T Vector购自宝生物工程(大连)有限公司;宿主菌大肠杆菌E.coliXL1-blue,本实验室保存。
1.1.5工具酶和主要试剂:溴氰菊酯(98.7%)和高效氯氰菊酯(99.0%)购自北京市和力顺科技有限公司,DMEM培养基购自美国Gibco公司,Trizol Reagent购自Invitrogen公司,RNA PCR Kit(AMV)Ver.3.0、Premix Version 2.0(Loading dye mix)、Agarose Gel DNA Purification Kit Ver 2.0试剂盒、DNA分子量标准DL 2000和限制性内切酶EcoRⅠ、HindⅢ购自宝生物工程(大连)有限公司(TaKaRa),IPTG和X-gal购自上海生工生物工程技术服务有限公司,质粒快速提取试剂盒购自北京博大泰克公司。
1.2 实验方法
1.2.1幼虫半数致死浓度(LC50值)测定:对实验室品系及野外种群的幼虫做毒力测定。采用浸渍法(刘维德,1983),将杀虫剂母液用丙酮配制成5~7个浓度,容器中加199 mL过夜清水,放入30头Ⅲ龄末Ⅳ龄初幼虫,加1 mL不同梯度浓度的药液,1 mL丙酮作对照,重复3次,24 h后观察结果,以幼虫不能逃避机械刺激为死亡。将存活个体在-70 ℃条件下保存,用于后续实验。用SPSS软件进行数据统计,记录处理虫数。通过分析获得致死中浓度LC50值及其95%置信限(95% CI)。由于实验室品系三带喙库蚊未完全回复到敏感状态,三带喙库蚊敏感品系幼虫对常用杀虫剂的LC50值参考以往文献记录数值(表1)(陈美文,1984; 张淑媛,1993)。
1.2.2三带喙库蚊经口感染乙脑病毒: (1)10%病毒鼠脑悬液的制备:取1窝1~3日龄的健康KM乳鼠,脑内接种病毒,每只0.03 mL,接种完成后放回笼中继续饲养,24 h内无非特异性死亡。逐日观察乳鼠生长情况,待乳鼠出现散窝、抽搐、弓背等发病症状,用75%酒精对发病乳鼠体表消毒后进行无菌解剖取鼠脑,加入DMEM培养液冰上研磨,制成10%的病毒鼠脑液(每个鼠脑重量约为0.2 g),12 000 r/min,离心10 min,取上清为病毒鼠脑悬液,沉淀作为阳性样本,于-70℃冻存。(2)经口感染:在感染实验前一晚将一定量羽化3~5 d的三带喙库蚊吸入小蚊笼中,断糖水。取成年的健康KM鼠,眼球取血共4 mL,加入1%的肝素钠抗凝剂防止凝血。将病毒鼠脑悬液、新鲜鼠血、8%过滤糖水按1∶1∶1体积配成12 mL病毒血餐,37℃水浴,另配制一份由DMEM培养液替代病毒鼠脑悬液的血餐,作为阴性对照。将海绵剪成适当大小,浸透血餐后盛放于小平皿中,放入小蚊笼中供蚊子吸血1 h。将小蚊笼放入手套隔离器中,挑选饱血雌蚊放入透明塑料杯中,以细密纱布封口,1只/杯。于26±1℃,相对湿度75%±5%,光照14 h/d环境中,以3%的糖水喂养,10 d后收样。将隔离器中剩余的蚊虫冻死,挑出饱血雌蚊冻存于-70℃,标记为0 d样本。阴性对照组的蚊虫直接饲育10 d后收样。
1.2.3RT-PCR检测蚊虫体内病毒核酸:(1)引物设计与合成:根据文献资料 (方美玉等,1997),使用Primer primier 6.0软件,设计了1对乙脑病毒通用引物。上游引物P101:5′-GTCAACCCCATAACTCTCACAGC-3′,下游引物P102:5′-ACGCAGAGGACTAGGAGCATTAC-3′,目的片段长度为1 227 bp。引物由赛百盛生物工程公司合成,用无RNA酶的水配成10 μmol/L应用浓度,于-20℃冻存备用。(2)成蚊总RNA的提取:取单头雌蚊,采用Invitrogen公司Trizol试剂提取三带喙库蚊总RNA(按操作手册进行)。提取的总RNA溶解于适量DEPC处理的无菌水中,立即进入cDNA第1链的合成。(3)反转录反应(RT反应): 反应体积20 μL,其中蚊RNA 2 μL ,25 mmol/L MgCl24 μL,10×RT Buffer 2 μL,RNase Free ddH2O 7.5 μL,各10 mmol/L dNTP Mixture 2 μL,40 U/μL RNase Inhibitor 0.5 μL,200 U/μL AMV Reverse Transcriptase 1 μL,50 pmol/μL Random 9 mol/μL,按以下条件进行:30 ℃,10 min;42 ℃,30 min,95 ℃,5 min;5 ℃,5 min。立即进入PCR扩增反应。 (4) PCR扩增: 反应总体积 50 μL,包括cDNA模板(RT反应产物)4 μL,Premix Taq 25 μL,10 mmol/L P101 2.0 μL,10 mmol/L P102 2.0 μL,ddH2O 17 μL。反应条件为: 94 ℃,5 min;94 ℃,30 s,50 ℃,30 s,72 ℃,1 min,35个循环;72 ℃,7 min。(5) PCR 产物纯化:按Agarose Gel DNA Purification Kit Ver 2.0 试剂盒(TaKaRa公司产品)说明书纯化回收PCR 产物。(6)克隆并测序:PCR纯化产物克隆入pMD18-T载体(TaKaRa),转化宿主菌XL-blue 1,在X-Gal和IPTG的存在下,经过蓝白斑筛选,PCR鉴定及酶切鉴定,挑选阳性克隆菌液送至上海生工公司进行测序,将所得的核酸序列进行去载体、拼接、去冗余处理后,将结果与美国国家生物技术信息中心(NCBI)数据库中的部分已知物种核酸序列进行相似性比对。(7)电泳检测阳性样本:以DNA DL2000 Marker作为分子量标准,取5 μL PCR反应产物用1.2%琼脂糖凝胶电泳分析,记录阳性样本数。
1.2.4统计与计算:用SPSS13.0软件进行数据统计,记录处理虫数。通过分析获得致死中浓度(LC50值)及其95%置信限(95%CL)、斜率值(slope)、标准误(SE)、卡方值(χ2)、自由度(df)。计算抗性指数,抗性指数(R/S)=野外种群LC50/参考敏感品系LD50。
2 结果
2.1 三带喙库蚊幼虫对两种常用拟除虫菊酯类杀虫剂的生物测定结果
本研究采用浸渍法,测定了各种群三带喙库蚊幼虫对溴氰菊酯和高效氯氰菊酯的半数致死浓度(LC50值)。结果表明,三带喙库蚊幼虫实验室品系、南京江浦种群F1代、濉溪南坪种群F1代、安康建民种群F1代和F3代对溴氰菊酯的LC50值分别为0.0009、0.0071、0.0160、0.0027和0.0025 mg/L,与参考的敏感品系数据相比,抗药性指数从2.30至40.05倍不等;对高效氯氰菊酯的LC50值分别为0.0043、0.0117、0.0528、0.0121和0.0141 mg/L,与参考的敏感品系数据相比,抗药性指数从2.13~26.42倍不等。可见,各自然种群三带喙库蚊幼虫对两种杀虫剂均产生了不同程度的抗性(表1)。
2.2 各地三带喙库蚊对乙脑病毒的易感性
采用经口感染的方法,对实验室品系和3个野外种群的三带喙库蚊进行了乙脑病毒的感染实验。三带喙库蚊吸食7.3 logPFU/mL 的乙脑病毒血餐10 d后,用RT-PCR方法检测蚊虫体内病毒,检测的片段经克隆、测序比对之后确定为乙脑病毒。结果显示:三带喙库蚊实验室品系、南京江浦种群F1、濉溪南坪种群F1代、安康建民种群F1代和F3代对乙脑病毒感染率分别为84.44%、80.56%、62.50%、86.00%和91.89%(图1,表2)。
2.3 三带喙库蚊抗性水平与其对乙脑病毒易感性的相关性分析
将三带喙库蚊对两种常用拟除虫菊酯类杀虫剂的抗药性指数与其对乙脑病毒的感染率作相关性分析,得到如下结果:三带喙库蚊幼虫对溴氰菊酯和高效氯氰菊酯的抗性水平与其对乙脑病毒的易感性的相关性明显。其中三带喙库蚊对乙脑病毒的感染率越低,其幼虫对溴氰菊酯的抗性指数越高(P=0.0167<0.05),相关系数为0.887,回归方程为:y=-1.295x+119.5(图2);同样,对乙脑病毒的感染率越低,其对高效氯氰菊酯的抗性指数也越高(P=0.0460<0.05),相关系数为0.783,回归方程为:y=-0.765x+71.52(图3)。

表1 各种群三带喙库蚊对2种常用拟除虫菊酯类杀虫剂的致死中浓度(LC50)测定及抗药性指数Tab.1 Resistance characteristics(LC50&R/S) of the different populations of Culex tritaeniorhynchus larva
注:SS:参考敏感品系;LAB:实验室种群;NJJPF1:南京江浦种群F1代;AKJMF1:安康建民种群F1代;AKJMF3:安康建民种群F3代;SXNPF1:濉溪南坪种群F1代。抗性指数(R/S)=野外种群LC50/参考敏感品系LD50。下同。
Note:RS:Reference sensitive population;LAB:Laboratory population;NJJPF1:F1 of Nanjing jiangpu population;AKJMF1:F1 of Ankang jianmin population;AKJMF3:F3 of Nanjing jiangpu population;SXNPF1: F1 of Suixi nanping population. Resistant ratio(R/S)=LC50of Resistant strain/LC50of sensitive strain. The same below.

图1 感染实验中三带喙库蚊样本感染乙脑病毒(JEV)的PCR扩增结果Fig.1 PCR amplification of Japanese encephalitis virus in Culex tritaeniorhynchusM:DL2000分子量标准;1:JEV鼠脑悬液;2:正常三带喙库蚊(阴性对照);3:感染JEV 0 d的三带喙库蚊;4,5,6:感染JEV 10 d的三带喙库蚊.M: DL2000 DNA Marker;1:Mix liquid with Japanese encephalitis virus;2:Normal Cx. tritaeniorhynchus;3:Cx. tritaeniorhynchus infected orally by Japanese encephalitis virus 0 day;4,5,6:Cx. tritaeniorhynchus infected orally by Japanese encephalitis virus 10 days later.

表2 三带喙库蚊成蚊对乙脑病毒的易感性Tab.2 Susceptibility of Culex tritaeniorhynchus infected orally by Japanese encephalitis virus
感染率=阳性个体数/检测个体总数×100%。
Infection rate=number of positive individuals/total number of detection individuals×100%.

图2 三带喙库蚊幼虫对溴氰菊酯抗药性指数与其对乙脑病毒感染率的相关性Fig.2 Correlation relationship between R/S of larval mosquito to deltapermethrin and infection rate of Culex tritaeniorhynchus infected orally by Japanese encephalitis virus(P=0.0167)
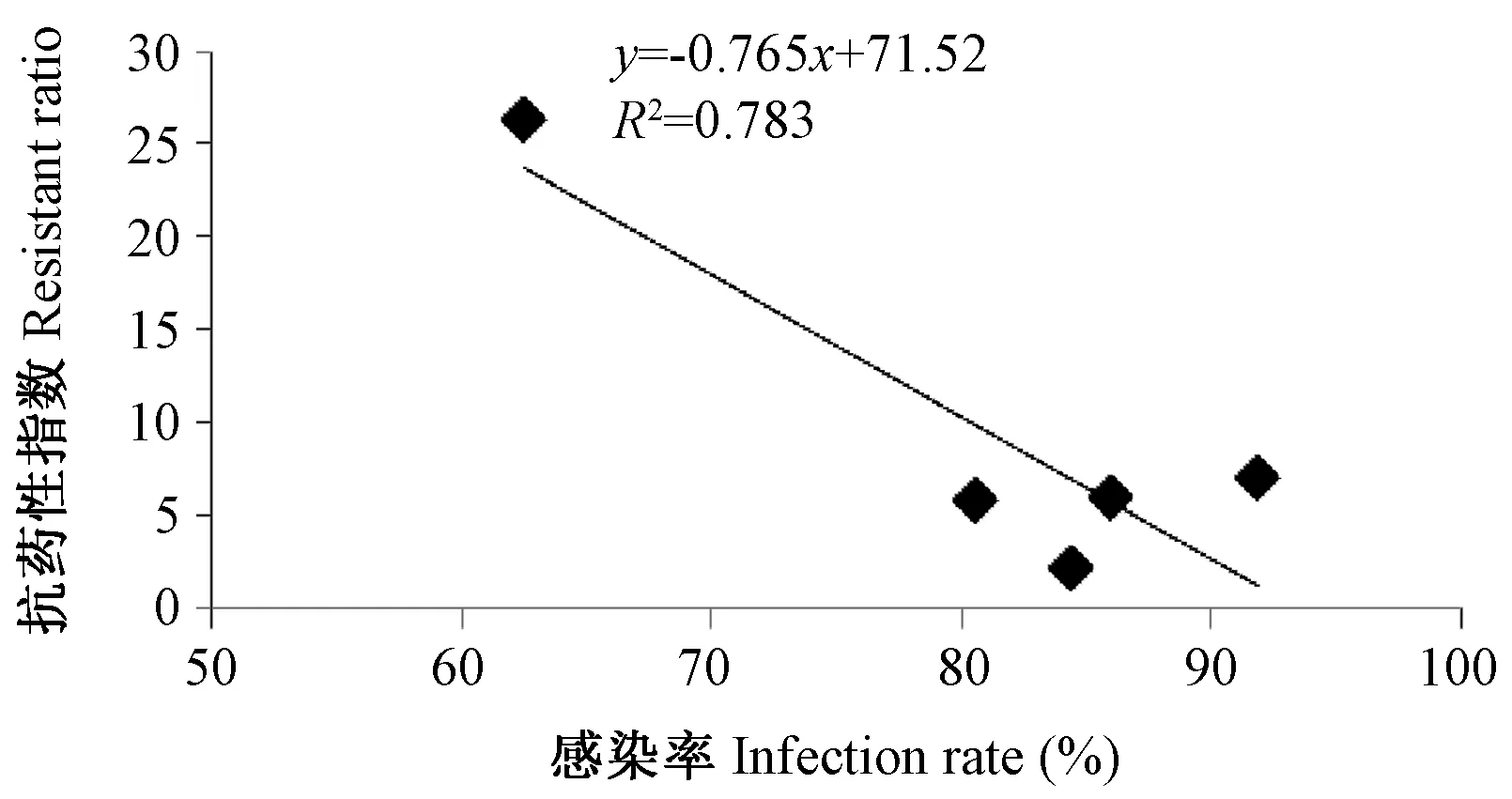
图3 三带喙库蚊幼虫对高效氯氰菊酯抗药性指数与其对乙脑病感染率的相关性Fig.3 Correlation relationship between R/S of larval mosquito to beta-cypermethrin and infection rate of Culex tritaeniorhynchus infected orally by Japanese encephalitis virus(P=0.0460)
3 讨论
蚊虫抗性的发生和发展受遗传、生物学、药剂和环境等方面因素的影响(唐振华等,2000;Nkyaetal., 2013)。在多种因素共同作用下,蚊虫对于杀虫剂的抗性水平千差万别。本研究根据对我国少数几个地区三带喙库蚊幼虫生物测定的结果,结合以往各地的调查数据(周明浩等,2006;刘洪霞等,2008;孙养信等,2009a,2009b,2011;杨维芳等,2011)表明:我国许多地区的三带喙库蚊已经对多种杀虫剂产生了不同程度抗性。具体表现为不同种类杀虫剂的抗性水平不同,对有机磷类和氨基甲酸酯类杀虫剂抗性水平较高,对拟除虫菊酯类杀虫剂的抗性水平相对较低;不同地理种群三带喙库蚊对同一种杀虫剂的抗性水平不同,可能与杀虫剂的使用剂量和频率有关。
媒介蚊虫对虫媒病毒的易感性受到包括蚊虫的遗传背景因素、虫媒病毒的因素(滴度、毒力和血清型等)、环境因素(温度、湿度等)、蚊虫营养和个体大小等多种因素的影响(周光智等,2003)。蚊虫在长期的化学杀虫剂选择压力下,已从多个生理途径进化出抵抗这种选择压力的能力,而且这种能力是可以遗传的。根据抗性分子机制不同,蚊虫抗药性主要分为代谢解毒和靶标敏感。参与解毒代谢的酶类主要通过基因扩增和活性升高等方式抵抗杀虫剂,而靶标蛋白类主要通过基因突变,最终导致蛋白质结构改变的方式抵抗杀虫剂的作用。这些改变发生的同时,也改变细胞表面电荷的分布和神经递质的正常传递,影响了蚊虫细胞的氧化还原能力,改变了蚊虫的生理生化功能(崔峰等, 2007)。蚊虫生理生化功能的改变,可能促进或抑制其对疾病的传播。因此,在媒介蚊虫的防治中,了解抗药性对蚊虫媒介效能的影响就显得尤为重要。
由于自然环境中蚊虫接触的杀虫剂种类繁多,其抗药性的产生是多种机制共同作用的结果,通过研究野外种群三带喙库蚊抗性水平与其对乙脑病毒易感性的相关性,更能反映自然环境中的真实情况。我们的研究结果显示:各野外种群三带喙库蚊幼虫对溴氰菊酯的抗性指数越高,其对乙脑病毒的感染率越低(P=0.0167<0.05);对高效氯氰菊酯的抗性指数越高,其对乙脑病毒的感染率也越低(P=0.0460<0.05)。表明三带喙库蚊在杀虫剂的选择压力下,其对乙脑病毒的易感性可能会受到一定的影响,但这种影响的机制尚待进一步研究。

