提取方式对板栗雄花序总黄酮抗氧化活性的影响研究
张利燕,常 虹,赵丽芹,周家华
(1.北京市农林科学院农业综合发展研究所,北京 100097;2.内蒙古农业大学,内蒙古呼和浩特 010018)
人体在新陈代谢过程中,随着氧的消耗会生成许多自由基,这些自由基是许多生理和病理过程的积极参与者,对机体危害极大[1],是导致人类癌症和心脏病等慢性疾病发生的主要原因之一[2]。食品在贮藏过程中,在外界因素的作用下会发生腐败变质。为了清除体内的自由基,降低人类患慢性疾病的可能,以及防止食品的腐败变质延长食品的保质期,经常在食品中添加一些人工合成的抗氧化剂。近年发现,人工合成抗氧化剂均具有一定的毒性,黄酮类化合物具有高效、低毒、廉价、抗氧化性强的特点,除此之外许多研究已表明,黄酮类化合物还具有多种生物活性,如抗菌、消炎、抗突变、降压、清热解毒、镇静、利尿、抗癌、防癌、抑制脂肪酶等[3-6]。随着人们生活水平的提高,添加天然抗氧化剂起到药食两用的作用越来越受到消费者的青睐。板栗花为壳斗科(Fagceae)栗属植物栗(Castanea mollissima Blμme)的雄性花序,其花粉含丰富的活性钙、磷、维生素E、雌二醇、黄酮、蛋白质等生物活性物质[7]。其中,板栗花中的黄酮物质是所有花粉中含量最高的,凝聚了天然、绿色、营养、保健等特点[8-11]。然而,在板栗的种植中,雄花序远远多于雌花序,为了保证板栗的品质,多余的雄花序将被疏掉[12],从而造成资源的浪费,同时产生大量农业废弃物。从环保和发展循环经济的观点来看,对农业和食品行业中植物废弃物的再次开发利用是目前发展的新趋势,若能对废弃的板栗雄花序进行天然抗氧化物质的开发,将在生产实践上发挥重要作用。目前植物中黄酮类物质的提取多采用醇浸提、微波、超声波和酶法等,通常提取效果的优劣以提取率的高低来评价,但是,哪种提取方法提得的总黄酮清除自由基的能力最强,哪种提取方式提得的总黄酮总还原能力最大还没有报道,本文研究了不同提取方式对板栗雄花序总黄酮清除自由基能力和总还原能力的影响,为科学高效地开发利用天然抗氧化剂使其发挥最大抗氧化效能提供参考。
1 材料与方法
1.1 材料与仪器
板栗雄花序 2011年7月采于河北怀柔,自然阴干;DPPH(1,1-dipheny-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl) 美国SIGMA公司,分析纯;硫酸亚铁 天津市福晨化学试剂厂,分析纯;磷酸氢二钠、铁氰化钾、三氯乙酸、水杨酸、氯化铁 国药集团化学试剂有限公司,分析纯;磷酸二氢钠、过氧化氢、无水乙醇 北京化工厂,分析纯。
TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;HHS电热恒温水浴锅 上海博迅实业有限公司医疗设备厂;LP-503电子天平
常熟市衡器厂;R-201真空旋转蒸发仪 配有SHB-Ⅲ循环水式多用真空泵,上海申科机械研究所;FD-1D-80冷冻干燥机 北京博医康实验仪器有限公司;PHS-3C酸度计 上海理达仪器厂。
1.2 实验方法
1.2.1 醇浸提法提取板栗雄花序中的黄酮类化合物采用乙醇热回流浸提法提取板栗雄花序中的黄酮类化合物。乙醇浓度70%,浸提温度60℃,料液比1∶30,原料粉碎度100~120目,回流提取2次,每次2h,提取液除去残渣后旋转蒸发回收溶剂。浓缩液经真空冷冻干燥得到板栗雄花序总黄酮粗提物样品,放入干燥皿中备用。
1.2.2 微波法提取板栗雄花序中的黄酮类化合物微波萃取技术提取板栗雄花序中黄酮类物质的适宜工艺条件为:乙醇浓度70%,微波功率800W,辐射时间3min,固液比1∶140,原料粉碎度100~120目,提取液除去残渣后旋转蒸发回收溶剂。浓缩液经真空冷冻干燥得到板栗雄花序总黄酮粗提物样品,放入干燥皿中备用。
1.2.3 超声波法提取板栗雄花序中的黄酮类化合物 通过单因素实验和正交实验确定了超声波提取板栗雄花序中黄酮类物质的最适条件,即乙醇浓度70%,料液比1∶30,原料粉碎度100~120目,超声温度50℃,超声波功率400W,时间30min,提取液除去残渣后旋转蒸发回收溶剂。浓缩液经真空冷冻干燥得到板栗雄花序总黄酮粗提物样品,放入干燥皿中备用。
1.2.4 酶法提取板栗雄花序中的黄酮类化合物 准确称取粉碎度为100~120目的板栗雄花序5g,加入100mL的水(按料液比1∶10),用稀盐酸调节其pH为4.5,然后加入0.05%的果胶酶和0.05%的淀粉酶,50℃酶解1h后沸水浴中灭活10min,抽滤得上清液。滤杂加入150mL 70%的乙醇,60℃、100r/min水浴1h,提取液过滤后与酶解上清液合并旋转蒸发回收溶剂,浓缩液经真空冷冻干燥得到板栗雄花序总黄酮粗提物样品,放入干燥皿中备用。
1.2.5 黄酮浓度的测定
1.2.5.1 芦丁标准溶液的配制 准确称取120℃干燥后并且恒重的芦丁标准品0.0157g,加入适量50%乙醇,稍加热溶解,冷却后用50%乙醇定容至50mL,摇匀备用,配成浓度为0.314mg/mL的芦丁标准溶液。
1.2.5.2 准曲线的绘制及黄酮浓度的测定 以不同用量芦丁标准溶液绘制标准曲线,采用Al(NO3)3络合显色法[13]测定吸光度,绘制芦丁含量—吸光度线图,得标准曲线方程:A(吸光度)=2.0419×C(芦丁含量,mg/mL)+0.0237,R2=0.9951。
精确吸取配制液0.5mL三份于3支具塞试管中,加50%乙醇补足至2.00ml,以后步骤同上。同时取0.5ml配制液,用50%乙醇补足至等体积,作为对照液,测定吸光度,根据标准曲线计算配制液中黄酮的浓度。对于浓度大的配制液先稀释再按以上步骤测定其黄酮浓度。
1.2.6 清除DPPH自由基能力的测定 在Bao等[14]所建立方法的基础上进行改良,用60%乙醇配制质量浓度为0.02、0.04、0.06、0.08、0.10、0.12、0.14mg/mL的Trobx溶液,DPPH用60%乙醇配制成2×10-4mol/L的溶液。取1mL不同浓度的样品溶液与4mL 2×10-4mol/L的DPPH溶液于具塞试管中,摇匀反应30min后,于517nm处测定吸光度值,用60%乙醇溶液作参比。取3次实验的平均值计算清除率。不同提取方式提得的板栗雄花序总黄酮以相同的浓度梯度做对DPPH自由基的清除能力。对DPPH自由基的清除率计算公式如下:
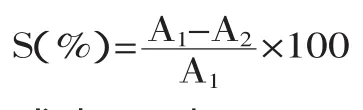
式中:A1表示4mL 2×10-4mol/L DPPH溶液加入1mL 60%乙醇溶液的吸光值;A2表示4mL 2×10-4mol/L DPPH溶液加入1mL样品溶液的吸光值。
1.2.7 清除羟自由基(·OH)能力的测定 参照Smirnoff等[15]的方法,略做修改。用60%乙醇配制质量浓度为0.2、0.4、0.6、0.8、1mg/mL的Trobx溶液,在10mL比色管中依次加入0.5mL 9mmol/L水杨酸-乙醇溶液,0.5mL 9mmol/L七水合硫酸亚铁溶液,混匀,加入不同浓度的Trobx溶液2mL,加入4mL蒸馏水,混匀,最后加入8.8mmol/L H2O20.5mL启动反应,37℃保温30min,于510nm处测定吸光值。按下面公式计算不同浓度的黄酮溶液对·OH的清除率。不同提取方式提得的板栗雄花序总黄酮以相同的浓度梯度做对·OH的清除能力。·OH的清除能力计算公式如下:
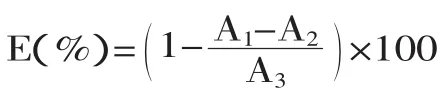
式中:A1为加入样液的吸光值;A2为蒸馏水代替H2O2的吸光值;A3为蒸馏水代替样液的吸光值。
1.2.8 总还原力的测定[16-17]用60%乙醇将不同提取方式提得的板栗雄花序总黄酮粉末均配制成质量浓度为0.05、0.10、0.15、0.20、0.25mg/mL的Trobx溶液,然后分别测定其不同提取方式提得的板栗雄花序总黄酮的还原力。取1mL不同浓度的Trobx溶液于试管中,依次加入2.5mL 0.2mmol/L磷酸缓冲液(PBS,pH6.6)和2.5mL 1%的铁氰化钾,摇匀,于50℃水浴保温20min后,快速冷却,再加入2.5mL 10%三氯乙酸溶液,以3000r/min离心10min,取上清液2.5mL,依次加入2.5mL蒸馏水,0.5mL 0.1%氯化铁溶液,充分混匀,10min后在700nm下测其吸光值,以蒸馏水代替样品作空白。
2 结果与分析
2.1 板栗雄花序总黄酮清除DPPH自由基的能力
以醇浸提法获得的板栗雄花序总黄酮作标准曲线,见图1。在一定浓度范围内,随着板栗雄花序总黄酮试样浓度的增大,对DPPH自由基的清除能力增大,并且浓度和清除率有很好的量效关系。半数抑制浓度IC50为0.068mg/mL,由此可见,板栗雄花序总黄酮对DPPH自由基的清除能力很强,是一种很好的天然自由基清除剂。
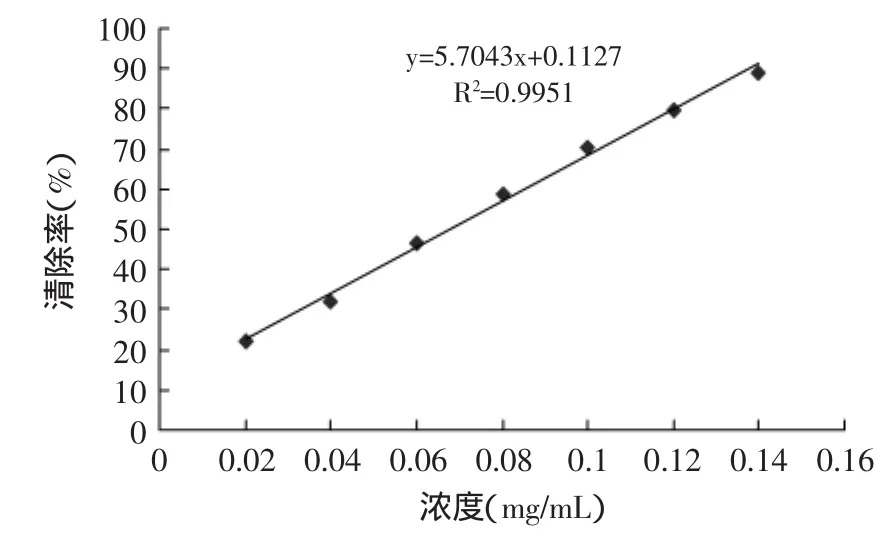
图1 板栗雄花序总黄酮清除DPPH自由基的能力Fig.1 Total flavonoids of the male chestnut flowers’sscavenging ability to DPPH free radical
2.2 提取方式对清除DPPH自由基能力的影响
图2显示,各种提取方式提得的板栗雄花序总黄酮对DPPH自由基的清除能力都较强,在一定浓度范围内,各提取方式提得的总黄酮均随其浓度的增大,对DPPH自由基的清除能力增大。方差分析显著水平达0.0704,在0.05的显著水平下,各提取方式提得的总黄酮清除DPPH自由基的能力差异不显著。其中醇浸提法提得的总黄酮清除DPPH自由基的能力最大,微波和超声波提得的总黄酮清除DPPH自由基的能力基本一样,且比醇浸提法提得的总黄酮清除DPPH自由基的能力略低,而酶法提取提得的总黄酮清除DPPH自由基的能力最低,而且提取条件要求较高。因此,综合考虑提取黄酮的操作时间、溶剂消耗、提取效果等因素,在条件允许的情况下,应选择微波提取法,因为微波提取操作时间短、溶剂消耗量少、提取率高、污染小,而且与其他提取方法相比,其提得的总黄酮清除DPPH自由基的能力也很强。
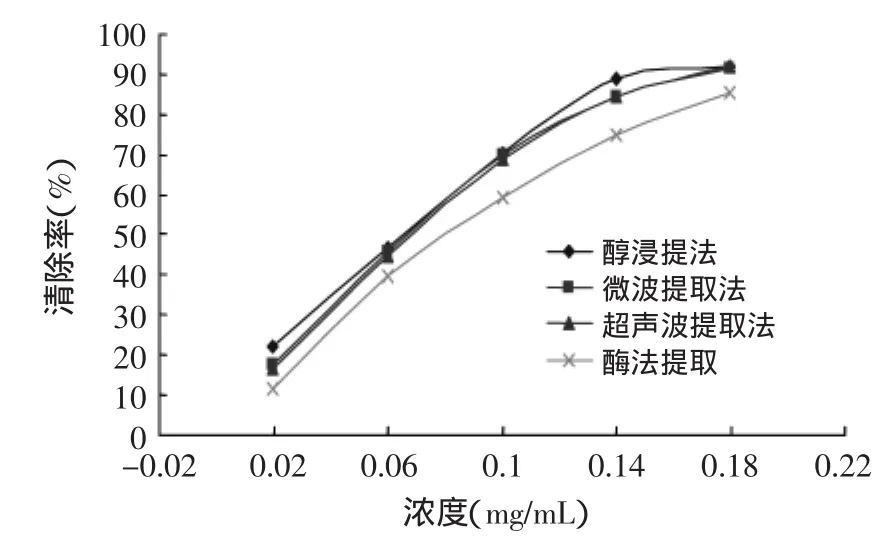
图2 提取方式对清除DPPH自由基能力的影响Fig.2 Effect of extraction method to scavenging DPPH free radical
2.3 板栗雄花序总黄酮清除·OH的能力
以醇浸提法获得的板栗雄花序总黄酮做标曲,图3显示,在一定浓度范围内,随着试样浓度的增大,其对·OH的清除能力增大,并且浓度和清除率有很好的量效关系。半数抑制浓度IC50为0.492mg/mL,由此可见,板栗雄花序总黄酮对·OH的清除能力很强,是一种高效的天然自由基清除剂,可以添加到食品、药品或保健品等中,帮助人类预防某些慢性病。
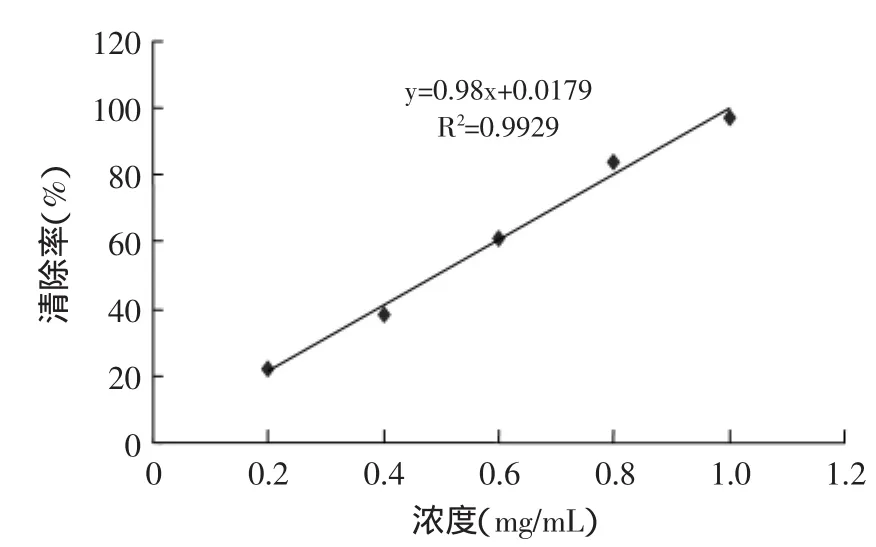
图3 板栗雄花序总黄酮清除羟自由基(·OH)的能力Fig.3 Total flavonoids of the male chestnut flowers’s scavenging ability to Hydroxyl free radical
2.4 提取方式对清除羟自由基(·OH)能力的影响
图4显示,在一定浓度范围内,各提取方式提得的板栗雄花序总黄酮随其浓度的增大,对·OH的清除力增大。方差分析显著水平达0.0287,在0.05的显著水平下,各提取方式提得的板栗雄花序总黄酮清除·OH能力差异显著。醇浸提法提得的总黄酮对·OH的清除能力最大,微波提取法提得的总黄酮对·OH的清除力略有降低,超声波提取法提得的总黄酮对·OH的清除力明显降低,而酶法提取提得的总黄酮对·OH的清除力最低。因此,板栗雄花序总黄酮作为天然·OH清除剂使用时,如果为了使其发挥最大·OH清除力,应选择醇浸提法;如果考虑经济效益和环境效益,应选择微波提取法,微波提取法与其他方法相比,既节省资源又环保,而且其提取物清除·OH的能力比醇浸提法略微降低一些,其清除·OH的能力也较强。

图4 提取方式对清除羟自由基(·OH)能力的影响Fig.4 Effect of extraction method to scavenging Hydroxyl free radical
2.5 板栗雄花序总黄酮的总还原力
以醇浸提法获得的板栗雄花序总黄酮做标曲,图5显示,在一定浓度范围内,随着试样浓度的增大,其吸光值增大,浓度和吸光值具有很好的量效关系。与空白相比,当试样的浓度为0.25mg/mL时,吸光值达到0.7,由此可见,板栗雄花序总黄酮具有很强的还原性,即具有很强的抗氧化性,是一种高效的天然抗氧化剂,值得深入研究及开发利用。
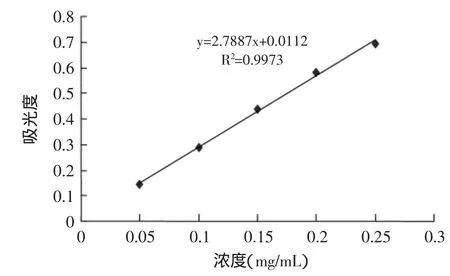
图5 板栗雄花序总黄酮的总还原力Fig.5 Total flavonoids of the male chestnut flowers’s total reduction capacity
2.6 提取方式对板栗雄花序总黄酮总还原力的影响
图6显示,在一定的浓度范围内,随各提取方式提得的总黄酮浓度的增大,其吸光值均增大,且都有很好的量效关系。方差分析显著水平达0.3162,在0.05的显著水平下,各提取方式提得的板栗雄花序总黄酮的还原力差异显著。各提取方式提得的总黄酮还原力的大小顺序为:微波提取法>醇浸提法>超声波提取法>酶提取法。因此板栗雄花序总黄酮作为抗氧化剂开发利用时,应选择微波提取法,因为微波提取法提得的板栗雄花序总黄酮具有最大抗氧化效能,而且与其他方法比较,微波提取法具有许多优点,顺应当前国家经济社会的发展趋势。
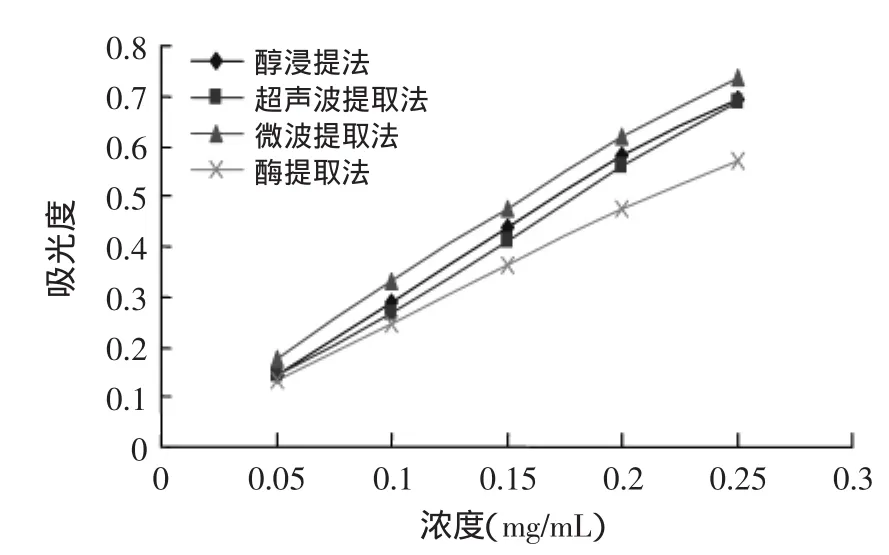
图6 提取方式对板栗雄花序总黄酮总还原力的影响Fig.6 Effect of extraction method to total flavonoids of the male chestnut flowers's total reduction capacity
3 结论
3.1 不同提取方式提得的板栗雄花序总黄酮清除DPPH自由基能力差异较小,而清除·OH能力和总还原力差异显著。
3.2 提取方式对板栗雄花序总黄酮清除自由基的能力和总还原力的影响不一致,不同提取方式提得的板栗雄花序总黄酮清除自由基的能力大小依次为:醇浸提法>微波法>超声波法>酶法;总还原力的大小顺序为:微波提取法>醇浸提法>超声波提取法>酶提取法,因此,不同提取方式提得的黄酮类化合物的提取率及黄酮种类都不同。
3.3 提取天然黄酮类化合物时,应综合考虑提取时间、能源消耗,环境污染,提取物效能的发挥等因素,之后选择最佳的提取方式。如果要使提得的天然黄酮类化合物发挥最大抗氧化效能,应针对不同的抗氧化使用范畴选择不同的提取方式。
[1]赵保路.氧自由基和天然抗氧化剂[M].第一版.北京:科学出版社,1999:7-14.
[2]ZHANG Yanjun,SEERAM N P,LEE R,et al.Isolation and identification of strawberry phenolics with antioxidant and human cancer cell antiproliferative properties[J].Journal of Agricultural and Food Chemistry,2008,56(3):670-675.
[3]毛雪石.黄酮类化合物的抗肿瘤活性[J].国外医学药学分册,1995,22(2):92-95.
[4]裴凌鹏,伯棣,金宗濂,等.黄酮类化合物的生理活性及其制备技术研究进展[J].食品科学,2004,25(2):203-207.
[5]魏朝良,于德红,安利佳.黄酮类化合物及清除自由基机制的探讨[J].中成药,2005,27(2):239-241.
[6]刘海莹.中草药中黄酮的生物活性和细菌耐药性的研究[D].曲阜:曲阜师范大学,2008.
[7]王嗣,杜成林,唐文照,等.板栗花的化学成分研究(I)[J].中草药,2004,35(10):1103-1104.
[8]俞秀玲.花粉的活性成分[J].食品工业科技,2007,28(4):236-238.
[9]吴雪辉,江南,梁颖诗,等.微波提取板栗花中黄酮类物质的工艺研究[J].食品工业科技,2006,27(8):106-109.
[10]曹炜,赵长琦,尉亚辉.油菜花粉黄酮对氧自由基致鼠红细胞膜损伤的保护作用[J].食品科学,2002,23(9):115-118.
[11]Campos M G.Age-Induced Diminution of Free Radical Scavenging Capacity in Bee Pollens and the Contribution of Constituent Flavonoids[J].Agricultural and Food Chemistry,2003,51:742-745.
[12]王家玉.板栗增雌花减雄花的技术措施[J].林业科技开发,1995(1):48-49.
[13]万茵,谢明勇,梁丽军,等.车前子总黄酮的提取工艺优化及体外抗氧化作用研究[J].食品科学,2006,27(12):373-376.
[14]Bao J S,Ca i Y Z,Sun M,et al.Anthocyanins,flavonols,and free radical scavenging activity of Chinese bayberry extracts and their color properties and stability[J].Agricultural and Food Chemistry,2005,53:2327-2332.
[15]Smirnoff N,Cumbes QJ.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28:1057-1060.
[16]林烽.橄榄叶总黄酮代谢和提取工艺优化及其抗氧化作用[D].福州:福建农林大学,2008.
[17]王晶,任发政.桑树皮黄酮的超声波提取及体外抗氧化作用研究[J].食品科学,2008,29(4):206-209.
——植物学教材质疑(六)

