食物链长度远因与近因研究进展综述
王玉玉,徐 军,雷光春,*
(1.北京林业大学,自然保护区学院,北京 10083;2.中国科学院水生生物研究所, 东湖湖泊生态系统试验站, 淡水生态与生物技术国家重点实验室, 武汉 430072)
食物链长度远因与近因研究进展综述
王玉玉1,徐 军2,雷光春1,*
(1.北京林业大学,自然保护区学院,北京 10083;2.中国科学院水生生物研究所, 东湖湖泊生态系统试验站, 淡水生态与生物技术国家重点实验室, 武汉 430072)
食物链长度是生态系统的基本属性,其变化决定着群落结构和生态系统功能。稳定同位素分析技术的进步推进了生态系统中食物链长度决定因子相关研究的开展。尽管近期的研究证明了食物链长度与资源可利用性、生态系统大小、干扰等远因之间的关系,但是对于食物网内部结构变化这一近因对食物链长度的影响作用关注较少。综述了边界明确和开放类型淡水生态系统中食物链长度的相关研究进展;探讨了远因和近因机制在决定食物链长度中的作用;给出了判断不同层次和尺度上决定食物链长度机制的概念框架;为今后更好的开展不同生态系统间食物链长度的比较研究提出了建议。
食物链长度;资源可利用性;生态系统大小;干扰;食物网结构;远因和近因机制
食物网中从基础资源到顶级捕食者之间的营养级数量就是食物链长度[1- 2]。食物网研究中常用顶级捕食者的营养级位置来表示食物链长度[2- 3]。食物链长度是生态系统的基本属性,在决定生态系统功能中发挥着重要作用[4- 9]。一方面因为它是复杂食物网关系中可以描述的特征,反映了食物网的垂直结构[10- 13];另一方面它通过改变营养关系的组织结构来影响种群结构、生物多样性和生态系统稳定性[5, 14- 15],进而改变养分循环、初级生产力等生态系统功能[8, 16- 17],决定顶级捕食者体内污染物的生物累积[18- 19]。食物链长度及其动态是生态学许多重要理论的基础,包括食物金字塔[20],绿色世界[7],营养级联[21- 22]。
测度食物链长度的方法主要有3种[1, 23]:(1)链接度食物链长度,测度食物网基底可利用资源与顶级消费者间平均链接点数量[23- 24];(2)功能食物链长度,测度顶级捕食者影响低营养级的路径与强度[23, 25];(3)能量食物链长度,采用稳定同位素分析技术追踪顶级捕食者同化的通过所有路径传递的能量或物质流[23, 26]。碳、氮稳定同位素分析技术已成为食物链长度研究的关键技术[1, 3, 27]。消费者体内的碳稳定同位素的含量(δ13C)通常与其食物来源相近,仅有lt;1‰的富集,可以反映其同化的来自湖泊沿岸带与敞水带[28- 30],河流浅滩与深潭中[31]的物质。与碳稳定同位素不同,氮稳定同位素含量(δ15N)在生物体内随着营养级的增加而逐渐增高,营养级间富集值平均为(3.4±1)‰,反映了消费者在食物网中的营养级位置[29, 32]。食物链长度就是所研究群落中的顶级捕食者集合中营养级位置最高的物种营养级位置[3, 27]。过去在进行跨系统和地点的稳定同位素比较分析时,不同研究地点食物网基础资源的氮稳定同位素含量由于氮源和生物地球化学循环过程的不同而存在巨大差异,结果难以对比[32]。随着选择初级消费者作为食物网稳定同位素“基准”的较准方法出现,多个生态系统间食物链长度的比较变得可行[26, 29, 32, 33]。使用碳、氮稳定同位素分析技术可以快速获得生物营养级位置和食物链长度的信息,这种研究能力的增强重新燃起了科研人员对生态系统中决定食物链长度的因子研究的兴趣[3, 23, 26]。
对全球219个水域生态系统食物链长度的文献分析发现,河流生态系统食物链长度平均为3.5,而海洋和湖泊生态系统食物链长度平均为4[3]。不同生态系统间和相同生态系统内食物链长度变化的原因一直是生态学研究的重要内容[1, 3]。资源可利用性假说、干扰假说和生态系统大小假说[1, 23, 34]是关于影响食物链长度远因作用的传统假说。资源可利用性假说(也称为能量限制假说)是基于热力学第二定律提出的[35],该假说认为食物链长度由可供给高营养级生物的基础资源和能量利用效率所决定,由于能量在连续的营养级传递过程中不断减少,能量传递效率决定了食物链长度[11, 13]。使用“资源可利用性”而不采用“初级生产力”来衡量可利用的能量是因为这一概念应用范围更广泛,可以描述从净自养(P∶Bgt;1)到净异养(P∶Blt;1)系统间为食物网提供支持的能量或资源可利用性[23]。干扰假说(也称动态稳定假说)是基于Lotka-Volterra 方程推导出的,认为频繁或强烈的扰动会缩短食物链长度,较长的食物链由于缺少弹性而不可能存在于常受扰动的栖息地[36]。生态系统大小假说出现最晚,认为大的生态系统空间可直接增加总的资源可获得性,通过物种多样性、栖息地可利用性与异质性、捕食者-被捕食者相互作用稳定性来影响捕食者-猎物个体大小比例、消费者杂食性、物种定居与消失的可能性等依赖资源可获得性的种群特征进而决定食物链长度[1, 23, 27]。尽管这些假说是对所有生态系统提出的,但是关于这些假说较好的测试与验证均是在水域生态系统中进行的[3, 23]。
虽然近期的研究明确了食物链长度变化与生态系统发育过程中外部的环境变量如资源可利用性、生态系统大小之间的联系[13, 37- 38],但是由于通常食物链长度自然变化对环境变量的响应包含了食物网结构变化这一近因的作用,目前的研究还未从机理上将食物链长度变化与这些潜在因素联系起来。在近因方面,决定食物链长度的核心就是食物网结构和功能的改变,其中影响食物链长度的直接因素就是顶级捕食者的添加、移除,及其营养级位置的改变[14, 39- 40]。添加或移除直接改变了顶级捕食者这种影响被称为增补机制[14]。而营养级改变则是指同一顶级捕食者在食物网中功能的改变,引发顶级捕食者营养级位置的变化机制主要有3种:(1)添加或移除中间营养级物种(或者基础资源),被称为嵌入机制;(2)改变食物来源丰富度,从而改变顶级捕食者杂食性,杂食机制;(3)中间营养级物种营养级位置变化,中间营养级物种的营养级位置变化同样也是由于嵌入和杂食机制作用在更低营养位置物种上引起的[27]。嵌入机制和杂食机制存在一定的内部联系,例如新嵌入的中间营养级物种会改变食物网原有的结构与能量传递路径,从而为杂食性提供了新的渠道[14]。嵌入机制和杂食机制的差异在于嵌入机制改变了物种丰度和食物网拓扑结构,而杂食机制是在不改变物种丰度和食物网拓扑结构的条件下改变食物网能量流动特征[14]。已有研究多关注食物网顶级捕食者的增补机制引起的食物链长度的变化,然而嵌入机制和杂食机制具有多重营养级和多重路径的复合作用,且杂食性在自然界广泛存在,因此这两种机制在近期愈来愈受到关注[5, 37]。
本文通过综述边界明确和开放类型淡水生态系统能量食物链长度研究进展,总结了远因(资源可获得性、干扰、生态系统大小)和近因(食物网结构内部,包括物种多样性、捕食-猎物个体大小比例、消费者杂食性)在决定食物链长度中的作用,探讨远因和近因对处于不同发展阶段的生态系统食物链长度的作用效果,展望今后淡水生态系统食物链长度研究的发展方向。
1 淡水生态系统食物链长度限制因子研究进展
1.1 边界明确的生态系统:湖泊、池塘
由于湖泊和池塘生态系统具有边界清晰,对系统干扰响应较快的特点[41],非常适合开展试验生态学、比较生态学以及生态假说的验证研究[23, 37- 38, 42- 43]。由于湖泊、池塘环境变化小,很少受到与河流、湿地等开放生态系统相同程度的干扰,因而对于湖泊等边界明确淡水生态系统的食物链长度研究目前主要聚焦在生态系统大小和资源可获得性2种假说上。
最近2组对北美地区不同大小湖泊食物链长度研究中均发现湖泊食物链长度与生态系统大小正相关[37- 38]。而对全球湖泊食物链长度研究发现生态系统大小并不是决定淡水湖泊食物链长度的决定因素[3],但是这一综合研究中并未详细评估其他控制因素(如资源可利用性)的作用。Doi等人使用稳定同位素分析技术对日本15个池塘顶级捕食者大口黑鲈营养级位置的研究结果对静水生态系统食物链长度研究提供了新的思路[44]。与其他研究中使用标准的湖沼指数(如,TP总磷浓度,叶绿素a浓度)来推断生产力的方法不同,Doi等人创新性的将藻类分成可食用和非可食,从而获得了良好的分析效果。该研究发现池塘中大口黑鲈营养级位置变化范围为3.4—5.0;食物链长度与生态系统大小正相关;与用藻类总生物量(叶绿素a浓度)表征的资源可利用性无关;而当用可食性藻类替代总藻类时,资源就成为决定食物链长度的重要决定因素[44]。
而对单个湖泊和成因非常类似的湖泊群,生态系统大小之外的因子就成为了重要的决定因素[23, 27]。在加拿大阿尔伯塔高山湖泊Moab湖开展的长期观测为资源可利用性对湖泊食物链长度的影响提供了证据[45]。由于森林火灾Moab湖流域内72%的森林被烧毁,水体中溶解营养盐浓度随即大幅上升,随着养分增多初级生产力增长了1.5倍,消费者丰度随之增加。致使火灾后湖红点鲑转而大量取食幼鱼和浮游动物糠虾(MysisRelicta)与火灾前主要取食底栖无脊椎动物等初级消费者不同,食谱的变化使得湖红点鲑和其他顶级捕食者的营养级位置升高。受资源可利用变化驱动的捕食者食性变化最终使得Moab湖食物链在火灾后增长了约1个营养层次[45]。近期开展实验研究中还发现消费者物种组成变化也是湖泊食物链长度的重要控制因子。对北美地区湖泊研究发现当温带地区的顶级捕食者小口黑鲈(Micropterusdolomieu)入侵北温带和寒带湖泊后,本地顶级捕食者湖红点鲑(Salvelinusnamaycush)的营养级位置下降了0.6[26, 46]。因为外来顶级捕食者的存在使得沿岸带鱼类数量和多样性下降,水生食物网结构发生变化,入侵湖泊中湖红点鲑的食谱与未入侵湖泊相比更多的依赖浮游动物而不是原先的沿岸带鱼类[26]。另一个类似的案例是亚洲胡瓜鱼(Osmerusmordax)在加拿大中东部和美国北部的扩散,这种鱼是生活在湖泊浮游层中的中间消费者,他们的营养级位置比原先湖红点鲑的猎物鱼高,湖红点鲑对亚洲胡瓜鱼的取食增长了被入侵湖泊食物链长度[47- 48]。由于物种组成变化导致的消费者取食行为的差异可能是所观测到的单个湖泊食物链长度发生变化的根本原因。
1.2 开放的生态系统:河流、湿地
对于开放的河流、湿地等淡水生态系统,生态系统大小、资源可利用性和干扰都可能对食物链的长度产生影响[23]。Williams和Trexler对美国南佛罗里达Everglades湿地20个生产力(直接测定)和水文干扰(干旱频度)不同的湿地决定食物链长度的因子展开研究发现2个中间消费者的营养级位置与干旱频度强烈相关,说明干扰对食物链长度产生了影响[49]。水域顶级捕食者长吻雀鳝的营养级位置与挺水植物茎杆密度正相关,虽然不是直接证据但是这一关系表明资源可利用性对湿地食物链长度有影响[49]。
在探讨生产力和干扰对巴西Upper Paran′a河食物链长度的影响研究时,发现在高比降河流中食物链长度最短,水库中食物链长度最长,变幅在4.0—4.35之间[50]。作者认为是顶级捕食者与猎物鱼类之间个体大小比例的差异决定了营养物质传输路径,最终决定了食物链长度,资源可利用性并不是Upper Paran′a河流食物链长度的决定因素[50]。这一研究与其他有强烈水文干扰的河流生态系统中得出的水库相对于高比降河流水文变异小,食物链长度短的结果相反[42,51]。但值得注意的是在对Upper Paran′a河的研究中并没直接测定来自于初级生产者或者碎屑的能量来源。洪水和干旱是河流生态系统中常见的干扰事件,相对于洪水对河流生态系统的影响,人们对干旱对河流生态系统的影响研究较少[23]。Walters和Post 2008年开展河流流量减少的控制实验中发现低流量的干扰并没有使食物链长度缩短(减少流量的控制河流下游食物链长度为3.0—3.6,而未控制的河流上游的食物链长度为3.0—3.8),同时鱼类个体大小结构却发生了改变[52]。在受控制河段虽然大型鱼类消失了,小型鱼类仍然存在并占据了与原先大型鱼类相同的营养级位置。因此尽管低流量实验改变了鱼类个体大小结构,但是不同大小鱼类在食物网结构中的互补作用缓冲了干旱对食物链长度的影响[52]。在以上研究中均没有检验2个以上因素对食物链长度的控制情况,且大多数研究均采用了完全不同的方法来量化独立变量(特别是干扰和资源可利用性),因此这些研究中得出的结果有所不同并不奇怪。
实际上资源可利用性、生态系统大小和干扰三者之间是紧密关联的,随着流量增大,河道形态、水生(藻类)、陆生(沿岸带凋落物)能量来源的相对贡献比例也会随着流域面积发生变化[41]。Sabo 等人在北美地区36个流域测试了生态系统大小、干扰和资源可利用性对食物链长度的影响发现,食物链长度随着流域面积增大而增长,随着水文节律变异和间歇率增大而减少[53]。水文情势的突然变化会破坏栖息地的质量,从而对生物产生毁灭性的影响[54]。该研究发现在常年有水的河流中顶级捕食者多为肉食性鱼类,而即使在最大的间歇性河流中顶级捕食者也仅是无脊椎动物或者个体很小的鱼类[53]。随着生态系统规模(流域面积)的增加,可以整合并减弱河网中流量差异的影响,增加河流生态系统中的环境稳定性,增长食物链长度[51]。
2 决定食物链长度机理研究进展
在自然生态系统中,食物链长度受众多因素和过程共同决定,这些因素和过程的作用使得食物链长度在时空尺度上呈现出明显的格局多样性,因此不同时空范围内决定食物链长度的主导因子也不同(图1)[3, 4, 23, 37, 53, 55- 56]。从生态系统进化的角度讲,形成初期或是处于隔离状态的生态系统,其食物链长度主要受群落结构的自组织特征限制[7, 57- 59]。在非生态隔离或进化后期的生态系统中,食物链长度的主要决定因子为资源可利用性,即资源不足则食物链长度受到限制,若资源充足此时捕食者与被捕食者之间的相互作用成为食物链长度的主要决定因子[25, 60- 63]。处于进化稳定期的生态系统,如果捕食者与被捕食者之间的相互作用不受个体大小限制的时候,食物链长度通常为3,反之决定食物链长度的主要因子就是干扰[42, 52, 64- 66]。如果生态系统处于低水平干扰,那么食物链长度在一定程度上是决定于生态系统大小;而在高频干扰下的生态系统,其食物链长度则主要受系统的稳定性或恢复力的限制[38, 61, 64- 65]。
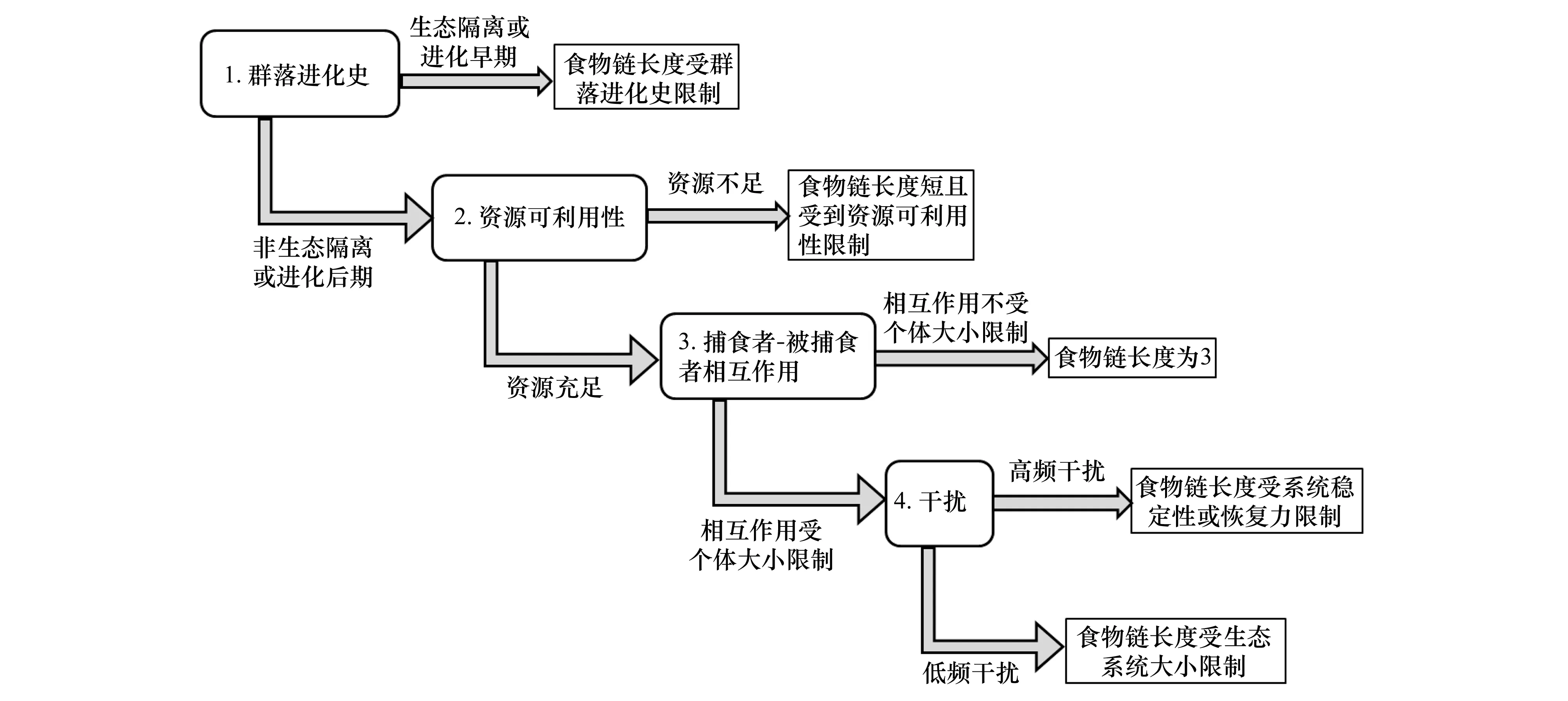
图1 判断潜在决定食物链长度因素流程图Fig.1 Flow chart outlining the potential constraints on food-chain length
识别食物网结构变化的近因机理为解释食物链长度自然变化与大尺度上远因的如资源可利用性、生态系统大小、干扰之间关系提供了路径。Takimoto和Post对已有的研究案例开展meta分析发现资源可利用和生态系统大小对淡水食物链长度有显著正效应,而干扰对食物链长度的效应并不明显[67]。Post和Takimoto通过模型分析发现当资源可利用性低时,增补机制是解释食物链长度变化的唯一机制[27]。而随着资源可利用增加,捕食者及中间营养级物种进入并共存,捕食者生物量增加会大量取食导致部分中间营养级物种消失,此时杂食机制成为决定食物链长度的主要机制(图2)。由于杂食性的存在,杂食和嵌入机制发生互作可能会将能量限制的作用效果覆盖,这一机制有助于解释之前关于发现的北美顶级捕食鱼类相同的湖泊食物链长度研究与资源可利用性无关的结果[38]。
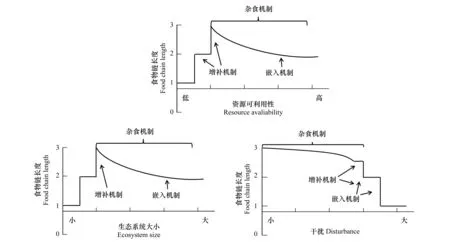
图2 远因和近因机制对食物链长度影响模式图Fig.2 Mode figure of how ultimate and proximate mechanisms impact on the food chain length
生态系统大小可以通过3种近因机制对食物链长度产生2种效应:(1)随着生态系统的增大,物种数量增加会通过增补和嵌入机制增长食物链长度,但是随着物种数量增多食物网的杂食性增加从而缩短食物链长度[27],(2)大的生态系统往往具有更大的生境异质性可以为猎物提供更多的避难所,减少捕食者的觅食效率,降低物种间的交互作用,削弱杂食性机制的作用,从而增长食物链的长度[38, 52- 53](图2)。因此在食物链长度相关研究中应采集中间营养级消费者(包括记数和组织采样),而不仅限于采集顶级捕食者和通常的基准生物,细致的采样有助于从机理上解释观察到的食物链长度与关键独立变量之间的关系。
人们普遍认为干扰是通过增补和嵌入机制来移除物种,改变物种的组合从而影响食物链长度,增补和嵌入机制在干扰中的效果还取决于食物网成员的定殖能力[51]。而对河流生态系统的研究发现杂食机制也会起到作用[50- 52](图2)。而目前对河流的研究中发现,洪水的发生有利于易被捕食却扰动抗性强物种的生存,从而增加食物网中能量传输路径,进而增长了食物链长度[51, 68]。说明在溪流中杂食机制可以在不改变物种组成的同时快速影响食物链长度。
目前对决定食物链长度的因子的研究已经从试图搜寻单一因素来解释,转向探讨一系列限制因子相互作用在何时何地决定食物链长度变化。综上,想要判定所观察到的食物链长度变异的根本机理需要以下2个步骤:(1)测度环境变量(如资源可利用性、干扰频度等远因)对食物网结构的影响;(2)测度食物网结构变化等近因对食物链长度的影响。
3 展望
随着稳定同位素分析技术在能量食物网研究中被广泛应用,近期的研究成果大大推进了人们对影响食物链长度的远因、近因及其作用机理的理解。为了今后能够解释不同层次,不同时空尺度上影响食物链长度机理,在研究远因作用时还需要注意以下方面:
(1) 资源可利用性 测度净初级生产力对于净自养和外源物质输入少的系统比较适合,而对于其他外源输入超过净异养的开放系统仅用传统方法测度初级生产力会大大低估食物网中的可利用资源及其对食物链长度的影响。对于内源和外源能量同样重要的系统,以及多系统中净异养和净自养系统之间如何比较仍是难题。而测定生态系统的代谢(即总初级生产力和生态系统呼吸)则集成了小尺度的空间异质性、反映了食物网基层小型周转率快生物的作用,从而可提供全面的资源可利用性的测度[23, 53]。仅测度生物存现量则可能误导对能量可利用性的评估,因为许多潜在资源会由于较低的营养质量或者防御性而不可食用[34,44]。 同时还需注意选择与顶级消费者生长季节时间相匹配的时间尺度和周期来测定资源可利用性[23]。
(2)生态系统大小 对于湖泊生态系统测度面积或体积都较为合适,一方面反映了栖息地的垂直结构,另一方面群落成员组成和生态系统过程通常受到湖泊的物理边界的限制(需要注意的要将外源输入极为重要的小湖泊和支持海洋洄游鱼类湖泊除外)[41]。
对于开放的生态系统有较高的周长面积比,可利用的资源通常是来自外源输入,如果仅以宽度、深度等物理边界来划分将会割裂生态过程(种群组成、能量流动路径、扩散)之间的联系。因此对于开放生态系统大小在研究中常用流域面积或者基流时河流的截面积来估算[23, 61]。由于许多关键的资源如初级生产力、外源输入的碎屑量会随着流域面积增大而增加。与流域面积不同,截面积(断面深度和宽度)与资源可用性不相关,且是栖息地总体积很好的度量,对于识别食物网结构如与个体大小相关的捕食率、顶级捕食栖息地可用性和适用性、杂食程度等对食物链长度的作用均有作用[53]。如果资源可利用性决定了食物链长度,那么流域面积就是合适的测度方法。如果是种群组织过程或物种相互关系决定了食物链长度那么截面积就是最适合的生态系统大小测度方法。确定最合适的生态系统大小的唯一方法就是在研究食物链长度时同时测度流域面积和截面积然后让数据来决定哪种度量方法最合适以及哪种机制决定了食物链的长度[23]。
(3)干扰 食物网动态稳定理论是基于Lotka-Volterra方程的概念模型推导出的,即顶级捕食者需要更长的时间才能返回被干扰的系统[4, 69]。Lotka-Volterra方程是对长期种群动态的一个简单描述,因此动态稳定理论解决的是长期干扰如何影响顶级捕食者对扰动的抵抗能力。而实际上很多关于干扰的研究是短期的(1年或几年),测度的是离散的突发灾难性事件对顶级捕食者的影响,并没考虑在更长时间尺度上顶级捕食者的复原能力[23]。因而在今后更大范围关于动态稳定性假说的比较研究中需要更仔细地界定环境因子的变化,区分短期和长期的环境因子变化与食物链长度之间的关系。
增补、嵌入、杂食这3种影响食物链长度近因机制的提出将食物网结构的复杂关系简化至易于掌控的水平。由于远因与近因之间和各自内部都可能发生复杂的相互作用,Post和 Takimoto提出的考虑3种近因作用机制群落尺度IGP(Intraguild predation)模型[27], 提供了将食物链长度自然变化与远因机制连接起来的框架,可以探讨资源可利用性,生态系统大小和干扰的变异对食物链长度的作用效应,在今后的研究可以采用。
综上,食物链长度的相关研究中应尽可能多的使用统一的方法测度资源可利用性,生态系统大小,环境变化等决定食物链长度的潜在因子,并注意采集分析食物网结构的相关数据,从而全面解释引起食物链长度变化的机理。
[1] Post D M. The long and short of food-chain length. Trends in Ecology and Evolution, 2002, 17(6): 269- 277.
[2] Post D M. Testing the productive-space hypothesis: rational and power. Oecologia, 2007, 153(4): 973- 984.
[3] Vander Zanden M J, Fetzer W W. Global patterns of aquatic food chain length. Oikos, 2007, 116(8): 1378- 1388.
[4] Pimm S L, Kitching R L. The determinants of food chain lengths. Oikos, 1987, 50(3): 302- 307.
[5] Carpenter S R, Kitchell J F, Hodgson J R, Cochran P A, Elser J J, Elser M M, Lodge D M, Kretchmer D, He X, von Ende C N. Regulation of lake primary productivity by food web structure. Ecology, 1987, 68(6): 1863- 1876.
[6] Deangelis D L, Barterll S M, Benkert A L. Effects of nutrient recycling and food-chain length on resilience. The American Naturalist, 1989, 134(5): 778- 805.
[7] Hairston N G, Smith F E, Slobodkin L B. Community structure, population control, and competition. The American Naturalist, 1960, 94(879): 421- 425.
[8] Cole J J, Pace M L, Carpenter S R, Kitchell J F. Persistence of net heterotrophy in lakes during nutrient addition and food web manipulations. Limnology and Oceanography, 2000, 45(8): 1718- 1730.
[9] Schmitz O J, Hambäck P A, Beckerman A P. Trophic cascades in terrestrial systems: a review of the effects of carnivore removals on plants. The American Naturalist, 2000, 155(2): 141- 153.
[10] Lindeman R L. The trophic-dynamic aspect of ecology. Ecology, 1942, 23(4): 399- 417.
[11] Pimm S L. Food Webs. London: Chapman and Hall, 1982.
[12] Martinez N D, Lawton J H. Scale and food-web structure: from local to global. Oikos, 1995, 73(2): 148- 154.
[13] Schoener T W. Food webs from the small to the large: the Robert H. MacArthur award lecture. Ecology, 1989, 70(6): 1559- 1589.
[14] Pace M L, Cole J J, Carpenter S R, Kitchell J F. Trophic cascades revealed in diverse ecosystems. Trends in Ecology and Evolution, 1999, 14(12): 483- 488.
[15] Duffy J E, RIchardson J P, France K E. Ecosystem consequences of diversity depend on food chain length in estuarine vegetation. Ecology Letters, 2005, 8(3): 301- 309.
[16] Worm B, Lotze H K, Hillebrand H, Sommer U. Consumer versus resource control of species diversity and ecosystem functioning. Nature, 2002, 417(6891): 848- 581.
[17] Schmitz O J. Top predator control of plant biodiversity and productivity in an old-field ecosystem. Ecology Letters, 2003, 6(2): 156- 163.
[18] Cabana G, Rasmussen J B. Modelling food chain structure and contaminant bioaccumulation using stable nitrogen isotopes. Nature, 1994, 372(6503): 255- 257.
[19] Kidd K A, Schindler D W, Hesslein R H, Muir D C G. Effects of trophic position and lipid on organochlorine concentrations in fishes from subarctic lakes in Yukon Territory. Canadian Journal of Fisheries and Aquatic Sciences, 1998, 55(4): 869- 881.
[20] Elton C S. Animal Ecology. London: Sidgwick and Jackson, Ltd, 1927.
[21] Carpenter S R, Kitchell J F, Hodgson J R. Cascading trophic interactions and lake productivity. BioScience, 1985, 35(10): 634- 639.
[22] Carpenter S R, Kitchell J F. The Trophic Cascade in Lakes. Cambridge: Cambridge University Press, 1993.
[23] Sabo J L, Finlay J C, Post D M. Food chains in freshwaters. Annals of the New York Academy of Sciences, 2009, 1162(1): 187- 220.
[24] Dunne J A, Williams R J, Martinez N D. Food-web structure and network theory: The role of connectance and size. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(20): 12917- 12922.
[25] Power M E, Marks J C, Parker M S. Variation in the vulnerability of prey to different predators: community-level consequences. Ecology, 1992, 73(6): 2218- 22123.
[26] Vander Zanden M J, Casselman J M, Rasmussen J B. Stable isotope evidence for the food web consequences of species invasions in lakes. Nature, 1999, 401(6752): 464- 467.
[27] Post D M, Takimoto G. Proximate structural mechanisms for variation in food-chain length. Oikos, 2007, 116(5): 775- 782.
[28] France R L. Differentiation between littoral and pelagic food webs in lakes using stable carbon isotopes. Limnology and Oceanography, 1995, 40(7): 1310- 1313.
[29] Post D M. Using stable isotopes to estimate trophic position: models, methods, and assumptions. Ecology, 2002, 83(3): 703- 718.
[30] Finlay J C. Stable-carbon-isotope ratios of river biota: implications for energy flow in lotic food webs. Ecology, 2001, 82(4): 1052- 1064.
[31] Finlay J C, Khandwala S, Power M E. Spatial scales of carbon flow in a river food web. Ecology, 2002, 83(7): 1845- 1859.
[32] Cabana G, Rasmussen J B. Comparison of aquatic food chains using nitrogen isotopes. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(20): 10844- 10847.
[33] Xu J, Zhang M, Xie P. Variability of stable nitrogen isotopic baselines and its consequence for trophic modeling. Journal of Lake Sciences, 2010, 22(1): 8- 20.
[34] Doi H. Resource productivity and availability impacts for food-chain length. Ecological Research, 2012, 27(3): 521- 527.
[35] Hutchinson G E. Homage to Santa Rosalia or why are there so many kinds of animals? The American Naturalist, 1959, 93(870): 145- 159.
[36] Pimm S L, Lawton J H. Number of trophic levels in ecological communities. Nature, 1977, 275(5618): 542- 544.
[37] Vander Zanden M J, Shuter B J, Lester N, Rasmussen, J B. Patterns of food chain length in lakes: a stable isotope study. The American Naturalist, 1999, 154(4): 406- 416.
[38] Post D M, Pace M L, Hairston N G. Ecosystem size determines food-chain length in lakes. Nature, 2000, 405(6790): 1047- 1049.
[39] Sterner R W, Bajpai A, Adams T. The enigma of food chain length: absence of theoretical evidence for dynamic constraints. Ecology, 1997, 78(7): 2258- 2262.
[40] Hastings A, Powell T. Chaos in a three-species food chain. Ecology, 1991, 72(3): 896- 903.
[41] Post D M, Doyle M W, Sabo J L, Finlay J C. The problem of boundaries in defining ecosystems: A potential landmine for uniting geomorphology and ecology. Geomorphology, 2007, 89(1/2): 111- 26.
[42] Marks J C, Power M E, Parker M S. Flood disturbance, algal productivity, and interannual variation in food chain length. Oikos, 2000, 90(1): 20- 27.
[43] Sprules W G, Bowerman J E. Omnivory and food chain length in zooplankton food webs. Ecology, 1988, 69(2): 418- 426.
[44] Doi H, Chang K H, Ando T, Ninomiya I, Imai H, Nakano S I. Resource availability and ecosystem size predict food-chain length in pond ecosystems. Oikos, 2009, 118(1): 138- 144.
[45] Kelly E N, Schindler D W, St louis V L, Donald D B, Vlaclicka K E. Forest fire increases mercury accumulation by fishes via food web restructuring and increased mercury inputs. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(51): 19380- 19385.
[46] Lepak J M, Kraft C E, Weidel B C. Rapid food web recovery in response to removal of an introduced apex predator. Canadian Journal of Fisheries and Aquatic Sciences, 2006, 63(3): 569- 575.
[47] Vander Zanden M J, Rasmussen J B. A trophic position model of pelagic food webs: impact on contaminant bioaccumulation in lake trout. Ecological Monographs, 1996, 66(4): 451- 477.
[48] Swanson H, Johnston T, Leggett W, Bodaly R A, Doucett R R, Cunjak R A. Trophic positions and mercury bioaccumulation in rainbow smelt (Osmerusmordax) and native forage fishes in northwestern Ontario lakes. Ecosystems, 2003, 6(3): 289- 299.
[49] Williams A J, Trexler J C. A preliminary analysis of the correlation of food-web characteristics with hydrology and nutrient gradients in the southern Everglades. Hydrobiologia, 2006, 569(1): 493- 504.
[50] Hoeinghaus D J, Winemiller K O, Agostinho A A. Hydrogeomorphology and river impoundment affect food-chain length of diverse Neotropical food webs. Oikos, 2008, 117(7): 984- 995.
[51] Power M E, Parker M S, Dietrich W E. Seasonal reassembly of a river food web: floods, droughts, and impacts of fish. Ecological Monographs, 2008, 78(2): 263- 282.
[52] Walters A W, Post D M. An experimental disturbance alters fish size structure but not food chain length in streams. Ecology, 2008, 89(12): 3261- 3267.
[53] Sabo J L, Finlay J C, Kennedy T, Post D M. The role of discharge variation in scaling of drainage area and food chain length in rivers. Science, 2010, 330(6006): 965- 967.
[54] Pringle C. What is hydrologic connectivity and why is it ecologically important?. Hydrological Processes, 2003, 17(13): 2685- 2689.
[55] Arim M, Marquet P A, Jaksic F. On the relationship between productivity and food chain length at different ecological levels. The American Naturalist, 2007, 169(1): 62- 72.
[56] Briand F, Cohen J E. Environmental correlates of food chain length. Science, 1987, 238(4829): 956- 960.
[57] Paine R T. Food webs: linkage, interaction strength and community infrastructure. Journal of Animal Ecology, 1980, 49(3): 667- 685.
[58] Cohen J E, Newman C M. Community area and food-chain length: theoretical predictions. The American Naturalist, 1991, 138(6): 1542- 1554.
[59] Cohen J E, Briand F, Newman C M. A stochastic theory of community food webs Ⅲ. Predicted and observed lengths of food chains. Proceedings of the Royal Society of London Series B, Biological Sciences, 1986, 228(1252): 317- 353.
[60] Arim M, Abades S R, Laufer G, Loureiro M, Marquet P A. Food web structure and body size: trophic position and resource acquisition. Oikos, 2010, 119(1): 147- 153.
[61] Thompson R M, Townsend C R. Energy availability, spatial heterogeneity and ecosystem size predict food-web structure in streams. Oikos, 2005, 108(1): 137- 148.
[62] Post D M, Conners M E, Goldberg D S. Prey preference by a top predator and the stability of linked food chains. Ecology, 2000, 81(1): 8- 14.
[63] Jennings S, Pinnegar J K, Polunin N V C, Trevor W B. Weak cross-species relationships between body size and trophic level belie powerful size-based trophic structuring in fish communities. Journal of Animal Ecology, 2001, 70(6): 934- 944.
[64] Takimoto G, Spiller D A, Post D M. Ecosystem size, but not disturbance, determines food-chain length on islands of the Bahamas. Ecology, 2008, 89(11): 3001- 3007.
[65] Mchugh P A, Mcintosh A R, Jellyman P G. Dual influences of ecosystem size and disturbance on food chain length in streams. Ecology Letters, 2010, 13(7): 881- 890.
[66] Townsend T, Mcintosh K, Edwards S. Disturbance, resource supply, and food-web architecture in streams. Ecology Letters, 1998, 1(3): 200- 209.
[67] Takimoto G, Post D. Environmental determinants of food-chain length: a meta-analysis // Ecological Research. Japan: Springer, 2012: 1- 7.
[68] Calizza E, Costantini M L, Rossi D, Carlino P, Rossi L. Effects of disturbance on an urban river food web. Freshwater Biology, 2012, 57(12): 2613- 2628.
[69] Polis G A, Strong D R. Food web complexity and community dynamics. The American Naturalist, 1996, 147(5): 813- 846.
参考文献:
[33] 徐军, 张敏, 谢平. 氮稳定同位素基准的可变性及对营养级评价的影响. 湖泊科学, 2010, 22(1): 8- 20.
Proximateandultimatedeterminantsoffoodchainlength
WANG Yuyu1, XU Jun2, LEI Guangchun1,*
1SchoolofNatureConservation,BeijingForestryUniversity,Beijing100083,China2DonghuExperimentalStationofLakeEcosystems,StateKeyLaboratoryofFreshwaterEcologyandBiotechnologyofChina,InstituteofHydrobiology,ChineseAcademyofSciences,Wuhan430072,China
Food chain length has been recognized as an important ecosystem characteristic and a fundamental ecosystem attribute: it influences community structure, ecosystem functions and bioaccumulation of contaminants in top predators. Previous studies have shown that food chain length varies greatly among systems. Defining the determinants of food chain length has been a primary research focus for food web ecologists, and has contributed to ecological theories. Three main hypotheses, i.e. resource availability, ecosystem size, and the disturbance hypothesis, which argues that the stability of local dynamics and the level of disturbance contribute to food chain length have been extensively examined. However, much less attention has been paid to proximate changes in food web structure that link variation in food-chain length to the ultimate dynamic mechanism. Proximate mechanisms could cause variation in food-chain length by either: additive mechanism, through addition or removal of top predators; insertion mechanism, through addition or removal of intermediate predators; omnivory mechanisms, changes in the degree of trophic omnivory by the top predator. Recent advances in stable isotope analysis have rekindled interest in examining factors that determine food chain length in ecological communities. In this paper, we reviewed recent studies from close and open freshwater systems to explore the factors that determine the relative importance of resource availability, disturbance and ecosystem size on food chain length, and how they may be affected by food web architecture. We then provided a framework to investigate how these hypotheses operating at different spatial scale. We explore the implications of these mechanisms for understanding how proximate changes in food-web structure link variation in food-chain length to the ultimate mechanism. Finally, we gave suggestions in applying the framework to consolidate the hypotheses across ecosystems in future studies.
food-chain length; resource availability; ecosystem size; disturbance; food web structure;ultimate and proximate mechanism
中央高校基本科研业务费专项资金资助项目(BLX2012023); 国家自然科学基金资助项目(41301077, 31170439)
2013- 06- 06;
2013- 07- 18
*通讯作者Corresponding author.E-mail: guangchun8099@gmail.com
10.5846/stxb201306061370
王玉玉,徐军,雷光春.食物链长度远因与近因研究进展综述.生态学报,2013,33(19):5990- 5996.
Wang Y Y, Xu J, Lei G C.Proximate and ultimate determinants of food chain length.Acta Ecologica Sinica,2013,33(19):5990- 5996.

